10.8:
Teoria do Campo Cristalino - Complexos Octaédricos
10.8:
Teoria do Campo Cristalino - Complexos Octaédricos
Teoria do Campo Cristalino
Para explicar o comportamento observado dos complexos de metais de transição (como cores), foi desenvolvido um modelo que envolve interações eletrostáticas entre os eletrões dos ligandos e os eletrões nas orbitais d não hibridizadas do átomo central de metal. Este modelo eletrostático é a teoria do campo cristalino (TCC). Ela ajuda a perceber, interpretar, e prever as cores, o comportamento magnético, e algumas estruturas de compostos de coordenação de metais de transição.
A TCC concentra-se nos eletrões não ligados no ião de metal central em complexos de coordenação fora das ligações de metal-ligando. Como a teoria da ligação de valência, a TCC conta somente parte da história do comportamento dos complexos. Na sua forma pura, a TCC ignora qualquer ligação covalente entre ligandos e iões metálicos. Tanto o ligando como o metal são tratados como cargas de ponto infinitesimalmente pequenas.
Todos os eletrões são negativos, pelo que os eletrões doados pelos ligandos repelem os eletrões do metal central. Considere o comportamento dos eletrões nas orbitais d não hibridizadas em um complexo octaédrico. As cinco orbitais d consistem em regiões em forma de lóbulo e estão dispostas no espaço como mostra a Figura 1. Em um complexo octaédrico, os seis ligandos coordenam ao longo dos eixos.
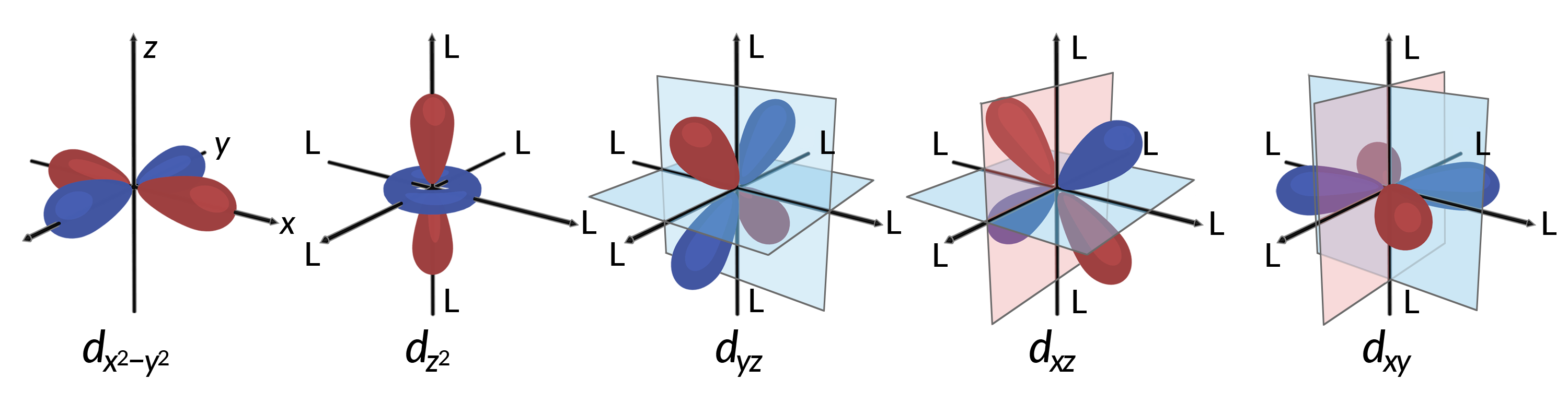
Figura 1. As características direcionais das cinco orbitais d são mostradas aqui. As porções sombreadas indicam a fase das orbitais. Os ligandos (L) coordenam ao longo dos eixos em complexos octaédricos. Para maior clareza, os ligandos foram omitidos da orbital dx2−y2 de modo que as legendas dos eixos pudessem ser mostradas.
Em um ião de metal não complexado em fase gasosa, os eletrões são distribuídos entre as cinco orbitais d de acordo com a regra de Hund porque as orbitais têm todas a mesma energia. Nos complexos de metais de transição, as energias das orbitais d dos átomos de metais de transição são afetadas pelo tipo de ligandos e pela geometria molecular. Se as moléculas de ligando estiverem uniformemente dispostas em torno do ião metálico, é criado um campo cristalino esférico. Este campo cristalino esférico eleva as energias das orbitais d do ião metálico em igual quantidade (Figura 2). Quando os ligandos coordenam com um ião metálico em uma geometria octaédrica, as energias das orbitais d já não são as mesmas.
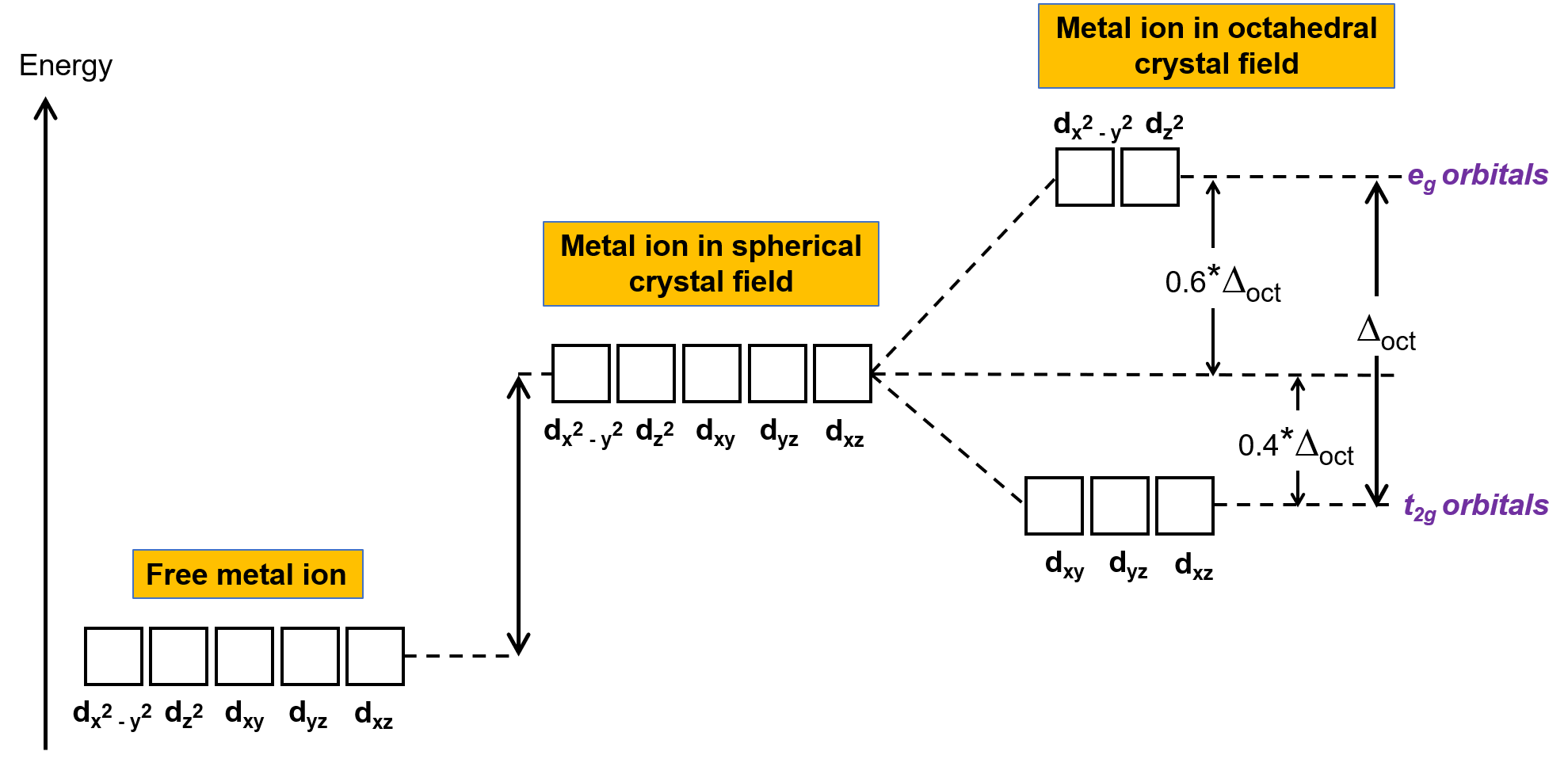
Figura 2. As orbitais d do ião de metal em um campo cristalino esférico estão desestabilizadas (mais elevadas em energia) em comparação com as orbitais d do ião de metal não complexado livre. Em complexos octaédricos, as orbitais eg estão ainda mais desestabilizadas (mais elevadas em energia) em comparação com as orbitais t2g porque os ligandos interagem mais fortemente com as orbitais d para as quais estão diretamente apontados.
Em complexos octaédricos, os lóbulos em duas das cinco orbitais d, as orbitais dx2−y2 e dz2, apontam para os ligandos (Figura 1). Estas duas orbitais são chamadas de orbitais eg (o símbolo refere-se à simetria das orbitais). As outras três orbitais, as orbitais dxy, dxz, e dyz, têm lóbulos que apontam entre os ligandos e são chamadas de orbitais t2g (novamente, o símbolo refere-se à simetria das orbitais). À medida que seis ligandos se aproximam do ião metálico ao longo dos eixos do octaedro, as suas cargas pontuais repelem os eletrões nas orbitais d do ião metálico. No entanto, as repulsões entre os eletrões nas orbitais eg (as orbitais dx2–y2) e os ligandos são maiores do que as repulsões entre os eletrões nas orbitais t2g (as orbitais dxy, dxz, e dyz) e os ligandos. Isto é porque os lóbulos das orbitais eg apontam diretamente para os ligandos, enquanto que os lóbulos das orbitais t2g apontam entre eles. Assim, eletrões nas orbitais eg do ião metálico em um complexo octaédrico têm energias potenciais mais elevadas do que as dos eletrões nas orbitais t2g. A diferença de energia pode ser representada como mostra a Figura 2.
A diferença de energia entre as orbitais eg e t2g é chamada de divisão de campos cristalinos e é simbolizada por Δoct, onde oct significa octaédrico. A magnitude da Δoct depende de muitos factores, incluindo a natureza dos seis ligandos localizados ao redor do ião central de metal, a carga sobre o metal, e se o metal está a usar orbitais 3d, 4d, ou 5d. Diferentes ligandos produzem diferentes divisões de campos cristalinos. A divisão de campo cristalino crescente produzida pelos ligandos é expressa na série espectroquímica, cuja versão curta é dada aqui:
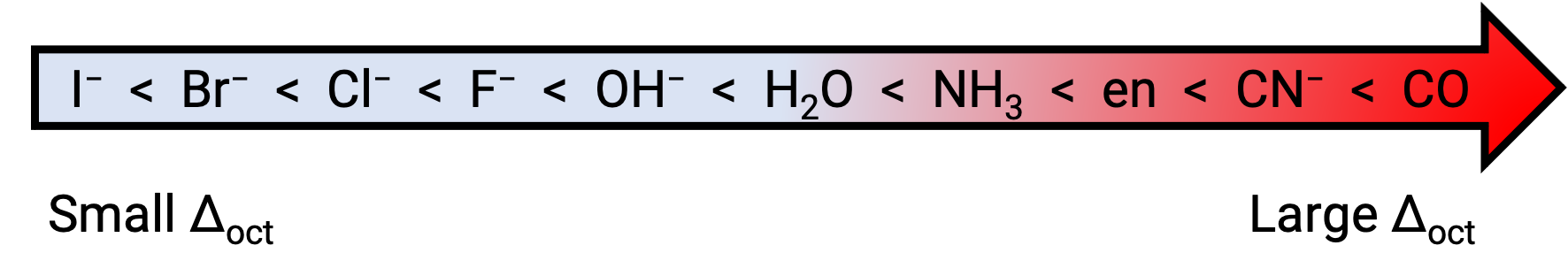
Este texto é adaptado de Openstax, Chemistry 2e, Section:19.3: Spectroscopic and Magnetic Properties of Coordination Compounds.
