10.8:
Kristal Alan Teorisi-Oktahedral Kompleksler
10.8:
Kristal Alan Teorisi-Oktahedral Kompleksler
Kristal Alan Teorisi
Geçiş metali komplekslerinin (renkler gibi) gözlemlenen davranışını açıklamak için, ligandlardan gelen elektronlar ile merkezi metal atomunun köprülenmemiş d orbitallerindeki elektronlar arasındaki elektrostatik etkileşimleri içeren bir model geliştirilmiştir. Bu elektrostatik model kristal alan teorisidir (CFT). Geçiş metallerinin koordinasyon bileşiklerinin renklerini, manyetik davranışlarını ve bazı yapılarını anlamaya, yorumlamaya ve tahmin etmeye yardımcı olur.
CFT, metal-ligand bağları üzerinde değil, koordinasyon komplekslerinde merkezi metal iyonu üzerindeki bağlanmayan elektronlara odaklanır. Değerlik bağı teorisi gibi, CFT de komplekslerin davranış hikayesinin sadece bir kısmını anlatır. Saf haliyle, CFT ligandlar ve metal iyonları arasındaki herhangi bir kovalent bağı göz ardı eder. Hem ligand hem de metal sonsuz küçük nokta yükleri olarak kabul edilir.
Tüm elektronlar negatiftir, bu nedenle ligandlardan bağışlanan elektronlar merkezi metalin elektronlarını itecektir. Oktahedral komplekste hibritleşmemiş d atomu içindeki elektronların davranışlarını göz önünde bulundurun. Beş d orbitali lob şeklindeki bölgelerden oluşur ve Şekil 1’de gösterildiği gibi uzayda düzenlenmiştir. Oktahedral bir kompleks içinde, altı ligand, eksenler boyunca koordine olur.
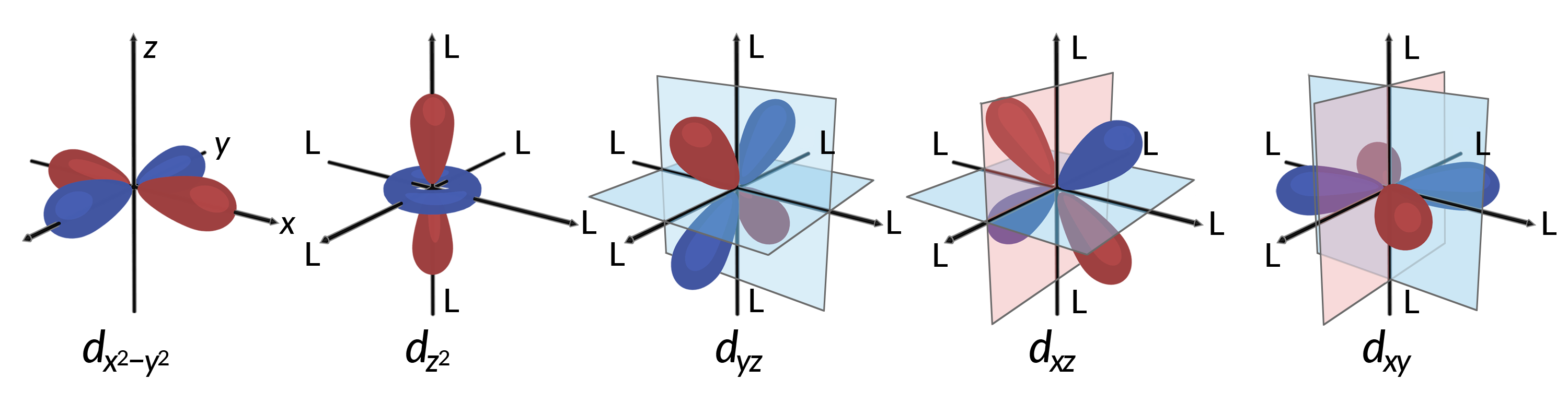
Şekil 1. Beş d orbitalinin yön özellikleri burada gösterilmiştir. Gölgeli kısımlar orbitallerin fazını gösterir. Ligandlar (L) oktahedral komplekslerdeki eksenler boyunca koordine olur. Netlik için, ligandlar dx2−y2 orbitalinden çıkarılmıştır, böylece eksen etiketleri gösterilebilir.
Gaz fazındaki karmaşık olmayan bir metal iyonunda, elektronlar Hund kuralına uygun olarak beş d orbitali arasında dağıtılır, çünkü orbitallerin hepsi aynı enerjiye sahiptir. Geçiş metali komplekslerinde, geçiş metali atomlarının d orbitallerinin enerjileri ligandların türünden ve moleküler geometriden etkilenir. Ligand molekülleri, metal iyonu etrafında düzgün bir şekilde düzenlenirse, küresel bir kristal alan oluşturulur. Bu küresel kristal alan, metal iyonunun d orbitallerinin enerjilerini eşit miktarda yükseltir (Şekil 2). Ligandlar oktahedral geometride bir metal iyonuna koordine olduklarında, d orbitallerinin enerjileri artık aynı değildir.
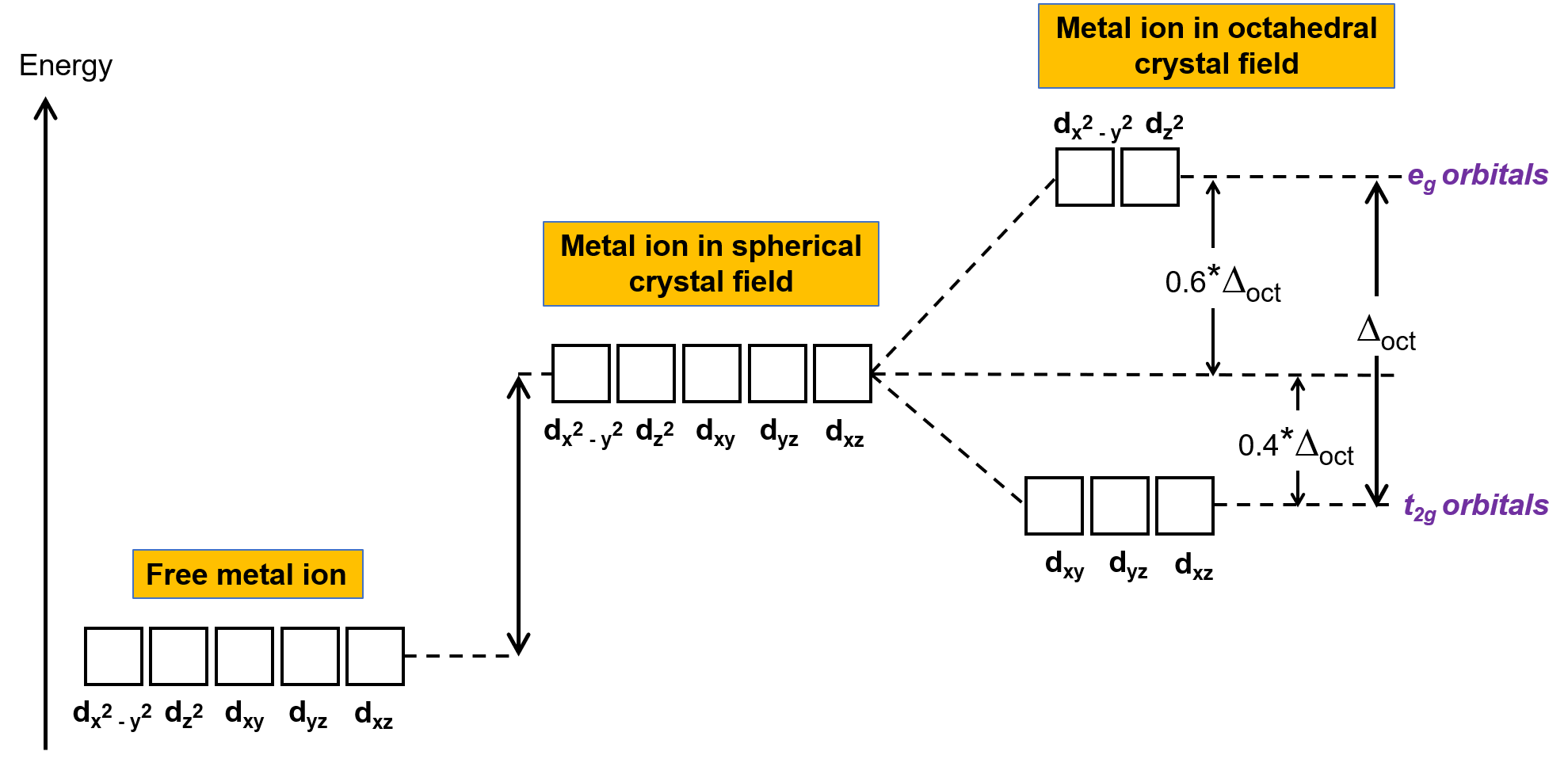
Şekil 2. Küresel bir kristal alandaki metal iyonunun d orbitalleri, kompleks olmayan serbest metal iyonunun d orbitallerine kıyasla dengesizleştirilir (enerjide daha yüksektir). Oktahedral komplekslerde, eg orbitalleri t2g orbitallerine kıyasla daha da dengesizleştirilir (enerjide daha yüksektir), çünkü ligandlar doğrudan işaret ettikleri d orbitalleriyle daha güçlü etkileşime girer.
Oktahedral komplekslerde, beş d orbitalinin ikisindeki loblar, dx2−y2 ve dz2 orbitalleri ligandlara işaret eder (Şekil 1). Bu iki orbital eg orbitalleri olarak adlandırılır (sembol orbitallerin simetrisini ifade eder). Diğer üç orbital, dxy, dxz ve dyz orbitalleri, ligandlar arasında işaret edilen ve t2g orbitalleri olarak adlandırılan loblara sahiptir (yine, sembol orbitallerin simetrisini ifade eder). Altı ligand, oktahedronun eksenleri boyunca metal iyonuna yaklaştıkça, nokta yükleri, metal iyonunun d orbitallerindeki elektronları iter. Bununla birlikte, eg orbitallerindeki elektronlar (dx2−y2 orbitalleri) ve ligandlar arasındaki itmeler, t2g orbitallerindeki elektronlar (dxy, dxz ve dyz orbitalleri) ve ligandlar arasındaki itmelerden daha büyüktür. Bunun nedeni, eg orbitallerinin loblarının doğrudan ligandlara işaret etmesidir, oysa t2g orbitallerinin lobları arasında işaret eder. Bu nedenle, bir oktahedral kompleksteki metal iyonunun eg orbitallerindeki elektronlar, t2g orbitallerindeki elektronlardan daha yüksek potansiyel enerjilere sahiptir. Enerji farkı, Şekil 2’de gösterildiği gibi temsil edilebilir.
eg ve t2g orbitalleri arasındaki enerji farkına kristal alan bölünmesi denir ve oct’nin oktahedral anlamına geldiği Δoct ile sembolize edilir. Δoct‘nin büyüklüğü, merkezi metal iyonu etrafında bulunan altı ligandın doğası, metal üzerindeki yük ve metalin 3d,4d veya 5d orbitalleri kullanıp kullanmadığı dahil olmak üzere birçok faktöre bağlıdır. Farklı ligandlar farklı kristal alan bölünmeleri üretir. Ligandlar tarafından üretilen kristal alanın artan bölünmesi, kısa bir versiyonu burada verilen spektrokimyasal serilerde ifade edilir:
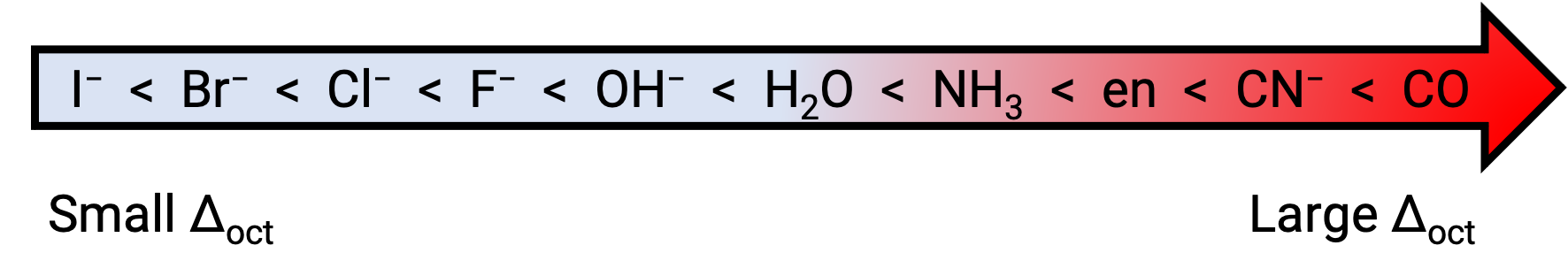
Bu metin bu kaynaktan uyarlanmıştır: Openstax, Chemistry 2e, Section:19.3: Spectroscopic and Magnetic Properties of Coordination Compounds.
