Introduction
Imágenes (fotoacústica) optoacústica atrae cada vez mayor interés por parte de las comunidades de investigación biológica y médica, tal como se manifiesta por el cada vez mayor número de publicaciones que abarcan gran variedad de nuevas aplicaciones que aprovechan las ventajas únicas que ofrece la tecnología de 1-5. En particular, la capacidad de imagen espectral distintivos agentes de absorción de fotos con resolución espacio-temporal de alto a profundidades que van más allá del límite de difusión de la luz se abre capacidades sin precedentes para la proyección de imagen funcional y molecular 6-10.
De hecho, la traducción de la tecnología en la práctica clínica optoacústica viene con perspectivas prometedoras en el diagnóstico y la monitorización del tratamiento de muchas enfermedades. Sin embargo, la limitada propagación de fotones en la dispersión ópticamente y tejidos absorbentes y las respuestas débiles generalmente asociados con el fenómeno optoacústica limitar la profundidad de aplicación del método. Como resultado, optoa de manosondas Coustic se han intentado partes de imagen accesible desde el exterior del cuerpo 11,12 mientras que los sistemas endoscópicos se utilizan para proporcionar imágenes del interior del cuerpo mediante la inserción de ellos a través de orificios naturales 13. Algunas partes de baja absorción del cuerpo humano, tales como la mama de la mujer, también se puede acceder por los escáneres tomográficos optoacústica 14,15. De particular interés es el enfoque de mano, ya que permite gran versatilidad, de manera similar a la ecografía. Aquí, la adaptación de los ultrasonidos común gama de sondas lineales para imágenes optoacústica sigue siendo un reto, debido principalmente a diferencias fundamentales en los requisitos de formación de imágenes tomográficas entre ultrasonido y optoacoustics. Mientras altas velocidades de cuadro en la ecografía estándar están habilitadas por secuencial de transmisión-recepción esquemas que emplean frecuencias de repetición de pulso de alta en el rango de kHz, optoacústica de imágenes en tiempo real en tres dimensiones se consigue por la recolección simultánea de datos de tomografía volumétrica de una sola interrogating pulso de láser. Por lo tanto, la imagen optoacústica de alta calidad implica la adquisición de datos tridimensionales a partir de la más grande de ángulo sólido posible alrededor del objeto fotografiado.
Recientemente, se introdujo la primera sonda optoacústica de mano para tres dimensiones (volumétrica) de imágenes en tiempo real 16. El sistema se basa en una matriz bidimensional de elementos piezoeléctricos 256 dispuestos sobre una superficie esférica (puntos azules en la figura 1A) que cubren un ángulo de 90 °. El tamaño de los elementos individuales de aproximadamente 3 x 3 mm 2, así como su orientación y ancho de banda de frecuencia (aproximadamente 2-6 MHz) garantizan colección señal efectiva de un volumen centímetro escala que rodea el centro de la esfera (cubo negro en la figura 1A). Excitación óptica de la región de formación de imágenes está provisto de un haz de fibras insertado a través de una cavidad cilíndrica central de la matriz, de modo que cualquier longitud de onda SUSCeptible de ser transmitida a través del haz de fibras se puede utilizar para la imagen. Una imagen real de la matriz de transductores junto con el haz de fibras ópticas se muestra en la Figura 1B. La excitación eficiente y la detección simultánea de las señales permite formación de imágenes de tejido profundo con excitación de disparo único (un pulso láser), de modo que imágenes en tiempo real a una velocidad determinada por la frecuencia de repetición de impulsos del láser se activa adicionalmente con un Graphics- procesamiento de unidades (GPU) aplicación del procedimiento de reconstrucción 17. Una carcasa cilíndrica con una membrana de polietileno transparente (Figura 1C) se une a la matriz de transductores para encerrar un medio líquido acústicamente transmitir (agua). La membrana está acoplado además al tejido por medio de gel acústico. Una imagen de la sonda optoacústica como se utiliza en el modo de operación de mano se muestra en la Figura 1D.
La THR demostradoee de imágenes de mano dimensional optoacústica combinada con la capacidad de formación de imágenes en tiempo real funcional venir con ventajas importantes para el diagnóstico clínico y una serie de aplicaciones potenciales se prevé para diversas indicaciones, tales como la enfermedad vascular periférica, trastornos del sistema linfático, cáncer de mama, lesiones de la piel, inflamación o artritis 18. Además, la capacidad de formación de imágenes permite la visualización rápida de acontecimientos biológicos dinámicos con la sonda dispuesta en una posición estacionaria. Combinado con la longitud de onda de ajuste rápido oscilador paramétrico óptico (OPO) la tecnología láser, este enfoque permite la formación de imágenes en tiempo real de la biodistribución de agentes de absorción de fotos. De esta manera, las nuevas posibilidades pueden surgir igualmente en pequeñas aplicaciones de imágenes de animales, por ejemplo., En el estudio de la hemodinámica del tejido, el seguimiento in vivo de células, la visualización de la farmacocinética, la perfusión de órganos, dirigido imagen molecular de los tumores y el sistema cardiovascular, o la neuroimagen.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
El procedimiento detallado para operar con la sonda optoacústica volumétrica manual se describe a continuación. Este procedimiento se realiza de acuerdo a las regulaciones institucionales aprobados en relación con los experimentos en animales y humanos.
1. Sistema de Preparación
- Encender el láser durante un período de calentamiento de ~ 15 min antes de la operación para la estabilización del haz de luz de salida.
- Coloque la parte de agua que encierra con la membrana de aislamiento que está en contacto con la piel (Figura 1).
NOTA: La distancia entre la membrana de aislamiento (en contacto con la piel) y la región con la máxima sensibilidad del transductor (centro de la sonda esférica) establece la profundidad de formación de imágenes eficaz. - Llenar todo el volumen de aproximadamente 100 ml de aislamiento entre la membrana y la superficie del transductor con agua desionizada por medio de una bomba.
- Asegúrese de que no hay fugas de agua ni burbujas de aire son present. Por otra parte, evitar las burbujas de aire, proporcionando la recirculación de agua.
- Realizar los experimentos a temperatura ambiente y asegurar el medio de acoplamiento (agua) se mantiene a esta temperatura.
2. Preparación Imaging
- Preparación de imágenes humano.
- Eliminar el vello de la parte al-fotografiada-estar con una loción de depilación con el fin de evitar un fondo no deseado en las imágenes (este paso es opcional).
- Aplicar gel de ultrasonido sobre la piel alrededor de la región para formar una imagen con el fin de proporcionar un acoplamiento acústico eficiente. Coloque la sonda optoacústica en la región de interés. Asegúrese de que no haya burbujas de aire en el gel de acoplamiento de ultrasonido.
- Preparación de imágenes de animales.
- Asegúrese de que los procedimientos de atención y experimentales con animales están de acuerdo con las normas y reglamentos institucionales y gubernamentales.
- Retire la piel del animal en la región para obtener imágenes con una loción de afeitar. Proteger los ojos del animal conungüento veterinario, lo que evita la sequedad y los daños causados por la exposición a la radiación láser pulsada intensa.
- Anestesiar al animal mediante el uso de la inyección intraperitoneal (IP) de ketamina / xilazina (100 mg / kg de ketamina kg + 5 mg / kg kg de xilazina) antes del experimento o utilizar anestesia con isoflurano (2-3% (en volumen) con 0,9 l / flujo de gas min) durante el experimento. Confirmar anestesia comprobando el reflejo de la extremidad posterior del animal.
- Aplicar gel de ultrasonido sobre la piel alrededor de la región a ser fotografiado con el fin de proporcionar un acoplamiento acústico eficiente y colocar la sonda optoacústica en la región de interés. Asegúrese de que no haya burbujas de aire en el gel de acoplamiento de ultrasonido.
3. Pre-vista del modo de funcionamiento
- Establecer la longitud de onda de formación de imágenes (s) entre 690 nm y 900 nm y la tasa de repetición de impulsos entre 10 y 50 Hz. Seleccione los parámetros para el sistema de adquisición de datos acústicos - 1 MWimpedancia de entrada. Adquirir 2.030 muestras para cada pulso de láser a una frecuencia de muestreo de 40 megamuestras por segundo y 12 bits de resolución vertical. Desencadenar la adquisición con la salida Q-switch del láser.
- Asegúrese de que tanto el operador y el paciente utilizar gafas de protección adaptadas a la longitud de onda (s) de excitación óptica. Ajustar la potencia del láser de manera que se mantiene la fluencia de luz en la superficie del tejido por debajo de 20 mJ / cm 2 durante el experimento para longitudes de onda del infrarrojo cercano con el fin de satisfacer los límites de exposición de seguridad para los experimentos humanos 19 y para evitar tensión térmica y daños en la piel en los animales .
- Iniciar el software pre-view con una implementación de algoritmos de procesamiento de GPU para permitir la visualización de imágenes en tres dimensiones a una velocidad correspondiente a la tasa de repetición de impulsos del láser.
- Mueva la sonda y / o el objeto a ser reflejado con el fin de optimizar el rendimiento de visualización y localización de las estructuras de interés.
4. Adquisición de Datos
- La adquisición de datos para el modo de exploración (de mano).
- Si es necesario, inyectar un agente de contraste antes de la adquisición de enriquecer el contraste en la región de interés.
NOTA: En nuestros experimentos no hemos realizado la imagen humana con contraste. Sin embargo, diversos agentes de contraste pueden ser potencialmente utilizados para este propósito. Verde de indocianina (ICG) es un ejemplo de agente de contraste óptico aprobado clínicamente que se puede utilizar para la mejora del contraste en dosis máxima recomendada de 2 mg / kg de peso corporal en los adultos. - Iniciar el hardware para la adquisición de datos con los parámetros descritos en 3,1 manteniendo la ejecución del software de vista previa. Mueva suavemente la sonda alrededor de la región fotografiada para realizar un seguimiento de las estructuras de interés.
NOTA: Cuando las imágenes en múltiples longitudes de onda láser se adquieren simultáneamente, la velocidad del movimiento de la sonda en el modo de mano tiene que ser disminuido significativamente (preferiblemente por debajo de 2 mm / segpara una tasa de repetición de impulsos de láser de 50 Hz) con el fin de evitar artefactos relacionados con el movimiento en las imágenes espectralmente sin mezclar. - La adquisición de datos para el modo estacionario.
- Monte el objeto fotografiado (ej., Los animales) y la sonda de mano en el soporte e iniciar la adquisición con los parámetros descritos en el punto 3.1, manteniendo la ejecución del software pre-vista.
- Mantener la sonda optoacústica y la parte de formación de imágenes en la misma posición durante el experimento para visualizar los eventos biológicos dinámicos en la región de interés.
- Inyectar un agente de contraste para rastrear su distribución dinámica en la región de interés.
NOTA: En nuestros experimentos con ratones, verde de indocianina (ICG) se utilizó para la mejora del contraste. Como pauta general, una cantidad de 10 nmol o 0,4 mg / kg de ICG tiene que ser introducido en la circulación del ratón con el fin de crear un contraste detectable con optoacoustics multi-espectrales en vivo.
NOTA: El agente de contraste debe seraprobado para uso humano y / o animal por la autoridad respectiva.
5. Finalización del Experimento
- Detenga el láser.
- Retire la sonda optoacústica de la región fotografiada. Para el estudio de los animales, detener el suministro de anestesia.
- Colocar el animal en un calentador de infrarrojos para mantener el calor y evitar el contacto con otros animales hasta que se recuperó de la anestesia. No deje que el animal sin vigilancia durante la recuperación de la anestesia.
6. Fuera de línea de procesamiento de datos
- Cargue el archivo (s) que contiene las señales optoacústica adquiridas en la aplicación de software utilizadas para el procesamiento de datos.
- Utilice un algoritmo de reconstrucción para obtener una matriz de matriz tridimensional correspondiente a una imagen volumétrica de la absorción óptica de cada fotograma y cada longitud de onda.
NOTA: Para la reconstrucción, es preferible utilizar un algoritmo que representa factores de distorsión, como heterogéneodades y la atenuación en el objeto fotografiado, efectos de ancho de banda final y forma geométrica de los elementos de detección y variaciones de la luz de fluencia, a fin de obtener una representación más cuantitativa de la distribución de la energía absorbida. - Usa un algoritmo de desmezcla para obtener, a partir de cada trama de múltiples longitudes de onda, un nuevo conjunto de matrices de la matriz tridimensional que representa la absorción óptica para cada sustancia absorbente presente en la muestra.
- Si es necesario, procesar aún más los conjuntos de matriz que representa la distribución de absorción óptica para facilitar la visualización y la lectura de los parámetros biológicamente relevantes.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Los resultados representativos, lo que demuestra la capacidad de la sonda optoacústica de mano volumétrico descrito, se exhiben en esta sección. En todos los casos, la fluencia de la luz en la superficie de la piel se mantuvo por debajo del límite de exposición seguridad de 20 mJ / cm 2 19.
El rendimiento de la sonda en tiempo real el seguimiento de la vasculatura periférica humana se mostró en la Figura 2. Durante el curso de este experimento, la sonda se escaneó lentamente a lo largo de la mano de un voluntario humano sano en una sola longitud de onda de 800 nm con el láser operativo a 10 pulsos por segundo 17, de manera que la visualización en tiempo real de los vasos sanguíneos para todas las posiciones de escaneado se consigue. La proyección de intensidad máxima representante (MIP) de las imágenes reconstruidas en las tres direcciones se muestran en la Figura 2. Visualización en tiempo real durante la medición se activa con un implementatio GPUn del filtrado algoritmo de retroproyección 17.
La capacidad de formación de imágenes multiespectrales en tiempo real se mostró en la Figura 3. Específicamente, las mediciones se realizaron mediante el escaneo de la sonda a lo largo de la muñeca de un voluntario sano que tiene vasos sanguíneos de diferentes tamaños y niveles de saturación de oxígeno, así como una pigmentación de la piel melanina ricos 10. Un láser de tasa de repetición de impulsos de 50 Hz con una capacidad de ajuste de longitud de onda en una base por pulso fue empleado en este caso. El láser fue sintonizado a múltiples longitudes de onda entre 730 y 850 nm con 30 nm de paso (5) longitudes de onda, que corresponde a una disminución monotónica en la absorción de la melanina, un aumento monotónico en la absorción de la hemoglobina oxigenada y un pico característico en la absorción de desoxigenada hemoglobina. Adquisición de la totalidad de un conjunto de datos multiespectrales tarda sólo 100 ms debido a la capacidad de ajuste rápido del láser. Las imágenes MIP a lo largo de la profundidaddirección para 3 longitudes de onda diferentes, que corresponden a la misma posición de la sonda, se muestran en la Figura 3A. Figura 3B muestra la distribución sin mezcla de hemoglobina oxigenada (HBO 2), la hemoglobina desoxigenada (HBR) y la melanina en rojo, azul y amarillo, respectivamente , mientras que fue asumido, además, que la absorción se debió exclusivamente a estos tres componentes cromóforos. De este modo, las estructuras de rojo y azul en la Figura 3, probablemente, representan arterias y venas, respectivamente, mientras que la mancha amarilla corresponde a la pigmentación de la piel. Absorción de la luz fuerte por la melanina puede reducir la profundidad de penetración es aplicable para este método en personas de piel oscura, aunque más pruebas es claramente necesario para sacar conclusiones cuantitativas.
La Figura 4 ilustra la capacidad de la formación de imágenes in vivo de procesos dinámicos. En la presente memoria, la circulación en el dedo medio era obstructed por medio de una banda de goma y liberado durante la adquisición de datos 18. Una secuencia de imágenes de longitud de onda individuales fue adquirida en 10 fotogramas por segundo como se determina por la tasa de repetición de impulsos del láser. Cuatro imágenes MIP a lo largo de las direcciones laterales y de profundidad espaciados por 1 seg se exhiben, donde la segunda imagen corresponde al instante después se restableció la circulación. La longitud de onda se fijó a 900 nm, de modo que la amplitud de las señales de optoacústica se incrementa tanto con el volumen sanguíneo y la oxigenación de la sangre.
Finalmente, la Figura 5 demuestra la capacidad del sistema establecido para rastrear la dinámica de perfusión en una región tridimensional de un ratón mediante el uso de ICG como agente de contraste 9. Un niño de ocho semanas de edad, desnudo femenino de CD-1 de ratón se utilizó para los experimentos in vivo. El procedimiento experimental se mostró de acuerdo con las reglas y regulaciones del gobierno institucional y bávaros. La vasculatura del cerebro erafotografiada por el posicionamiento de la del ratón en una posición y 2% de isoflurano en decúbito supino con oxígeno puro se utilizó para la anestesia. Vet pomada se utiliza para proteger los ojos del ratón. 10 nmol de ICG diluido en 50 ml de solución salina se inyectó 5 seg después de comenzar la adquisición de datos optoacústica. La longitud de onda del láser se sintoniza a 730, 760, 800, 850 y 900 nm en una base por pulsos a una velocidad de 50 veces por segundo. Para cada conjunto de longitudes de onda, la distribución ICG fue sin mezclar suponiendo que la absorción óptica es sólo debido a este agente, así como las formas oxigenada y desoxigenada de la hemoglobina. Las imágenes MIP a lo largo de la dirección de profundidad correspondiente a la distribución ICG sin mezclar durante 5 instantes diferentes se muestran en la Figura 5A (tiempo después de la inyección también se indica). El espectro de absorción de ICG en plasma se muestra en la Figura 5B. Este experimento en particular demuestra que el enfoque propuesto es capaz de simultané ormente representación verdaderamente de cinco dimensiones (es decir, tiempo de resolverse espectralmente enriquecido tridimensional) de datos de tomografía, que se utiliza posteriormente para reconstruir y espectralmente unmix la distribución de diversos cromóforos intrínsecas y agentes exógenos en tiempo real.
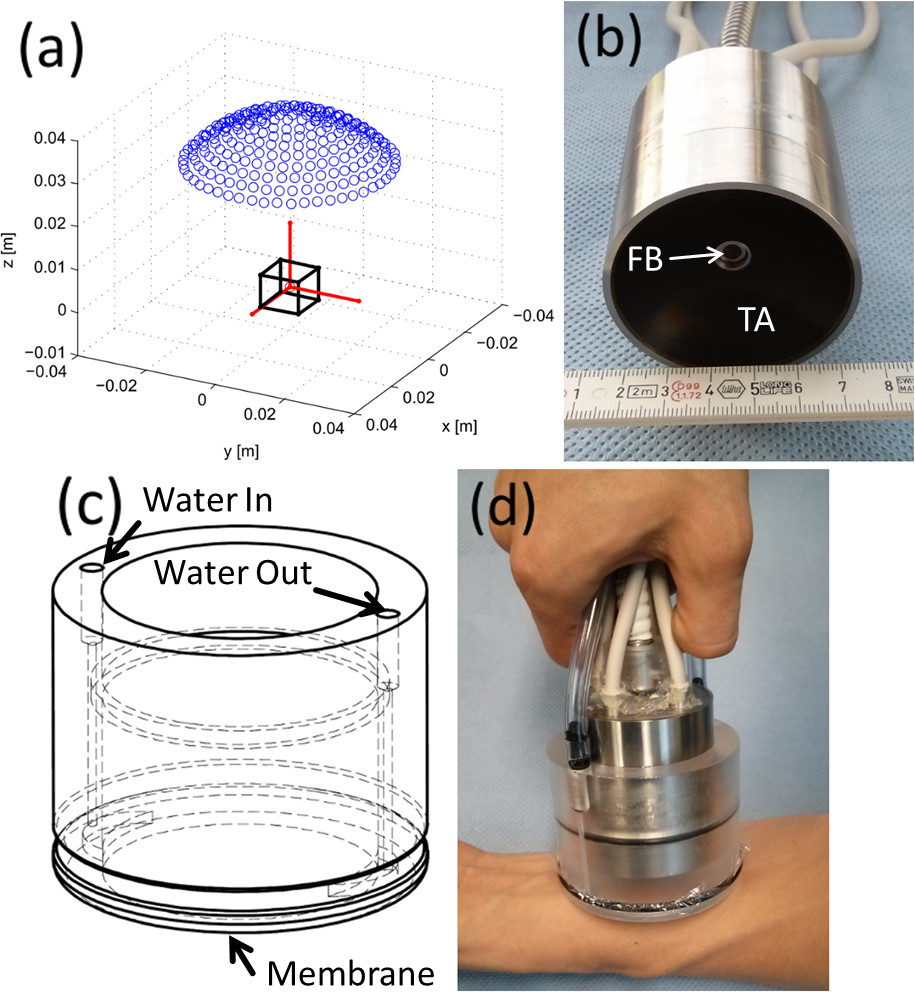
Figura 1: Disposición de la sonda optoacústica tridimensional de mano (A) Distribución de los elementos piezoeléctricos (puntos azules) con respecto a la región de interés (cubo negro) (B) Imagen real de la matriz de transductores (TA.. ) y haz de fibras (FB). (c) agua que encierra parte. (D) Imagen real de la sonda optoacústica como siendo utilizado en el modo de operación de mano. .jpg "target =" _ blank "> Haga clic aquí para ver una versión más grande de esta cifra.
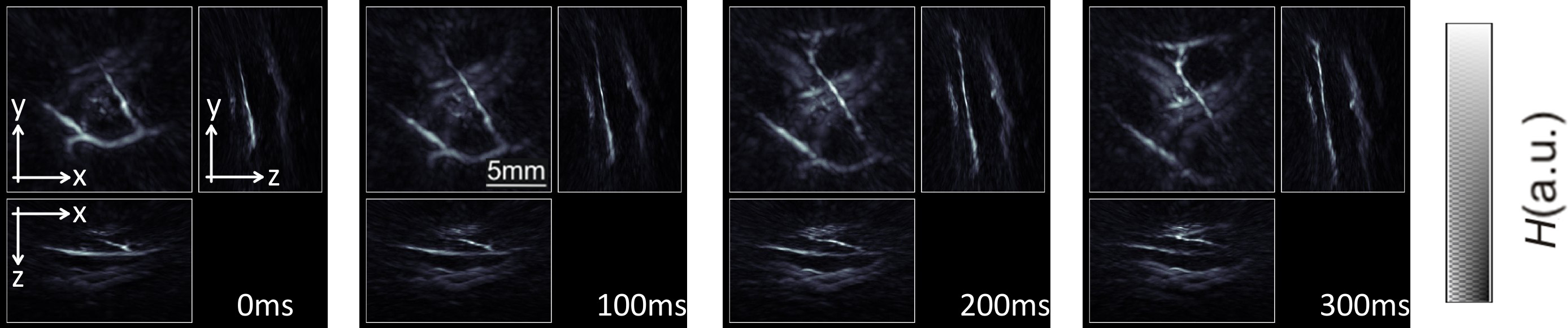
Figura 2: Seguimiento de la vasculatura periférica humana imágenes de proyección intensidad máxima de absorción óptica a lo largo de las tres direcciones cartesianas para cuatro imágenes consecutivas.. Aquí el láser se hizo funcionar a 10 pulsos por segundo con una longitud de onda constante ajustado a 800 nm. El esquema de color de escala de grises representa la intensidad de H absorción óptica en el objeto en unidades arbitrarias. Por favor, haga clic aquí para ver una versión más grande de esta cifra.
s.jpg "width =" 700 "/>
Figura 3:. De formación de imágenes de mano de cromóforos endógenos específicos (A) imágenes de proyección máxima intensidad de absorción óptica a lo largo de la dirección de profundidad para tres longitudes de onda diferentes correspondientes a tres pulsos consecutivos. En este caso, el láser funciona a 50 pulsos por segundo (la sonda no se movió). (B) imágenes espectralmente sin mezclar que muestra la distribución de la hemoglobina y la melanina oxigenada y desoxigenada. Haga clic aquí para ver una versión más grande de esta cifra.
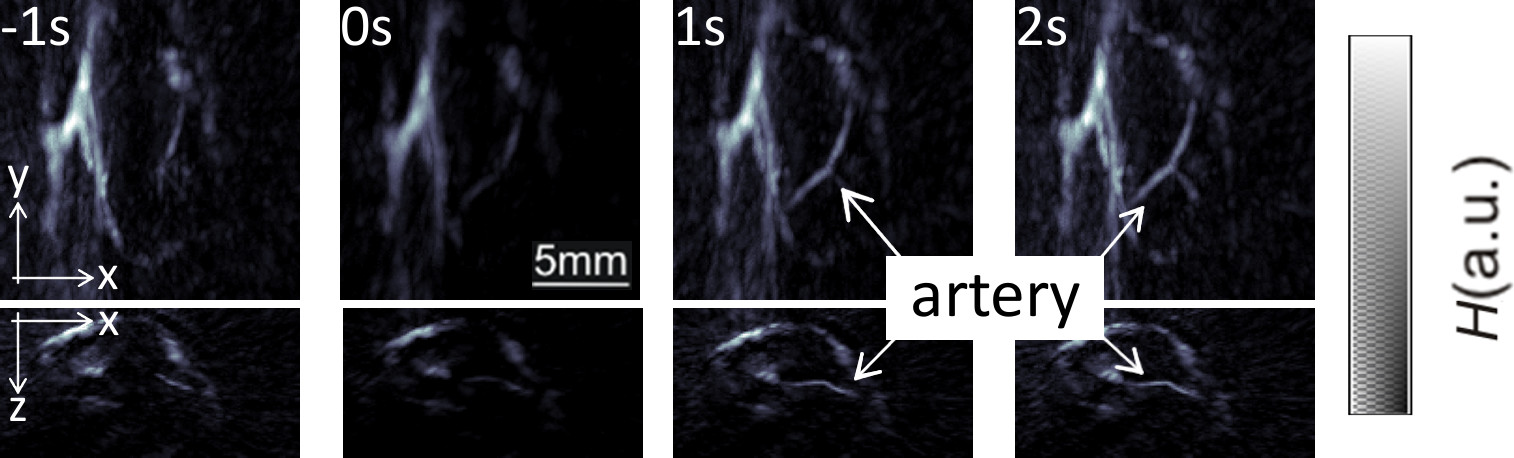
Figura 4:. Imágenes en tiempo real del flujo sanguíneo imágenes de proyección intensidad máxima de absorción óptica a lo largo de la profundidad ydirecciones laterales correspondientes a cuatro instantes diferentes. La circulación en el dedo medio fue bloqueada antes del experimento y se libera durante el experimento (a 0 segundos). Por favor, haga clic aquí para ver una versión más grande de esta cifra.
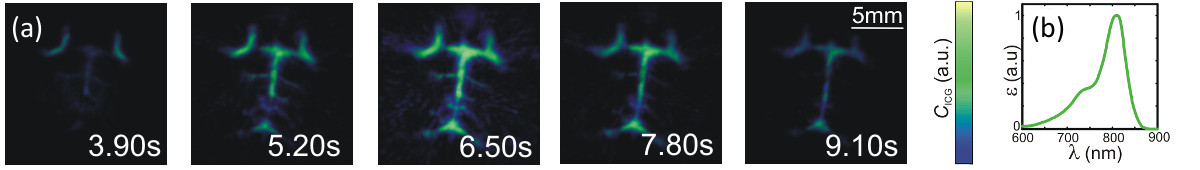
Figura 5: una imagen en tiempo real de la distribución de agente de contraste óptico en ratones (A) Distribución del agente de contraste de ICG (proyección de intensidad máxima a lo largo de la dirección de profundidad) durante cuatro instantes diferentes después de la inyección del agente (a 0 seg).. (B) Espectro de Extinción de ICG en el plasma. Haga clic aquí para ver una versión más grande de tsu figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Las ventajas únicas que ofrece técnicas de imagen optoacústica en la investigación con animales pequeños han creado una fuerte motivación para la traducción de la tecnología en la práctica clínica, con una serie de diagnósticos y aplicaciones de monitoreo de tratamiento previstas por ejemplo., En el cáncer de piel de la mama y, inflamación o enfermedades vasculatura periférica. Sin embargo, a diferencia de los ratones o animales más pequeños, que pueden estar rodeado de un número suficiente de fuentes de iluminación y los elementos de detección para crear una geometría de adquisición de imagen tomográfica eficaz, las grandes dimensiones del cuerpo humano y la aplicación dificultan la penetración óptica limitada de todo el cuerpo tomografía optoacústica similar a la resonancia magnética o tomografía computarizada. La sonda de imagen optoacústica portátil presentado es ideal para la imagen humana ya que comparte muchas de las ventajas de la ecografía, como el uso portátil, de alta resolución, la excitación no ionizantes y la capacidad en tiempo real. Sin embargo, el diseño de hardware óptima y recoNSTRUCCIÓN procedimientos para formación de imágenes optoacústica difieren significativamente de los utilizados comúnmente en los escáneres de ultrasonido. Esto es debido a las diferencias fundamentales entre las características operativas óptimas de las dos modalidades, tales como la frecuencia de repetición de impulsos, la amplitud de las respuestas ultrasónicas detectadas, los mecanismos de excitación de la señal subrayado y los enfoques de reconstrucción de imágenes resultantes. En particular, optoacoustics es inherentemente una técnica de imagen tridimensional como completos conjuntos de datos tomográficos volumétrica del objeto fotografiado, en principio, pueden ser generados con un solo pulso láser de interrogación, como también se demostró en este trabajo. Por otra parte, una adaptación de la sonda para proporcionar simultáneamente imágenes de ultrasonido puede ser implementado y se mantiene como un paso futuro en nuestra agenda de investigación.
En comparación con otras modalidades de imágenes clínicas bien establecidas, tales como la resonancia magnética (RM) o de rayos X de tomografía computarizada (TC), optoatomografía Coustic no es una modalidad de imagen de todo el cuerpo, pero puede proporcionar un contraste significativamente más rica y específica basada en interrogatorios luz de los tejidos. De hecho, el contraste de absorción óptica endógena no sólo entregar alta resolución morfología de los tejidos, pero también hace que la información molecular funcional y potencialmente selectiva de gran importancia para la toma de decisiones clínicas. La capacidad de imagen molecular está más fuertemente apoyada por la significativamente mayor disponibilidad de agente de contraste se acerca de los métodos de formación de imágenes ópticas en comparación los que están disponibles para la otra imagen modalidades 20,21. Además, la alta resolución temporal del enfoque optoacústica demostrado aquí, es decir., Alta velocidad de cuadro (en tiempo real) de formación de imágenes en tres dimensiones, generalmente no está disponible con cualquier otra modalidad actualmente en uso clínico o de laboratorio. Por último, la adquisición simultánea de datos multi-longitud de onda trae una quinta dimensión adicional en el volumet tiempo realric visualización que permite realizar observaciones espectroscópicas verdaderos tridimensionales de cromóforo tejidos y biodistribuciones bio-marcadores específicos.
Las aplicaciones potenciales de una sonda de mano optoacústica tridimensional no se limitan a la imagen clínica, pero también puede representar una herramienta muy importante en la investigación biológica con modelos animales. De hecho, los animales más grandes que los ratones generalmente no son adecuados para ser fotografiado en un sistema optoacústica tomográfico y el enfoque de mano es probablemente más conveniente. Además, volumétrica (tridimensional) de formación de imágenes de ciertas regiones en tiempo real con contraste óptico y la resolución de ultrasonido representa una ventaja única en el estudio de la administración de fármacos, cambios hemodinámicos o la farmacocinética.
En conclusión, se espera que la metodología introducida para imágenes optoacústica de mano le pedirá traducción clínica de la tecnología y avanzar significativamente preclínica y binvestigación iológica en muchas fronteras también.
Subscription Required. Please recommend JoVE to your librarian.
Materials
| Name | Company | Catalog Number | Comments |
| Optical parametric oscillator (OPO)-based laser | Innolas Laser GmbH, Krailling (Germany) | custom-made | The laser provides laser pulses with a duration around 10 nsec and an energy up to 80 mJ. The wavelength is tunable between 680-950 nm. |
| Spherical array of piezocomposite detectors | Imasonic SaS, Voray (France) | custom-made | The array consists of 256 piezoelectric sensors distributed on a spherical surface. Each element has dimensions 3 x 3 mm2, a central frequency of 4 MHz and a bandwidth of 100%. |
| Data acquisition system (DAQ) | Falkenstein Mikrosysteme GmbH, Taufkirchen (Germany) | custom-made | The DAQ simultaneously acquires 256 signals at 40 megasamples per second and 2,030 samples. The input impedance is 1 MW. |
| Fiber bundle | CeramOptec GmbH, Bonn (Germany) | custom-made | The bundle consists of 480 individual fibers randomly distributed in the input and output. The numerical aperture of each individual fiber is 0.22. |
| Athymic nude mouse | Harlan Laboratories (The Netherlands) | Athymic nude - Foxn1nu | The mouse was 8 weeks old (adult) at the time of the experiment. The ethical protocol was approved by the Bavarian goverment (number 55.2.1.54-2632-102-11) |
| Bepanthen cream | Bayer AG (Germany) | Vet ointment to protect the eyes during anesthesia | |
| Data processing software | Matlab (Mathworks, Natick, MA, USA) | custom-made | The data processing software was devoped at our institute. It allows reconstruction at each wavelength and multi-wavelength unmixing, as well as further data processing. |
| Water-enclosing part | custom-made | This part contains the water that acts as an acoustic coupling medium between skin and transducer elements | |
| Indocyanine green (ICG) | PULSION Medical Systems SE | ICG-PULSION (active ingredient: indocyanine green dye) is a drug used in cardiac, circulatory and micro-circulatory diagnostics, liver function diagnostics and ophthalmic angiography diagnostics. |
References
- Stritzker, J., et al. Vaccinia virus-mediated melanin production allows MR and optoacoustic deep tissue imaging and laser-induced thermotherapy of cancer. Proceedings of the National Academy of Sciences of the United States of America. 110 (9), 3316-3320 (2013).
- Herzog, E., et al. Optical Imaging of Cancer Heterogeneity with Multispectral Optoacoustic Tomography. Radiology. 263 (2), 461-468 (2012).
- Johnson, S. P., Laufer, J. G., Zhang, E. Z., Beard, P. C., Pedley, R. B. Determination of Differential Tumour Vascular Pathophysiology in Vivo by Photoacoustic Imaging. Eur J Cancer. 48, 186-187 (2012).
- Yao, J. J., et al. Noninvasive photoacoustic computed tomography of mouse brain metabolism in vivo. Neuroimage. 64, 257-266 (2013).
- Strohm, E. M., Berndl, E. S. L., Kolios, M. C. High frequency label-free photoacoustic microscopy of single cells. Photoacoustics. 1 (3-4), 49-53 (2013).
- Beard, P. Biomedical photoacoustic imaging. Interface Focus. 1, 602-631 (2011).
- Wang, L. H. V., Hu, S. Photoacoustic Tomography: In Vivo Imaging from Organelles to Organs. Science. 335 (6075), 1458-1462 (2012).
- Xiang, L. Z., Wang, B., Ji, L. J., Jiang, H. B. 4-D Photoacoustic Tomography. Sci Rep-Uk. 3, 10-1038 (2013).
- Buehler, A., Dean-Ben, X. L., Claussen, J., Ntziachristos, V., Razansky, D. Three-dimensional optoacoustic tomography at video rate. Optics express. 20 (20), 22712-22719 (2012).
- Dean-Ben, X. L., Razansky, D. Adding fifth dimension to optoacoustic imaging: volumetric time-resolved spectrally-enriched tomography. Light: Science and Applications. 3, (2014).
- Fronheiser, M. P., et al. Real-time optoacoustic monitoring and three-dimensional mapping of a human arm vasculature. J Biomed Opt. 15 (2), (2010).
- Buehler, A., Kacprowicz, M., Taruttis, A., Ntziachristos, V. Real-time handheld multispectral optoacoustic imaging. Opt Lett. 38 (9), 1404-1406 (2013).
- Yang, J. M., et al. Simultaneous functional photoacoustic and ultrasonic endoscopy of internal organs in vivo. Nat Med. 18 (8), 1297-1302 (2012).
- Kruger, R. A., Lam, R. B., Reinecke, D. R., Del Rio, S. P., Doyle, R. P. Photoacoustic angiography of the breast. Med Phys. 37 (11), 6096-6100 (2010).
- Heijblom, M., et al. Visualizing breast cancer using the Twente photoacoustic mammoscope: What do we learn from twelve new patient measurements. Optics express. 20 (11), 11582-11597 (2012).
- Dean-Ben, X. L., Razansky, D. Portable spherical array probe for volumetric real-time optoacoustic imaging at centimeter-scale depths. Optics express. 21 (23), 28062-28071 (2013).
- Dean-Ben, X. L., Ozbek, A., Razansky, D. Volumetric real-time tracking of peripheral human vasculature with GPU-accelerated three-dimensional optoacoustic tomography. IEEE transactions on medical imaging. 32 (11), 2050-2055 (2013).
- Dean-Ben, X. L., Razansky, D. Functional optoacoustic human angiography with handheld video rate three dimensional scanner. Photoacoustics. 1 (3-4), 68-73 (2013).
- American National Standards for the Safe Use of Lasers ANSI Z136.1.. , Americal Laser Institute. http://www.lia.org/PDF/Z136_1_s.pdf (2000).
- Ntziachristos, V., Razansky, D. Molecular imaging by means of multispectral optoacoustic tomography (MSOT). Chemical reviews. 110 (5), 2783-2794 (2010).
- Luke, G. P., Yeager, D., Emelianov, S. Y. Biomedical Applications of Photoacoustic Imaging with Exogenous Contrast Agents. Ann Biomed Eng. 40 (2), 422-437 (2012).



