Summary
Immunolabeling שיטות כדי לנתח אוכלוסיות נפרדות של microtubules במוח דג זברה המתפתח מתוארים כאן, אשר חלים באופן נרחב לרקמות אחרות. הפרוטוקול הראשון מתאר שיטה ממוטב עבור immunolabeling microtubules יציבה ודינמית. פרוטוקול השני מספק שיטה כדי התמונה ולכמת nascent microtubules במיוחד.
Abstract
Microtubules (MTs) הם דינמיים ושבירה במבנים מאתגר התמונה ויוו, בפרט העוברים בעלי. החוליות. שיטות Immunolabeling מתוארים כאן ולנתח אוכלוסיות נפרדות של MTs בצינור העצבי המתפתח של העובר דג זברה. כאשר המוקד הוא על רקמה עצבית, מתודולוגיה זו ישימה בהרחבה לרקמות אחרות. ההליכים ממוטבים מוקדם עד אמצע-somitogenesis-שלב עוברי (1 somite כדי 12 somites), אולם הם יכולים להיות מותאמים למגוון שלבים אחרים עם התאמות קלות יחסית. הפרוטוקול הראשון מספק שיטה להעריך את התפוצה המרחבית של MTs יציבה ודינמית ולבצע ניתוח כמותי של אוכלוסיות אלה עם תוכנות עיבוד תמונה. גישה זו משלימה הכלים הקיימים כדי התמונה microtubule dynamics והפצה בזמן אמת, באמצעות קווים הטרנסגניים או בביטוי ארעית של בונה מתויגות. ואכן, כלים כאלה הם מאוד שימושי, אולם הם אינם ברצון מבחינים בין MTs דינמית ויציבה. היכולת תמונה ולנתח אוכלוסיות נפרדות microtubule אלה יש השלכות חשובות על מנגנונים ההבנה שבבסיס תא קיטוב, מורפוגנזה. פרוטוקול השני מתאר טכניקה כדי לנתח nascent MTs במיוחד. זו מושגת על-ידי לכידתו של מאפייני הצמיחה דה נובו MTs לאורך זמן, בעקבות microtubule depolymerization עם nocodazole הסמים ותקופת ההתאוששות לאחר שטיפה סמים. טכניקה זו לא הוחל עדיין במחקר של MTs בדג זברה עוברי, אבל וזמינותו יקר על חקירת הפונקציה ויוו של חלבונים מעורבים microtubule הרכבה.
Introduction
Microtubules (MTs) הם פולימרים של α - ו β-טובולין. זה להרכיב לתוך protofilaments ליניארית, כמה מהם לשלב כדי ליצור צינור חלול1,2. MTs הם מבנים מקוטב, עם בצמיחה מהירה פלוס מסתיים, הגדלים לאט מינוס מסתיים שמעוגנים את centrosome או אחרים ארגון microtubule center (MTOC)3. דה נובו היווצרות MT הוא שיזם התגרענות בγ-טובולין. הטבעת מורכבת (γ-TURC), אשר מספק תבנית עבור הרכבה MT4. בתא נתון כלשהו, שתי האוכלוסיות של MTs ניתן להבחין את הפניה הזאת מעל בקצב שונה. MTs דינמי לחקור את הסביבה התאית שלהם על ידי מיתוג בין שלבי צמיחה הצטמקות בתהליך המכונה יציבות דינאמית5. בניגוד MTs דינמי, MTs יציב שאינו גדל, יש מחצית חיים ארוך יותר מאשר MTs דינמי6.
עשורים של מחקר ב ביולוגיה של התא יש מספק מערך מתוחכם של כלים ללמוד MT מבנה ותפקוד וכתוצאה גוף גדול של ידע על אלה אלמנטים cytoskeletal. למשל, MTs לשחק תפקיד המרכזי ובשימור תא קוטביות, אשר לא רק לייחס קוטביות מהותי שלהם, אלא גם כלפי ההתפלגות subcellular דיפרנציאלית של יציבה לעומת דינמי MTs7, 8. לעומת זאת, הרבה פחות מובנת על אדריכלות MT ותפקוד בסביבות מורכבות יותר תלת-ממדיים (3-D), כגון העובר חוליות, בחלקו בשל האתגר של הדמיה של שלד התא MT ברזולוציה גבוהה. למרות מגבלה זו, הדור האחרון של GFP-הבעת הטרנסגניים קווים שהמדבקה MTs או ארעי ביטוי מתויג fluorescently MT סמני גדל ההבנה שלנו של השינויים הדינמיים MTs עוברים וסלולר שלהם, תפקיד התפתחותי העובר דג זברה. הרשת MT יכול לדימות הטרנסגניים שורות אילו טובולין מתבצע ישירות פולימרים9 או טובולין עם תוויות מסומנות באופן עקיף באמצעות חלבונים הקשורים MT Doublecortin-כמו-קינאז (Dclk) או Ensconsin (EMTB)10, 11. קווים אחרים (וגם בונה) נוצרו לאפשר הערכה של קוטביות מהותי MT על-ידי תיוג במיוחד הר plus מסתיים או centrosome-מעוגן מינוס מסתיים11,12,13, 14. הכוח של כלים אלה טמון ביכולת בחקר דינמיקה MT ב live, פיתוח אורגניזמים. מחקרים גילו, לדוגמה, התפלגות מרחבית ודינאמי של MTs אוכלוסיות תאים מסוים, כיוון mitotic spindles ברקמות שעברו מורפוגנזה (אינדיקטור של המטוס של חלוקת התא), את הקוטביות של הפולימר MT ככל שהוא מתייחס לתהליכים כגון התארכות התא, הגירה, קצב הצמיחה MT נקבע על ידי שביט מהירות9,13,15. המגבלה של כלים אלה היא כי הם לא ברצון להפלות בין אוכלוסיות MT יציבה ודינמית.
ציור מן הספרות ביולוגיה התא עשיר, שיטות immunolabeling תמונה יציבה ודינמית MTs ב העובר דג זברה מתוארים כאן, אשר הם משלימים על השימוש הטרנסגניים קווים. השימוש הנרחב של כזה שיטות immunolabeling דג זברה יש כבר הקשו במידת מה על ידי הקושי בשימור תקינות MT במהלך ההליך קיבעון. פרוטוקול 1 מתאר שיטה ממוטב עבור סך immunolabeling, דינמי, וחצו MTs יציב ב סעיפים hindbrain המתפתח דג זברה. יתרה מזאת, שיטה פשוטה באמצעות מסחרית התוכנה הזמין מתואר לכמת אוכלוסיות אלה MT. MTs יציב נבדלים MTs דינמי המבוסס על מספר שינויים post-translational של α-טובולין, כגון acetylation ו- detyrosination, אשר מצטברים MTs יציבה לאורך זמן16,17. העובר דג זברה, acetylation חל על MTs ciliary, עצב אך לא על יציבה לאטמוספרה MTs18, הגבלת את התועלת של סמן זה לתת-ערכה של MTs מיוצב. לעומת זאת, detyrosination מופיע כך שיתרחשו MTs יציבה כל העובר דג זברה18. שינוי post-translational זה חושף את חומצה גלוטמית carboxy-מסוף של α-טובולין (detyrosinated טובולין)18 , ניתן להבחין באמצעות אנטי-Glu-טובולין19. למרות detyrosination מעדיפים מתרחש MTs יציב, ראיות מציין את השינוי post-translational הוא תוצאה של, יותר מאשר גורם לחוסר יציבות MT16. האוכלוסייה MT הדדיים, המורכב MTs דינמי, מזוהה באמצעות נוגדן, אנטי-Tyr-טובולין, זה במיוחד מזהה את הצורה tyrosinated של α-טובולין19. בעקבות immunolabeling עם סמנים אלה קונאפוקלית הדמיה, ניתן לבצע ניתוח כמותי של MTs (אורך, מספר ושפע היחסי) באזורים מוגדרים של הצינור העצבי המתפתח. שיטה יעילה מסופק כאן לביצוע ניתוח זה באמצעות תוכנת עיבוד תמונה תלת-ממדית. בשיטה זו ניתן להחיל על שאלות בנוגע מורפוגנזה לבין הממסד או ההבשלה של התא קוטביות20. אכן, לפתח של מערכים מקוטב של MTs יציב מלווה אירועים התפתחותיים רבים, כולל מורפוגנזה קולט אור21, epithelialization של תאים בפיתוח שפופרת פגמים בתעלה18 ו האקסון היווצרות8.
פרוטוקול 2 מתאר ויוו עיבוד של assay ביולוגיה התא כדי לנתח MTs במהלך שלהם הרכבה שלב (התגרענות/anchorage וצמיחה)22,23. MTs המתהווה nucleated-centrosome, לאחר מכן מעוגנת תוספות subdistal של אמא צנטריול23. מתוארת שיטה לנתח nascent לצמיחה מחודשת MT בעקבות depolymerization. פרוטוקול זה מספק פרטים על הטיפול nocodazole depolymerize MTs, ההליך שטיפה סמים ואת תקופת ההחלמה שלאחר הטיפול. MT מחדש את הצמיחה מנוטר על מרווח קבועs שטיפה פוסט מאת immunolabeling עם סמנים עבור MTs הכולל (אנטי-β-טובולין) לצד סמני centrosome (אנטי-γ-טובולין) ואת גרעין (4', 6-diamidino-2-phenylindole (דאפי)), על פי כללי בהליכים המתוארים תחת פרוטוקול 1. השלב depolymerization MT של פרוטוקול זה חיוני כפי שהיא מאפשרת הערכה של דה נובו MT צמיחה ולא סיומת של MTs שישנו. טכניקה זו ולכן היא נבדלת הליכים אחרים שפורסמו למדידת שיעורי צמיחה MT (בהעדר depolymerization) באמצעות סמן קצה פלוס כגון end מחייב חלבון 3 דבוקה חלבון פלואורסצנטי ירוק (EB3-GFP), כפי שמוצג טראן. et al., 201211. יתר על כן, וזמינותו זה שימושי במיוחד עבור ניתוח עוברי פגומים בהרכבה דה נובו MT, כגון המוטציות NEDD1 שדווחה בעבר שבו גיוס של γ-טובולין כדי centrosome פגום, וכתוצאה מכך לא שלם היווצרות שפופרת פגמים בתעלה, ליקויים עצביים24.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
אתיקה במשפט: ההליכים המתוארים להלן בצע של אוניברסיטת הנחיות טיפול בבעלי חיים במחוז בולטימור מרילנד.
1-ניתוח של ויציבה דינמי MTs באמצעות Immunolabeling (פרוטוקול 1)
- dechorionation ידני של העוברים לפני קיבוע
- קבל טרי הוליד העוברים על ידי לשפוך את המים העודפים מערכת, לאחר מכן איסוף העוברים הנותרים לתוך פלסטיק פטרי (עיין טבלה של חומרים).
- הסר כל פסולת מערכת מים, העברת העוברים על תבשיל חדש מלא עם העובר בינוני (עיין טבלה של חומרים) כדי להבטיח כי העוברים לפתח בסביבה נקייה.
- לאפשר את העוברים לפתח. כדי השלב הרצוי חממה מבוקרי טמפרטורה-28.5 ° C.
- עוברי המקום צעיר יותר 24 שעות לאחר ההפריה (hpf) בקערת זכוכית לפני dechorionation.
הערה: Dechorionate העוברים לפני קיבוע כדי להגדיל את החדירה המהירה של שלמות MT מקבע ומשמרות. שימוש בינוני העובר במקום מערכת מים כדי לספק את נוספים Ca 2 + הדרושים במהלך dechorionation. - להסיר באופן ידני את chorions עוברי בעוד פטרי, באמצעות מלקחיים בסדר תחת מיקרוסקופ ויבתר.
- לצבוט אזור קטן ב chorion עגול, שקוף המקיף את העובר עם זוג מלקחיים ובעדינות למשוך מלקחיים בנפרד כדי ליצור קרע בקרום.
- להגדיל את הפתח בעדינות ממבט על chorion קרע באמצעות מלקחיים. להיזהר לא לגעת העובר עם המלקחיים כפי פריר.
- קיבוע העובר בשלבים
- העברת מבוים, dechorionated עוברי ל 1.5 mL צנטריפוגה צינורות. להסיר כמה שיותר בינוני העובר ככל האפשר באמצעות כוס פסטר פיפטה.
הערה: לבצע קיבוע וטיפולי סמים על עוברי יאנג (אמצע-somitogenesis), לפני הקמת המרכזים העצביים תיווכה תחושת הכאב, אשר דורשים אין הליך נוספים כדי להקל על הכאב במהלך המתת חסד. שלבים התפתחותיים הם כמשמעותם קימל et al., 1995 25. השלבים somite 4-5, 11-12 שימשו כדי להשיג כמה תמונות של דמויות 2 ו- 3- - להכין 4% paraformaldehyde (PFA) /MT הרכבה מאגר (MAB) מקבע (עיין טבלה של חומרים) על ידי שילוב של 1 מ ל 8% מחברים לכל 1 מ ל 2 X MAB והוספת 2 µL 100% טריטון X-100 לכל 1 מ"ל של הנפח הכולל.
התראה: ללבוש כפפות בעת טיפול פתרונות המכילה מחברים, טריטון X-100, אשר גירוי העור. - תיקון עוברי 1 מ"ל 4% מחברים/MAB לשבועיים למשך 5 דקות ב- 28.5 ° C. לשאוב לשבועיים עם פיפטה, להחליף אותו עם מקבע טרי 1 מ"ל ולאחר תקופת דגירה של 3 שעות בטמפרטורת החדר (RT) על כיסא נדנדה.
הערה: דוגמאות יש לתקן במהירות בטמפרטורה שלהם ביולוגי (28.5 ° C עבור דג זברה) כדי למנוע תלוית טמפרטורה MT depolymerization.
- העברת מבוים, dechorionated עוברי ל 1.5 mL צנטריפוגה צינורות. להסיר כמה שיותר בינוני העובר ככל האפשר באמצעות כוס פסטר פיפטה.
- תשאף מקבע ולהוסיף 1 מ"ל 1 x באגירה טריס תמיסת מלח עם NP40 מאגר (TBS-NP40). בעדינות להתסיס ב RT-רוקר שלוש פעמים במשך 5 דקות. לאחסן עוברי ב 4 ° C 1 מ"ל טרי 1 X TBS-NP40 עבור לא יותר מ- 7 ימים-
התראה: ללבוש כפפות בעת טיפול פתרונות המכיל NP-40, מגרה העור.
Agarose - Sectioning עוברי עבור immunolabeling
- נקודת התכה נמוכה של RT חום 4% (LMP) הטבעה בינוני במיכל סגור עד הפתרון נעשה ברור באמצעות צלחת חמה מוגדר כ- 50 ° C בקרבה מיקרוסקופ ויבתר . להשאיר את המיכל סגור בין דגימות ומחוממים לאורך כל תהליך ההטבעה (צעדים 1.4.4-1.4.6).
- העברת העוברים מ 1.5 mL צנטריפוגה צינורות על צלחת פטרי באמצעות פיפטה מזכוכית ולמלא אותו 1 X TBS-NP40.
- להסיר את התאים חלמון גדול מעוברים שלב somitogenesis (4-5, 11-12 somites) בצלוחית הפטרי באמצעות מלקחיים בסדר תחת ההגדלה של מיקרוסקופ ויבתר 26. להחזיק את העובר על ידי ניצן הזנב עם זוג מלקחיים, הקילוף התאים חלמון עם הזוג אחרים על מנת לשמר את הרקמה hindbrain. להעביר את העוברים דה-yolked שטח של הפטרי ללא החלמון פסולת.
הערה: להטביע עוברי כייר מלא agarose בנפרד למניעת התקשות מוקדמת של agarose LMP. - מילוי אחד 12 מ"מ x 5 מ מ x 3 מ"מ טוב של העובש אופטים עם 200 µL נמסה LMP agarose משתמש של micropipette. בצע את השלבים 1.4.5.-1.4.6. במהירות (תוך 20 s של מילוי העובש) כדי להטביע את העובר לפני agarose LMP מתקררת כדי RT ומחזקים.
- להשתמש מלקחיים בסדר כדי להעביר עובר דה-yolked על-ידי tailbud מ הפטרי כייר מלא agarose לקראת סופו מחודדות תחת מיקרוסקופ ויבתר.
- מלקחיים בסדר להשתמש אוריינט העובר לתבנית כך vibratome חתכים במישור הרצוי. ליצור מקטעים רוחבי על ידי המכוונת העובר כך הרקמה hindbrain מקביל באורך התבנית עם פני השטח הגבי שלו מול הקצה, פני השטח הקדמי שלו מול בקצה אזור מחודדות. חזור על צעדים 1.4.4-1.4.6 העוברים הנותרים.
- אפשר agarose ההטמעה שבמהלכו למשך 5 דקות ב- RT.
- 40 ליצור מקטעים מיקרומטר של הציר הגבוה של agarose מוטבע עוברי (צעדים 1.4.1-1.4.7) באמצעות vibratome של המנה אופטים מלא 1 x TBS-NP40. להעביר חלקים עניין צלחת 24-ובכן ב- 500 µL 1 x TBS-NP40 באמצעות מלקחיים משובחים. מקם את המקטעים של עובר אחד בלבד לכל טוב.
הערה: עיין הפניה 18 לקבלת פרטים נוספים. ודא כי סעיפים להישאר hydrated בבית כל הזמן, לפחות 250 µL של המאגר ורוק במהירות נמוכה (10-25 סל ד) עבור השלבים הנותרים למנוע הפרדה מלהטביע agarose. דטרגנטים להציג החסימה, פתרונות כביסה צריך להפחית את מתח הפנים של המדיום הנוזלי ולאפשר ועלייתו של הסעיפים. בדוק כי סעיפים יישארו בתוך הבארות במהלך ואחרי כל המניפולציות. שימוש באזהרה כדי למנוע בטעות ביטול סעיפים במהלך שוטף.
- להסיר את המאגר ולהוסיף 500 µL של חסימת פתרון. רוק לפחות שעה-RT.
הערה: השתמש פתרון חסימה המכיל סרה 5% של המארח מינים של כל נוגדן משני כדי לשמש (עיין טבלה של חומרים). - Incubate ב 300 µL הראשית נוגדנים מדולל במאגר חסימה של 36-72 h-4 מעלות צלזיוס על כיסא נדנדה. תשטוף פעמיים ב 600 µL 1 x TBS-NP40 על כיסא נדנדה למשך 30 דקות כל אחת, ב- RT.
הערה: סעיפים כפול-התווית על-ידי המקננת ב ראשי נוגדנים נגד MTs הכולל (אנטי-β-טובולין, או אנטי-α-טובולין) ו MTs יציב (anti-Glu-טובולין) או MTs דינמי (אנטי-Tyr טובולין). בחר ראשי נוגדנים הועלו במינים שונים המארח תיוג זוגי כולל ו post-translationally שינוי אוכלוסיות α-טובולין. עיין בטבלה של חומרים עבור דילולים נוגדן.
µL - Incubate ב 300 fluorophore מצומדת נוגדנים משניים מדולל במאגר חסימה על כיסא נדנדה עבור 16-24 h, 4 ° C בחושך. תשטוף פעמיים ב 600 µL 1 x TBS-NP40 על כיסא נדנדה למשך 30 דקות כל אחת, ב- RT.
הערה: לעטוף את המנה רב טוב המכיל נוגדנים משניים בנייר מנקודה זו ואילך, לאחר כל מניפולציה כדי למנוע שכבתה. בחר נוגדנים משניים כי מגיבים עם אימונוגלובולינים המארח של נוגדן ראשוני. בחר fluorophores נוגדנים משני בעלי ספקטרום הפליטה נפרדים, שאינם חופפים. עיין בטבלה של חומרים עבור דילולים נוגדן. - דגירה העוברים ב 500 µL של דאפי פתרון על כיסא נדנדה למשך 30 דקות, בשטיפת RT. שלוש פעמים ב- TBS-NP40 נדנדה-RT למשך 5 דקות כל אחד.
הערה: תיוג גרעיני מספק הסלולר ההקשר עבור כימות MT שבוצעה בשלב 1.12. - במקום טיפה של הרכבה בינונית עם סוכן אנטי-עמעום על המרכז של שקופית ללא אבק. להשתמש מלקחיים בסדר כדי להעביר מקטעי ה-droplet בינוני הרכבה. המקום coverslip ללא אבק על המדגם. לאחסן שקופיות במקום יבש, חשוך וקריר, עטופה בנייר כסף, עד מבוצעת הדמיה-
הערה: חגים הסעיפים בחלק האחורי של השקופית באמצעות סמן קבוע שקצהו בסדר לפני הדמיה תסייע לזהות חלקים כאשר באמצעות המיקרוסקופ. - הדמיה קונאפוקלית
- הר מקטעים לייזר הפוכה מיקרוסקופ קונפוקלי סורק בהדבקת השקופית לבמה עם coverslip מול המטרה. לקבוע את אופטיקה המתאים (המטרה, לייזר והגדרות ערוץ כגון לקבל והיסט) בשקופית שליטה ולשמור אותם עקבית בין דגימות 27. להימנע oversaturating את הפיקסלים כדי למנוע אובדן נתונים.
- ללכוד תמונות קונאפוקלית Z-במחסן באמצעות הגדרות הערוצים עבור fluorophores נוגדנים משניים שנבחר ולשמור את קבצי התמונה 27. לרכוש Z-במחסן עבור כל מקטע.
הערה: לשכפל את הפרמטרים נהגה לרכוש את התמונות דמויות 2 ו- 3 באמצעות ההגדרות הבאות רכישה: מצב = XYZ; ההגדלה אובייקטיבי = 63 X עדשה טבילה שמן; מפתח נומרי אובייקטיבי = 1.4; Z-צעד = 0.1 מיקרומטר; Z-עומק = 16.23 מיקרומטר. השתמש בהגדרות ערוץ הבאות: דאפי עירור עם 20% UV-טווח לייזר, טווח מסנן פליטה = 430-480 ננומטר, האופטיקה (PMT) רווח = 525 V ולאחר קיזוז PMT =-1.72%; fluorophore ננומטר 448 (עיין טבלה של חומרים) עירור עם 20% 488 ננומטר לייזר, טווח מסנן פליטה = 493-573 ננומטר, רווח PMT = 689 V ולאחר קיזוז PMT =-0.2%; 594 עירור fluorophore ננומטר עם 32% 594 ננומטר לייזר, טווח מסנן פליטה = 608-706 ננומטר, PMT רווח = 768 V ולאחר קיזוז PMT =-6.8%- - לשמור קבצי נתונים גולמיים עם שמות קבצים ייחודי, תיאורי וליצור עותק לעריכה בתוכנה ניתוח התמונה.
- אוסף של Z-במחסן להצגת תחזיות המרבי
- לפתוח את העותק קובץ נתונים באמצעות תוכנת ניתוח תמונה תלת-ממדית הציבור (למשל, ImageJ). סימון כל אחד מערוצי מופיע רצף תמונות בודדות (Z-ערימות).
- פיצול לערוצי התמונה באמצעות הרצף התפריט הבא: “ תמונות/צבע/פצל ערוצים ”.
- ליצור תמונת הממוזג על-ידי השלכת את ערוצי עניין באמצעות הרצף התפריט הבא: " תמונות/צבע/מיזוג ערוצים. " בחר את 594 ננומטר, 488 ננומטר, וערוצי דאפי להיות כוזב בצבע אדום, ירוק וכחול, בהתאמה. בדוק " יצירת הפרדות צבע " ובחר " אישור " 28.
הערה: להשמיט את הערוץ דאפי להעביר את פירוט ספציפי ל MTs הקרנה מרבי כמו באיור 2 ו- 3, עדיף על ידי רק בחירת צבעים שווא עבור שני הערוצים האחרים. - לבחון את Z-מחסנית הממוזג, רשום את ההתחלה והסיום עמדות של הפנימית הטובה ביותר Z-המטוסים עבור כל הערוצים גלוי. לפטר החיצוני Z-המטוסים בדרך כלל בעלי אות שיוצרת עקב משטחים אחידים של המקטע. עיין להפנות 29 לפרטים-
- להמחיש הערימה-Z הממוזגת כתמונה דו-ממד יחיד על-ידי ביצוע של הטלה בעוצמה מרבית Z-מחסנית באמצעות הרצף התפריט הבא של ניתוח תמונה תלת-ממדית של: " תמונות/מחסנית/Z-בפרוייקט. " להזין ההתחלה והסיום עמדות הטובים ביותר הפנימי Z-מטוסים מהשלב 1.11.3 כמו " התחל פרוסה " ו " עצירה פרוסה, " בהתאמה. בחר " מקסימום עוצמה " סוג ההקרנה ולחצו על " אישור ". עיין להפנות 28 לפרטים נוספים-
- MT בניתוח תיוג
- לפתוח את תוכנת ניתוח תמונה תלת-ממדי מסחרי. בחר " ליצור ספריית " לספק שם תיאורי עבור הספרייה התמונה. לחץ על " צור. " לגרור קבצים תמונת raw המופקים מיקרוסקופ קונפוקלי לספרייה. קבצים גדולים יותר דורשים יותר זמן להעביר.
- בחר קובץ כדי לנתח. בחר " מיקוד מורחבת " מ " תצוגה " התפריט כדי להציג את התמונה התמזגו הערוץ בחלון הראשי של.
- להתאים את סף על-ידי גרירת הכלי המחוון לכל ערוץ ימין או שמאל עד האות רקע מוקטן, האות האמיתי הוא עמיד. שים לב כי כל אחד מערוצי מראה אות אמת עבור מולקולת עם התווית (למשל, דאפי הערוץ מציג גרעינים מלבני או mitotic אך לא אוטומטית-זריחה הציטופלסמה או agarose).
- בחר " ביד חופשית אזור של הריבית (ROI) " כלי ומיתאר האזור עניין כדי להיות מנותח. בחר " פעולות " טאב ואחריו " יבול לבחירה " כדי לחתוך את התמונה. שמור את קובץ התמונה החתוכה תחת שם חדש. לחץ " מדידות " טאב כדי ליצור הפרוטוקול עבור סינון אובייקטים מסוימים הנוגעים ניתוח תלת-ממדי.
- דראג " למצוא אובייקטים " לחלון פרוטוקול. שינוי שם של הפרוטוקול הראשון " דאפי. " בחרו בערוץ דאפי בתפריט הנפתח. גרור את ההגדרות הבאות בפרוטוקול דאפי ולמקם אותם מתחת " למצוא אובייקטים " לפי הסדר הבא (טבלה 1): " למלא חורים ObjectsŔ " נפרד לגעת ObjectsŔ " לא לכלול אובייקטים על-ידי SizeŔ " אל תכלול לא נוגע ROIs ".
הערה: המטרה של הגדרת טבלה 1 כדי לקבוע תחילה סף זה מבטלת את אותות ותפוצתם, גודל עולה בקנה אחד עם הגודל של עצמים שעוברים ניתוח. לדוגמה, לחסל את אות לא גדולים מספיק כדי להיות גרעין בעת ספירת גרעיני. - בצע הרצף (שלב 1.12.9) להרכיב את הנותרים מסננים עבור β-טובולין, סמנים אחרים תוך שימוש בהגדרות טבלה 1-
- בחר " מידה " בחלק התחתון של כל פרוטוקול. בחר " בעוצמה ומדידה נפח " ו " אורך השלד " עבור כל תיוג טובולין, אבל רק לשעבר לאות דאפי.
- ציירו רועי סביב האזור שברצונך למדוד. לצפות את המידות תחת " סיכום " טאב לאחר התוכנה תהליכי באזור. העתק את הנתונים ולשמור אותם לגיליון עביד, כמו בטבלה 2. צור עותק גיבוי של הגיליון לניתוח בשלב מאוחר יותר.
- בחר מדידות של עניין (לדוגמה, אורך של הר צרור, מספר חבילות MT/גרעין, כפי גילה עם סמנים שונים) בגיליון ולנתח כדי לקבוע את הממוצעים עבור כל קבוצה.
הערה: הר צרור האורך הממוצע = הסכום ' מתכוון אורך השלד עבור β-טובולין ' עבור כל העובר מחולק על ידי המספר הכולל של העוברים. עיין שורה 20 המובאים בטבלה 2. תבנית הגיליון כך משתנים וקבוצות ניסיוני מוצגים בגרף בקלות.
2. דה נובו MT הרכבה Assay (פרוטוקול 2)
- לבנות ובדיקה מרובת טוב זרימה דרך המנגנון ( איור 1) 2 ימים לפני הניסוי.
הערה: המנגנון מאפשר שטיפה בו זמנית של מספר קבוצות הניסוי לאחר הטיפול nocodazole באמצעות אספקה של טבלה של חומרים. סילר לאיטום סיליקון דורש לפחות 24 שעות של זמן ייבוש לפני זה מהווה שום סיכון רעילות העוברים.- לפצל את שפופרת צנטרפוגה 50 מ ל לשניים לאורכו, באמצעות פאזל או הלהקה ראה-
- 7 לחתוך עיגולים למחצה, עם רדיוס של 3 ס מ, מתוך 70 מיקרומטר ניילון mesh ולחיתוך שיתאימו בחוזקה לתוך אחד חצי של ספליט צנטריפוגה שפופרת. הדבק החוגים למחצה לתוך הצינור צנטריפוגה במקביל הסימנים הדרגתיות 10 מ"ל באמצעות סילר לאיטום אקווריום-בטוח סיליקון. לאפשר להתקן יבש במשך יומיים ולשטוף למסמס בתוך מים במשך 2-3 ח'
- קו בסוף (משורשרות) העליון ברכבת התחתית צנטריפוגה לחתוך עם בפלסטלינה כזה כי הגובה של הנוזל נשמר במכשיר זרימה דרך יש עומק של ¼ אינץ ( איור 1, נוף 2 ו- 3).
- להכין את המנגנון שטיפה על-ידי הסרת הבוכנה מזרק 50-mL ולהוספה של 12 סנטימטרים של אבובים בסדר לתוך הקצה. לדחוף את הצנרור ככל היא ללכת, לאטום סביב המפרק באמצעות מידול קליי.
- טרום רטוב באמצעות רשת בינוני העובר כדי לאפשר את הנוזל לרוץ דרך המכשיר זרימה דרך כולו. זווית המכשיר על קרח אז הנוזל הזה בריכות כל התאים אבל עדיין תודה שבאתם הקדמי שבו השפה קליי ממוקם. באמצעות עמדה טבעת, להשעות את המנגנון שטיפה מעל המכשיר זרימה דרך על קרח ( איור 1).
- להירגע 200 מ של העובר בינוני על הקרח ויוצקים מספיק לתוך מנגנון שטיפה כדי להבטיח כי כל בועות האוויר נמחקים כי קצב הזרימה הוא כ 7 מ ל לדקה התאמת קצב הזרימה על-ידי שינוי הגובה של המזרק.
- Enzymatically dechorionate עוברי
- להפוך הפתרון עובד של פרוטאז שאינם ספציפיים על-ידי דילול 1 מ"ל של 10 מ"ג/מ"ל מניות שאינם ספציפיים פרוטאז במדיום העובר 20 מ ל.
- בצע dechorionation כימי על עוברי h 1 לפני timepoint כאשר הם צפויים להגיע לשלב ההתפתחותי הרצוי. תקציר chorions על-ידי הסרת העובר בינוני 100 מ מ פטרי המכילות מבוים עוברי והוספת 20 מ של הפתרון עובד שאינם ספציפיים פרוטאז.
- Incubate עוברי ב 37 מעלות צלזיוס במשך 5 דק
הערה: לא יעלה על 5 דקות או להשתמש ריכוז גבוה יותר של פתרון פרוטאז שאינם ספציפיים, כמו התוצאה תהיה העוברים נופל לגזרים פעם שטופלו nocodazole. - במהירות פיפטה החוצה פרוטאז שאינם ספציפיים, ממלאים את מנות כ 25 מ ל העובר בינונית. אני חוזר פעם.
- באמצעות פיפטה של זכוכית 1-mL, העברת העוברים צעיר יותר 24 מנות hpf הזכוכית כדי להגן עליהם מפני נזק.
- Dechorionation מלאה על-ידי הסרת ידני chorions באמצעות זוג מלקחיים בסדר, כפי שמתואר בשלב 1.1.5.
- במקום זכוכית פטרי המכילות dechorionated העוברים בתוך חממה 28.5 ° C למשך תקופה מינימלית של 30 דקות עד שהם מגיעים לשלב ההתפתחותי הרצוי.
- Depolymerize MTs הקיימים
- להכין את הפתרון עובד של nocodazole µg/mL 5 על ידי שילוב של nocodazole מניות 1 מ"ג/מ"ל µL 50 מ"ל קרח העובר קר בינונית.
התראה: שימוש בכפפות בעת טיפול nocodazole, מגרה העור. - חילופי המדיום העובר של קבוצת טיפול nocodazole עם הפתרון עובד 10 מ"ל nocodazole קר. המקום פטרי בקרח זמן מתאים לשלב ההתפתחותי (לדוגמה, 1h עבור עוברי somite 4-5). להפריש שליטה ללא טיפול עוברי בצלחת פטרי על הקרח יש לתקן לצד שטיפה דגימות בשלב 2.3.4.1.
- העברת העוברים באמצעות על פיפטה 1-mL כמראה אש למכשירים זרימה דרך, בעזרת תאים נפרדים עבור כל קבוצה ניסיונית. הפעלה הכשלון nocodazole על ידי שפיכת בינוני העובר קר קרח אל החלק העליון של המזרק 50 מ ל.
הערה: השתמש עוברי לפחות 30 לכל קבוצה ניסיונית. קבוצות ניסיוני יכול מורכב העוברים בקרה או מגוון רחב של מורפולינו או להזריק RNA עוברי. הכשלון ידרוש סכום כולל של-150 מ ל העובר בינוני להוסיף כל 8-10 דקות סחף את nocodazole תוך לעכב את הצמיחה MT עם קרח. שמירה על העוברים על הקרח הוא חיוני להצלחת assay הזה משום MTs אינם יציבים בטמפרטורות נמוכות, הקור מעכב הפיתוח עבור עוברי מוקדם. - לאפשר MTs לצמוח לאחר 20 דקות של כשלון ב RT על-ידי העברת העוברים זכוכית פטרי המכילות חמים (28.5 ° C) העובר בינונית בעזרת פיפטה מזכוכית מלוטשת 1 מ"ל של אש. ברגע העוברים מועברים, להפעיל טיימר.
- לתקן את העוברים שטיפה ובקרה -1 דקות, 5 דקות, 10 דקות על ידי pipetting כ 10 עוברי לתוך mL 1.5 צנטריפוגה צינור מלא עם 1 מ ל- 4%-כדורגלן/MAB-תיקון (28.5 ° C), בעקבות ההוראות צעד 1.2.3.
- להכין את הפתרון עובד של nocodazole µg/mL 5 על ידי שילוב של nocodazole מניות 1 מ"ג/מ"ל µL 50 מ"ל קרח העובר קר בינונית.
- הכין דוגמיות של immunolabeling כפי שמתואר סעיפים 1.3-1.5.
- Immunolabel צף ומקטעים עוברי תמונה כמו שמתואר בסעיפים 1.6-1.10 עם השינויים הבאים למפרטי נוגדן ראשוני: שימוש שבערך ארנב אנטי-γ-טובולין, 1:200 העכבר אנטי-β-טובולין.
- תהליך ולנתח תמונות בעזרת תוכנת ניתוח תמונה תלת-ממדית, כפי שמתואר בשלב 1.12.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
ניתוח של MTs יציבה ודינמית באמצעות immunolabeling
פרוטוקול 1, ההתפלגות של MT תת האוכלוסיות במהלך המוקדמות (קיל עצבית) ו- (מוט עצבית) מאוחר, שלבי הפיתוח שפופרת פגמים בתעלה מתגלה, באמצעות Glu-טובולין טובולין Tyr כסמני בשביל יציבה ודינמית MTs, בהתאמה. MTs דינמי שולטים ב- hindbrain בשלב קיל עצבית (4-5 somites) (איור 2א-ד). כפי בשדרית מתפתח המטה עצבית (11-12 somites), שלב של epithelialization משופר, MTs איכותית פחות הם immunoreactive עם הנוגדן אנטי-Tyr-טובולין (איור 2E-H), ובמיוחד המוט הגחון. לעומת זאת, Glu-טובולין פזורים punctate ברחבי בשדרית עצבית (איור 3י-ם), אך הוא מועשר במוט עצבית הגחון לאורך ספינלי MT (איור 3E-H). ראשי חץ הצבע על חבילות MT ספציפי או מבנים איפה תיוג הוא גדל.
למרות נוגדנים anti-Glu-טובולין והן אנטי-Tyr-טובולין היו מיוצר מאותו המין המארח (מניעת תיוג ניסוי כפול), תוצאות אלה מציינים כי סמנים MT יציבה ודינמית לעיתים רחוקות חופפים זה לזה hindbrain דג זברה. ראשית, מוט עצבית הגחון יש יותר יציבה (איור 3F) מאשר דינמי MTs (איור 2F). המגמה הפוך במוט העצבי הגבי, בקנה אחד עם מודל של דג זברה neurulation שבו הרקמה הגבי נשאר דינמי עד הצינור העצבי נוצר20. שנית, בעוד mitotic הצירים מסומנות באופן מלא עם הנוגדן טיר-טובולין בשדרית עצבית (איור 2D, ראשי חץ), רק בבסיס בכישור, חופפת centrosome, נקראת עם הסמן יציבות (Glu-טובולין איור 3 D, ראשי חץ). Immunofluorescence β-טובולין, המשותף בשני מבחני, מודיע הנסיין של ההתפלגות של MTs כל ומספק בסיס לביטול שאינם ספציפיים תיוג.
מדידת אובייקטים באמצעות תוכנת ניתוח תלת-ממדי התמונה יוצרת כמות גדולה של נתונים ניתן לארגן לתוך טבלה נוחה (טבלה 2). כדי להפוך את אורך, count ומדידות שטח, אנו משתמשים רק קבוצת משנה של הנתונים הזמינים לנתח. אחד המרכיבים של הנתונים אותם אנו לא מנתחים נוסף הוא המספר של חפצים המזוהים. מספר זה משמש פקד איכות פנימית, כפי שהמספר לא אמור להשתנות באופן נרחב בין כמו מקטעים, היחס של גרעינים ל MTs צריך להישאר דומה במצב בטיפול אחד. חריג חשוד טעות הוא מחוון או הניתוח צריך אפשרות להפעיל מחדש עם מסננים מנוכי עונתיות או התמונה גרוע מדי הנקרא לנתח. לפיכך, כל התמונות חריג חשוד טעות צריך להיות reanalyzed עם ההגדרות המכווננות. חריג חשוד טעות בסעיף צריך להיבדק עבור סימני תיוג עניים או נזק פיזי זה עשוי להתבטא ספירות אובייקט חריג. לאחר סיום הניתוח, איכות מבוקר, מידע שימושי ניתן לשחזר מן הנתונים הגולמיים כגון ממוצע אורך MTs מוחלט ויציב MTs או היחס של MTs יציבה ל MTs הכולל (טבלה 3). בנוסף מדידות אלה, רבים מדדים אחרים ניתן להשיג באמצעות ניתוח תמונה תלת-ממדית תוכנה זו ניתן להשתמש כדי לצייר מסקנות על MTs או ביחס שלהם מבנים אחרים התאית (גרעין, centrosome, וכו ').
דה נובו שיטת ההרכבה MT
הטיפול nocodazole depolymerizes MTs וכתוצאה מכך תיוג ' מאטום לשקוף ' (איור 4א, 4 D, ו- 4g). כמו MTs ולצמיחה מחודשת, הם נמתחים מסימוני centrosome (איור 4B, 4E, ו- 4 שעות), לעומת זאת, זה ייתכן שלא יהיה ברור במטוס יחיד בשל שלהם מסלולים שאינם מישורי (איור 4C, 4F, ו- 4I). בכל זאת, כמה תוכנות ניתוח תמונה מסוגלים מדידת אורכי בתלת-ממד, המאפשר הערכה של MT צמיחה לאחר הכשלון nocodazole (טבלה 4). הערה חשוב זה ניתן להשיג את ערכת הנתונים בטבלה 4 הוא כי האורך הממוצע של MTs מופיע כדי להגדיל לאורך זמן לאחר הכשלון nocodazole בכל האזורים של הצינור העצבי מנותח. כפי שהוזכר לעיל, סוגים אחרים של מדדים המתקבל תמונה תלת-ממדית ניתוח תוכנה יכול לספק הסלולר ההקשר לפענוח המידע MT (לדוגמה, היחס בין MTs לכל גרעין).
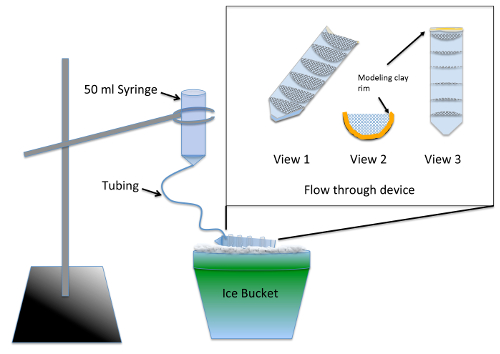
איור 1 : איור של מכשירי שטיפה דה נובו Assay הרכבה MT. שיבוץ היא תקריב של זרימה דרך המכשיר עשוי רשת מודבקים לתוך שפופרת צנטרפוגה 50-mL חתך לאורכו. רשת השינוי compartmentalizes זרימה דרך המכשיר כך מספר קבוצות הניסוי ניתן לעבד בו זמנית. במהלך השימוש, העובר בינוני מתווסף המזרק, זורם באיטיות דרך הצנרת כדי למלא זרימה דרך המכשיר, מתן שטיפה קבועה כל הקבוצות ניסיוני. אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 2: שימוש immunolabeling כדי תמונה דינמית MTs. Dechorionated עוברי תוקנו בשלבים המתאימים (4-5 ב- A-D ו- 12-13 somites ב E-H), אשר הייתה מצויה לרוחבה למחלקה דרך hindbrain, immunolabeled עם נוגדנים נגד β-טובולין (ירוק ב A ו- E) כדי לסמן כל MTs, tyrosinated α-טובולין (אדום ב B ו F) כדי לחשוף את אוכלוסיות MT דינמי. MTs דינמי מאוד ניתן לראות את התמונות הממוזגות (C, G) ו שלהם הגדלה גבוהה יותר (ד, ח) כאזורי איפה התווית הצהובה גלוי (חץ ברה , H). גודל ברים = 25 מיקרומטר (A-C ו- E-G) ו- 10 מיקרומטר (D ו- H). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

Figure 3: השימוש immunolabeling כדי תמונה יציבה MTs. Dechorionated העוברים היו קבועים, למחלקה דרך hindbrain, immunolabeled בשלבים המתאימים (somites 4-5 ב- A -D ו- 12-13 somites ב E-H). MTs יציב מסומנות עם נוגדנים נגד הצורה detyrosinated של α-טובולין (Glu-טובולין) (אדום ב B ו F) בעוד MTs סה כ היו דמיינו של נוגדן β כללי-טובולין (ירוק ב A ו- E). סימנים אדומים וצהובים התמונות הממוזגות (C, G) ו שלהם הגדלה גבוהה יותר (ד, ח) מייצגים אזורים של הר גבוהה יציבות (חץ ברה, H). גודל ברים = 25 מיקרומטר (A-C ו- E-G) ו- 10 מיקרומטר (D ו- H). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

איור 4: השימוש immunolabeling כדי התמונה המתהווה MTs. Dechorionated עוברי קבוע ב 4-5 somites, אשר הייתה מצויה לרוחבה למחלקה דרך hindbrain. קטעים היו immunolabeled עם β-טובולין (D, E, ו- F) כדי לסמן גדל MTs, γ-טובולין(A, Bו- C) כדי לסמן את נקודת התגרענות/centrosome. באזור הגבי של הצינור העצבי הוא לכוד (A, D; B, E C -f) מוצגים בהגדלה גבוהה יותר (G, H, אני, בהתאמה) כדי לחשוף את הגרעינים (דאפי, כחול), centrioles (וγ-טובולין, אדום) וסיכום MTs (β-טובולין, ירוק). ראשי חץ לבן: colocalization של MTs, centrioles; ראשי חץ צהוב: צנטריול השני של התא הוא גלוי. גודל ברים = 25 מיקרומטר (A-F) ו- 10 מיקרומטר (G-אני). אנא לחץ כאן כדי להציג גירסה גדולה יותר של הדמות הזאת.

טבלה 1: הגדרות ברירת המחדל עבור סינון אובייקטים בתוכנת ניתוח תמונה תלת-ממדית.

בטבלה 2: נציג ערכת נתונים גולמיים שהושג באמצעות ניתוח תמונות תלת-ממדי תוכנה כדי לנתח יציבה MTs. כל עמודה מייצגת מדידות של מקטע יחיד. מינימום: המידה הקטנה ביותר; מקס: מדידה הגדול; SD: סטיית תקן; SE: שגיאה סטנדרטית.

טבלה 3: דוגמאות של נתונים (datasets) אשר ניתן להשיג תלת-ממדי התמונה ניתוח תוכנה לכמת MTs יציב. בחר מדידות של אורך כלומר סה כ (β-טובולין) ויציבה (Glu-טובולין) MTs מחושב על ידי לוקח הממוצע של אורך השלד רעה עבור התווית הרלוונטיות של כל הדגימות (עיין בטבלה 2) ואת היחס של האורווה לסך MTs ( Glu-tubulin מפספס לכל β-טובולין פסים) מחושב על ידי לקיחת הרוזן β-טובולין הממוצע מחולק על ידי הרוזן Glu-טובולין הממוצע.

בטבלה 4: דוגמאות של נתונים (datasets) אשר ניתן להשיג תמונה תלת-ממדית ניתוח תוכנה כדי לנתח דה נובו MT הרכבה. תוצאות נציג מכלול דה נובו MT הניסוי, השוואת נתונים (datasets) השיג עבור שלוש נקודות זמן התאוששות (1, 5, 10 דקות) לאחר כשלון nocodazole. עבור כל נקודת זמן, מדידות השיג עבור ספירת גרעיני, centrioles (puncta וγ-טובולין), מספר MTs הכולל (β-טובולין פסים), מוצגים עבור נבחרת מחוזות הדמיה ניתח (חתך של הצינור העצבי המתפתח).
Subscription Required. Please recommend JoVE to your librarian.
Discussion
כיום ישנן שיטות רבות הדמיה MT הדינמיקה של התפתחות מוקדמת של דג זברה, ועד הדמיה חיה של מולקולות מתויגות immunolabeling של קבוע רקמות11,12,13,14. למרות MTs בתא יחיד יכולה להתקיים במצבים דינמיים או יציבה, epithelialization הוא תהליך שבו MTs בהדרגה התייצבו לאורך זמן. באמצעות סמנים עבור MTs יציבה ודינמית מציע דרך להמחיש את התופעה. השיטה המוצגת כאן ממנף את העוצמה של תוכנת הדמיה תלת-ממדית כדי לכמת את המעבר דינאמי יציבה אוכלוסיות MT ב חתך רוחב של רקמה עוברית דג זברה. פרוטוקול 2, השיטה משמשת תווית אוכלוסיה שונות של nascent MTs ולעקוב אחר השעות הנוספות? התגרענות ואת הצמיחה שלהם.
MTs הם שקשה לחסלם תמונה במצב מקורי שלהם עקב שלהם נטיה depolymerize. לכן, מרכיב המפתח של שיטה זו הוא קיבוע מהיר של MTs לכל אורך העובר כולו. זו מושגת על ידי מתחיל את הקיבעון בטמפרטורות פיזיולוגית באמצעות מאגר זה מייצבת את MTs וגם מגביר את החדירות של העובר. הזמן קיבוע חשוב גם כמו והפחיתה את הקיבעון נכשל לעצור MTs תוך קיבוע יתר מטשטשים את epitopes, מתנגש עם הנוגדן מחייב. הזמן קיבוע המוצע של 3-4 h עובד עם עוברי כי הם של gastrulation מאמצע עד 24 שעות לאחר ההפריה. עוברי לקראת סוף ציר הזמן הצעיר להיות קבועה עבור קרוב ל-3 שעות בעוד עוברי מבוגרים ייתכן שתצטרך את כל 4 שעות. אפילו עם קיבוע נאות, MTs depolymerize עם הזמן כך חלוקתה, immunolabeling חייבת להתבצע תוך שבוע אחד של תיקון.
ברגע הרקמה הוא קבוע כראוי, יכול מתעוררות בעיות עם immunolabeling. הבעיה הנפוצה ביותר נתקל כבר מסכן חדירה דרך המרכז של הרקמה, במיוחד, אם מקטעים רבים מדי מודגרת בבאר אותו. הגדלת ריכוז נוגדן ואת הדגירה העיקרי את זמן נוגדנים ראשיים ומשניים, בשילוב עם חיזוק של דטרגנטים כדי לשפר את permeabilization של העוברים להפחיתם מרבית הבעיות immunolabeling. אם הנוגדן תיוג נכשל בשל בעיות immunolabeling או קיבעון, זה אפשרי לקבוע את הגורם על-ידי בדיקת נוגדן תיוג דפוס. קיבוע עניים לגרום תיוג אינטנסיבי ממברנה ומפוזר תיוג בציטופלסמה, ואילו קיבוע יתר וכתוצאה מכך חלש תיוג זה ישמר MT אדריכלות. חדירה המסכן של הנוגדן, עם זאת, תופיע אזורים במרכז של הרקמה ללא תיוג.
היכולת לנתח MT תמונות באופן משמעותי תלויה באיכות גבוהה הדמיה. כדי ללכוד MT אורך בתלת-ממד, הגודל המינימלי Z-צעד אפשרי עבור המטרה ו מפתח נומרי אמור לשמש. התמונות המוצגות כאן נלקחו בשבי עם 63 X שמן emersion המטרה עם 1.4 מפתח נומרי בהפקת הבאות: פיקסל = 240 nm, Z-צעד = 0.1 מיקרומטר, Z-מחסנית גודל = מיקרומטר 16.252. כי רוחב הר בודד 25 ננומטר, בערך פי 10 מתחת למגבלה של הרזולוציה של מיקרוסקופ אור, המדד הזה לא יכול להיות מדויק נמדד בעזרת טכניקה זו. במקום זאת, ניתן למדוד אורכים MT היחידה שווה או גדול מגודל הפיקסל המזעריות השגה כל בשלושה ממדים. קו ו/או מסגרת בממוצע ניתן לשפר את הגדרת אות MT. MT ניתוח צריך להיות שמורות עבור מקטעים באיכות גבוהה. בעוד רקמות עם קיבוע המסכנה לא יכולה להיות עם תמונה וניתח, overfixation מתון יכול להיות אוזנו על-ידי בקפידה הגדלת עוצמת לייזר ולהשיג כדי לזהות את האות חלש תוך שמירה על טווח דינמי רחב. חדירה נוגדן עני, ואילו לא היו אופטימאליים, ניתן לתקן על ידי הגבלת ייבוא תמונות לאזורים היטב עם תוויות, וכתוצאה מכך הדמיה מקטע דק יותר (5-10 מיקרומטר). רקע גבוה מ תיוג יכול לקבל פיצוי על-ידי כוונון הגדרות המסנן. עם זאת, אם כל אחד התאמות אלה נעשים, זה הכרחי לוודא כי הסף מסננים באופן קביל על כל מטוס של Z-המחסנית.
תמונה תלת-ממדית ניתוח תוכנה מאפשר הנסיין לכמת MT אורך, שטח, זווית, שפע, ומדדים אחרים במרחב תלת-ממדי של מקטעי רקמת קבוע. השיטה המתוארת כאן מספק הנחיות להשגת נתונים כאלה באמצעות תוכנה זמינים מסחרית. עם זאת, המודולים סינון עשוי להיות מותאם כדי הציבור תוכנה משופרת עם תוספים הרלוונטיים ו/או פקודות מאקרו, שזמינה לכל ניתוח. לפני ניתוח, בתמונות raw חייב להיות thresholded כדי להימנע כולל רקע ושאינם ספציפיים אותות כימות. לאחר ניתוח השלמת נתונים מועברים לגליונות אלקטרוניים עביד, מסקנות רבות יכול להיעשות מתוך ערכת הנתונים. אחד החישובים שנעשו כאן היה Glu-טובולין פסים פסים β-טובולין, או היחס של MTs יציבה ל MTs הכולל שבו 1 מייצג שלד התא כולו MT התייצבה ברועי. אם הנסיין שרוצה להשלים נתונים כמותיים שלהם, יצירת תבנית קובץ מלוטש תמונות מתויגות (TIFF) תמונה עם סרגלי קנה מידה הוא מאמץ עם תוכנת ניתוח תמונה תלת-ממדית.
Assay זו מאפשרת ניתוח תפקודי של חלבונים מעורבים MT הרכבה, בתוך vivo. אם immunolabeling מבוצעת על לסירוגין מקטעים טורי, פרוטוקול זה יכול לשמש כדי ללמוד MTs דינמית ויציבה של העובר אותו. בעתיד, שינויים כגון דטרגנטים מוגבר או שינו זוויות ההטבעה יאפשר השימוש בשיטות אלה עבור מבוגרים העוברים ומגוון רחב של שאלות אנטומיים.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
המחברים אין לחשוף.
Acknowledgments
מיקרוסקופ קונפוקלי נרכש בכספים מ ארה ב הלאומית למדע קרן (NSF), גרנט #DBI-0722569. המחקר נתמך על ידי ארה ב הלאומית מכוני בריאות/לאומי המכון של גנרל רפואי למדעים (NIH/NIGMS) גרנט #GM085290, ארה ב המחלקה של ההגנה (DOD) גרנט #W81XWH-16-1-0466 מוענק ברוסטר חומרי גלם. אי חיוניים נתמך על ידי מענק כדי UMBC הווארד יוז מכון רפואי דרך המכללה מראש לתואר ראשון במדעי החינוך תוכנית, להעניק #52008090. פ מ בראון נתמכה על ידי ארצות הברית מחלקת של החינוך GAANN מלגת, מלגת בוגר מאירהוף ממומן על ידי מענק NIH/NIGMS #GM055036, Assistantship של מחקר שמומן על ידי משרד ההגנה האמריקאי גרנט #W81XWH-16-1-0466.
Materials
| Name | Company | Catalog Number | Comments |
| Agarose | Used to treat petridishes. Prepare 1% agarose by heating a solution of 1 gram agarose per 100 ml 1X embryo medium in a microwave until polymerized. |
||
| Kpipes | Sigma | P7643 | |
| NaCl | Sigma | S7653 | |
| Tris-HCl | Sigma | T3253-500G | |
| KCl | Sigma | P9333-500G | |
| CaCl2·2H2O | Sigma | C5080 | |
| NP-40 | American Bioanalyticals | AB01424 | |
| EGTA | Sigma | E3889-25G | |
| MgCl2 | Sigma | M2670-500G | |
| Bovine serum albumin (BSA) | Fisher | BP1605 | |
| Triton-x | American Bioanalyticals | AB02025 | |
| Anti-Fade mounting medium | Invitrogen | P10144 | |
| Mouse anti-β-tubulin | Developmental studies Hybridoma Bank | E7 | 1/200 |
| Rabbit anti-γ-tubulin | Genetex | GTX113286 | 1/500 |
| Rabbit anti-α-tubulin | Genetex | GTX108784 | 1/1000* |
| Rabbit anti-detyrosinated-tubulin | Millipore | AB3201 | 1/200-1/1000* Titrate antibody with first use of new lot. |
| Rabbit anti-tyrosinated-tubulin | Millipore | ABT171 | 1/500 |
| Mouse anti-centrin | Millipore | 04-1624 | 1/1000 |
| Goat 488 anti-rabbit | Thermofisher | A11008 | 1/500 |
| Goat 594 anti-rabbit | Thermofisher | A11012 | 1/500 |
| Goat 594 anti-mouse | Thermofisher | A11005 | 1/500 |
| Goat 488 anti-mouse | Thermofisher | A11001 | 1/500 |
| Vibratome | Vibratome | 1500 | |
| Forceps | World Precision Instruments | 555227F | |
| 100 mm petri dish | Cell treat | 229693 | |
| 35 mm petri dish | Cell treat | 229638 | |
| 50 ml falcon tube | Fisher | 14-432-22 | |
| Woven nylon mesh 70 um | Amazon.com | B0043D1SZG | |
| Micropipette | Gilson | F123602 | |
| Glass pipette | Fisher | NC-999363-9 | |
| Aquarium sealant | Amazon.com, by MarineLand | Silicone Sealer 1 oz (Tube) | |
| Ring stand | Fisher | 14-675BO | |
| Microbore PTFE Tubing, 0.022"ID | Cole-Parmer | WU-06417-21 | |
| Modeling clay | Amazon.com | Sargent Art 22-4000 | Any wax or oil based non-toxic modeling clay will suffice |
| Clamp | Fisher | 02-215-466 | |
| 60ml syringe | Fisher | 14-820-11 | |
| Embryo medium (E3) | 34.8 g NaCl 1.6 g KCl 5.8 g CaCl2·2H2O 9.78 g MgCl2·6H2O To prepare a 60X stock, dissolve the ingredients in H2O, to a final volume of 2 L. Adjust the pH to 7.2 with NaOH. Autoclave. To prepare 1X medium, dilute 16.5 mL of the 60X stock to 1 L. |
||
| Blocking Solution | 50 ml TBS-NP-40 2.5 ml normal goat serum 1 g BSA 625 µl Triton-X |
||
| TBS-NP-40 (pH 7.6) | 155 mM NaCl 10 mM Tris HCl 0.1% NP-40 |
||
| 2x MAB (pH6.4) | 160 mM KPIPES 10 mM EGTA 2 mM MgCl2 |
||
| Commercial 3-D Image processing Software | PerkinElmer | Volocity (V 6.2) | |
| Dry block heater | VWR | 12621-108 | Used as a hot plate to melt agarose in Protocol 1. |
| Dissecting Microscope | Leica | MZ12 | |
| Confocal Microscope | Leica | SP5 | |
| Flat embedding mold | emsdiasum.com | BEEM 70904-01 | |
| Public domain image processing software | NIH | ImageJ (V 1.5) | |
| * Success varies by lot number | |||
References
- Akhmanova, A., Steinmetz, M. O. Tracking the ends: a dynamic protein network controls the fate of microtubule tips. Nat Rev Mol Cell Biol. 9 (4), 309-322 (2008).
- Conde, C., Cáceres, A. Microtubule assembly, organization and dynamics in axons and dendrites. Nat Rev Neurosci. 10 (5), 319-332 (2009).
- Kaverina, I., Straube, A. Regulation of cell migration by dynamic microtubules. Semin Cell Dev Biol. 22 (9), 968-974 (2011).
- Kollman, J. M., Merdes, A., Mourey, L., Agard, D. A. Microtubule nucleation by γ-tubulin complexes. Nat Rev Mol Cell Biol. 12 (11), 709-721 (2011).
- Howard, J., Hyman, A. A. Growth, fluctuation and switching at microtubule plus ends. Nat Rev Mol Cell Biol. 10 (8), 569-574 (2009).
- Schulze, E., Kirschner, M. Dynamic and stable populations of microtubules in cells. J Cell Biol. 104 (2), 277-288 (1987).
- Gundersen, G. G., Kalnoski, M. H., Bulinski, J. C. Distinct populations of microtubules: Tyrosinated and nontyrosinated alpha tubulin are distributed differently in vivo. Cell. 38 (3), 779-789 (1984).
- Li, R., Gundersen, G. G. Beyond polymer polarity: how the cytoskeleton builds a polarized cell. Nat Rev Mol Cell Biol. 9 (11), 860-873 (2008).
- Asakawa, K., Kawakami, K. A transgenic zebrafish for monitoring in vivo microtubule structures. Dev Dyn Off Publ Am Assoc Anat. 239 (10), 2695-2699 (2010).
- Wühr, M., Tan, E. S., Parker, S. K., Detrich, H. W., Mitchison, T. J. A model for cleavage plane determination in early amphibian and fish embryos. Curr Biol CB. 20 (22), 2040-2045 (2010).
- Tran, L. D., Hino, H., et al. Dynamic microtubules at the vegetal cortex predict the embryonic axis in zebrafish. Development. 139 (19), 3644-3652 (2012).
- Butler, R., Wood, J. D., Landers, J. A., Cunliffe, V. T. Genetic and chemical modulation of spastin-dependent axon outgrowth in zebrafish embryos indicates a role for impaired microtubule dynamics in hereditary spastic paraplegia. Dis Model Mech. 3 (11-12), 743-751 (2010).
- Yoo, S. K., Lam, P. -Y., Eichelberg, M. R., Zasadil, L., Bement, W. M., Huttenlocher, A. The role of microtubules in neutrophil polarity and migration in live zebrafish. J Cell Sci. 125 (23), 5702-5710 (2012).
- Andersen, E. F., Halloran, M. C. Centrosome movements in vivo correlate with specific neurite formation downstream of LIM homeodomain transcription factor activity. Development. 139 (19), 3590-3599 (2012).
- Lee, S. -J. Dynamic regulation of the microtubule and actin cytoskeleton in zebrafish epiboly. Biochem Biophys Res Commun. 452 (1), 1-7 (2014).
- Bulinski, J. C., Gundersen, G. G. Stabilization and post-translational modification of microtubules during cellular morphogenesis. BioEssays. 13 (6), 285-293 (1991).
- Magiera, M. M., Janke, C. Chapter 16 - Investigating Tubulin Posttranslational Modifications with Specific Antibodies. Methods Cell Biol. 115, 247-267 (2013).
- Hong, E., Jayachandran, P., Brewster, R. The polarity protein Pard3 is required for centrosome positioning during neurulation. Dev Biol. 341 (2), 335-345 (2010).
- Westermann, S., Weber, K. Post-translational modifications regulate microtubule function. Nat Rev Mol Cell Biol. 4 (12), 938-948 (2003).
- Jayachandran, P., Olmo, V. N., et al. Microtubule-associated protein 1b is required for shaping the neural tube. Neural Develop. 11, 1 (2016).
- Nam, S. -C. Role of Tau, a microtubule associated protein, in Drosophila photoreceptor morphogenesis. Genes N Y N 2000. 54 (11), 553-561 (2016).
- Abal, M., Piel, M., Bouckson-Castaing, V., Mogensen, M., Sibarita, J. -B., Bornens, M. Microtubule release from the centrosome in migrating cells. J Cell Biol. 159 (5), 731-737 (2002).
- Delgehyr, N., Sillibourne, J., Bornens, M. Microtubule nucleation and anchoring at the centrosome are independent processes linked by ninein function. J Cell Sci. 118 (8), 1565-1575 (2005).
- Manning, J. A., Lewis, M., Koblar, S. A., Kumar, S. An essential function for the centrosomal protein NEDD1 in zebrafish development. Cell Death Differ. 17 (8), 1302-1314 (2010).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn Off Publ Am Assoc Anat. 203 (3), 253-310 (1995).
- Beck, A. P., Watt, R. M., Bonner, J. Dissection and Lateral Mounting of Zebrafish Embryos: Analysis of Spinal Cord Development. JoVE J Vis Exp. (84), e50703 (2014).
- FÖldes-Papp, Z., Demel, U., Tilz, G. P. Laser scanning confocal fluorescence microscopy: an overview. Int Immunopharmacol. 3 (13-14), 1715-1729 (2003).
- Ferreira, T., Rasband, W. S. ImageJ User Guide - IJ 1.46. , Available from: https://imagej.nih.gov/ij/docs/guide/ (2010).
- Z-functions - ImageJ. , Available from: https://imagej.net/Z-functions (2017).



