Summary
Immunolabeling yöntemleri mikrotübüller gelişmekte olan Zebra balığı beyinde farklı nüfus analiz etmek için burada, genel olarak diğer dokulara geçerlidir açıklanmıştır. İlk protokol immunolabeling istikrarlı ve dinamik mikrotübüller için en iyi duruma getirilmiş bir yöntemi özetliyor. İkinci Protokolü görüntü ve doğmakta olan mikrotübüller özellikle ölçmek için bir yöntem sağlar.
Abstract
Mikrotübüller (MTs) görüntü vivo içindeözellikle de omurgalı embriyolar için zor olan dinamik ve kırılgan yapılardır. Immunolabeling yöntemleri burada MTs ayrı nüfus gelişmekte olan Nöral tüp Zebra balığı embriyo çözümlenecek açıklanır. Odağı sinir dokusu üzerinde olmakla birlikte, bu yöntem genel olarak diğer dokulara geçerlidir. Erken somitogenesis aşamalı orta embriyolar için (1 somite 12 somites için), ancak onlar nispeten küçük ayarlamalar ile diğer aşamalarında bir dizi için adapte edilebilir için yordamları optimize edilmiştir. İlk protokol istikrarlı ve dinamik MTs kayma dağılımını değerlendirmek ve görüntü işleme yazılımı ile bu nüfusun kantitatif analiz gerçekleştirmek için bir yöntem sağlar. Bu yaklaşım görüntü Mikrotubul dynamics ve dağıtım gerçek zamanlı, kullanma transgenik çizgiler veya geçici ifade tagged yapıları, varolan araçları tamamlar. Gerçekten de, onlar kolayca dinamik ve istikrarlı MTs arasında ayrım yapmak ancak gibi araçlar çok yararlı olur. Görüntü ve bu farklı Mikrotubul nüfus analiz yeteneği hücre polarizasyon ve Morfogenetik temel anlayış mekanizmaları için önemli sonuçları vardır. İkinci Protokolü doğmakta olan MTs özel olarak çözümlemek için bir teknik özetliyor. Bu ilaç nocodazole ve ilaç Silinerek geçiş sonra bir iyileşme döneminde Mikrotubul bozulumu takip zaman içinde de novo büyüme özellikleri MTS çekimi ile gerçekleştirilir. Bu teknik henüz MTs çalışmada Zebra balığı embriyo uygulanmış olduğundan değil, ama vivo içinde işlev proteinlerin Mikrotubul derlemede karıştığı soruşturma için değerli bir tahlil olduğunu.
Introduction
Polimerler, α - ve β-birkaç hangi içi boş boru1,2oluşturmak üzere birleştirmek doğrusal protofilaments araya tübülin mikrotübüller (MTs) vardır. MTs biter hızla büyüyen ve yavaş-centrosome veya diğer Mikrotubul düzenleme Merkezi (MTOC)3bağlantılı biter eksi büyüyen polarize, yapılardır. De novo MT oluşumu, γ-tübülin yüzük karmaşık çekirdekleşme (γ-TURC), MT derleme4için bir şablon sağlayan tarafından başlatılır. Verilen herhangi bir hücresinde, MTS iki popülasyonun o dönüşü üzerinde farklı oranlarda ayrılır. Dinamik MTs büyüme aşamaları ve büzülme dinamik istikrarsızlık5olarak bilinen bir işlemle arasında geçiş yaparak onların hücresel ortamı keşfetmek. Dinamik MTs, aksine istikrarlı MTs sigara büyüyen ve dinamik MTs6' dan daha uzun bir yarı ömrü vardır.
Araştırmalar yılların MT yapısı ve fonksiyonu çalışma araçları karmaşık bir dizi sağlanan ve hücre iskeleti bu öğeler üzerinde bilgi büyük bir vücut sonuçlandı. Örneğin, MTs kurulması ve aynı zamanda kararlı dinamik MTs7, karşı farklı hücre altı dağıtım için kendi içsel polarite sadece atfedilebilecek hücre polarite bakım merkezi bir rol oynamaktadır 8. buna ek olarak, çok daha az MT mimarisi ve işlev omurgalı embriyo gibi daha karmaşık üç boyutlu (3-D) ortamlarında hakkında kısmen nedeniyle MT sitoiskeleti yüksek çözünürlükte görüntüleme meydan anlaşılmaktadır. Bu sınırlamaya rağmen GFP-ifade transgenik son nesil bu etiketle MTs hatları veya geçici ifade fluorescently öğesini MT işaretlerinin MTs geçmesi dinamik değişiklikleri ve onların hücresel anlayışımızı artmıştır ve Zebra balığı embriyo gelişimsel rolünde. Tüm MT ağ hangi tübülin transgenik satırlarında etiketli9 veya tübülin polimerler MT ilişkili proteinler kullanarak dolaylı olarak etiketlenir doğrudan olması yansıması Doublecortin-gibi-kinaz (Dclk) veya Ensconsin (EMTB)10, 11. Diğer çizgiler (ve yapıları) MT içsel polarite değerlendirilmesi özellikle MT artı biter etiketleme tarafından etkinleştirmeniz veya biter11,12,13, centrosome bağlantılı oluşturulan 14. organizmalar geliştirme yeteneği MT dinamiklerini canlı, çalışma için bu araçları gücü yatıyor. Bu tür çalışmalar, örneğin, MTs kayma ve dinamik dağıtım, belirli hücre popülasyonlarının indirdik, Mitotik yönünü morfogenez (hücre bölünmesi boyutunda bir gösterge) geçiren dokularda MT polimer polarite spindles hücre uzama ve geçiş, gibi işlemleri ile ilişkisini ve MT büyüme hızı kuyruklu yıldız hız9,13,15tarafından belirlenir. Bu araçların onlar kolayca istikrarlı ve dinamik MT nüfus arasında ayırımcılık değil ki kısıtlamadır.
Zengin hücre biyolojisi edebiyatından çizim, Zebra balığı embriyo istikrarlı ve dinamik MTs görüntüye immunolabeling yöntemleri burada, transgenik çizgiler kullanmak için tamamlayıcı olduğu açıklanmıştır. Zebra balığı böyle immunolabeling yöntemleri yaygın kullanımı biraz zorluk fiksasyon işlemi sırasında MT bütünlüğünün korunmasında engel olmuştur. İmmunolabeling toplam, dinamik, için en iyi duruma getirilmiş bir yöntemi protokol 1 özetliyor ve istikrarlı MTs gelişmekte olan Zebra balığı arka beyin bölümlerini çapraz. Ayrıca, ticari olarak kullanarak basit bir yöntem bu MT nüfus ölçmek için kullanılabilir yazılım açıklanmıştır. İstikrarlı MTs dinamik MTs α-tübülin, istikrarlı MTs saat16,17üzerinde birikir asetilasyon ve detyrosination, gibi çeşitli translasyonel modifikasyonlar dayalı dan ayırt edilirler. Zebra balığı embriyo asetilasyon silier ve aksonal MTs ama bu işaretleyici bir alt kümesi stabilize MTs ile kullanışlılığı sınırlama değil istikrarlı Interphase MTs18, oluşur. Buna ek olarak, Zebra balığı embriyo18tüm istikrarlı MTs oluştuğu detyrosination görünür. Bu translasyonel modifikasyon carboxy-terminal glutamik asit α-tübülin (detyrosinated tübülin)18 ortaya çıkaran ve anti-Glu-tübülin19kullanarak tespit edilebilir. Detyrosination tercihen istikrarlı MTs üzerinde oluşmakla birlikte, deneysel kanıtlar bu translasyonel modifikasyon bir nedeninin, MT istikrar16yerine bir sonucu olduğunu gösterir. Dinamik MTs oluşan karşılıklı MT nüfus bir antikor, anti-Tyr-bu özellikle α-tübülin19tyrosinated şeklinde tanır tübülin, kullanarak ayırt edilir. Bu işaretleri ve confocal görüntüleme immunolabeling gelişen Nöral tüp tanımlanan bölgelerde MTs (uzunluk, numarası ve göreli bereket) kantitatif analiz gerçekleştirilebilir. Akıcı bir yöntem 3 boyutlu görüntü işleme yazılımı kullanarak bu analiz gerçekleştirmek için buraya sağlanır. Bu yöntem morfogenez ve kuruluş veya hücre polarite20olgunlaşma ile ilgili soruları için uygulanabilir. Gerçekten de, istikrarlı MTs polarize dizileri hazırlama photoreceptor morfogenetik21, epithelialization gelişmekte olan Nöral tüp18 ve akson oluşumu8hücre de dahil olmak üzere birçok gelişimsel olay eşlik eder.
Protokolü 2 vivo uyarlaması MTs onların derleme aşaması (çekirdekleşme/çapalama ve büyümesi)22,23sırasında analiz etmek için bir hücre biyolojisi tahlil açıklar. Yeni doğmakta olan MTs parçalanmayabilir centrosome ve daha sonra anne centriole23subdistal uzantıları için bağlantılı. Yeni doğmakta olan MT büyütme bozulumu takip analiz etmek için bir yöntem açıklanır. Bu iletişim kuralı, MTs, uyuşturucu Silinerek geçiş prosedürü ve tedavi sonrası iyileşme döneminde depolymerize için nocodazole tedavi için ayrıntıları sağlar. MT yeniden büyüme düzenli aralıklarla izlenirs yazı Silinerek geçiş işaretli toplam MTs için immunolabeling tarafından (anti β-tübülin) yanında centrosome için işaretleri (anti γ-tübülin) ve çekirdek (4', 6-diamidino-2-phenylindole (DAPI)), iletişim kuralı 1' de açıklanan genel yordamlara göre belirleme yapılacağı. MT bozulumu adım bu protokol değerlendirme de novo MT büyüme yerine önceden varolan MTs uzantısı sağlar, gerekli. Bu tekniği bu nedenle bağlayıcı protein 3 Tran ve ark.içinde gösterildiği gibi yeşil flüoresan protein (EB3-GFP), erimiş bağlıdır son gibi artı bir ipucu işaretleyici kullanarak (bozulumu yokluğunda) MT büyüme oranları ölçmek için yayımlanmış diğer yordamlar ayrıdır, 201211. Ayrıca, bu tahlil embriyo de novo MT derlemede arızalı analiz etmek için özellikle yararlıdır γ-tübülin centrosome için alımı Engelli daha önce bildirilen NEDD1 mutantlar gibi içinde eksik çıkan Nöral tüp oluşumu ve nöronal kusurları24.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
etik beyanı: University of Maryland Baltimore ilçe hayvan bakımı yönergeleri izleyin yordamlarda açıklandığı.
1. analiz istikrarlı ve dinamik MTs kullanılarak Immunolabeling (protokol 1)
- embriyo fiksasyon önce el ile dechorionation
- elde edilir taze balık yumurtası embriyo fazla sistem su dökerek ve plastik bir Petri kabına kalan embriyolar toplama (Tablo malzemeler için başvurmak).
- Yeni bir tabak için sistem su ve transfer embriyoların üzerinden herhangi bir enkaz dolu ile embriyo orta Kaldır (Tablo malzemeler için başvurmak) embriyo temiz bir ortamda geliştirmek emin olmak için.
- Isı kontrollü bir kuluçka 28.5, istenen sahneye geliştirmek embriyo izin ° C. Bir cam tabakta dechorionation önce
- yer embriyolar 24 h genç sonrası döllenme (hpf).
Not: Dechorionate embriyo fiksasyon hızlı penetrasyon sabitleştirici ve Korunağı MT bütünlüğünü en üst düzeye çıkarmak için önce. Kullanım embriyo orta yerine dechorionation sırasında gerekli ek Ca 2 + sağlamak için sistem su. - Embriyo Petri diseksiyon mikroskop altında iyi forseps kullanarak tabak içinde iken, chorions el ile kaldırın.
- Forseps ve yavaşça çekin forseps ayrı bir kopma membran içinde oluşturmak için bir çift ile embriyo çevreleyen yuvarlak, şeffaf koryon küçük bir alanda çimdik.
- İnce forseps kullanarak rüptüre koryon üzerinde gözetleyen tarafından açılış büyütmek. Rüptürü gibi embriyo Forseps ile dokunmak dikkatli olun.
- Aşamalı embriyo fiksasyonu
- Transfer sahnelenen, dechorionated embriyo 1,5 mL santrifüj tüpleri için. Bir cam Pasteur pipet kullanarak mümkün olduğu kadar embriyo orta kaldırın.
Not: fiksasyon ve ilaç tedavileri ötenazi sırasında ağrı hafifletmek için hiçbir ek işlem gerektiren ağrı hissi, arabuluculuk sinir merkezleri oluşumu önce genç (orta-somitogenesis) embriyo üzerinde gerçekleştirin. Gelişim dönemleri vardır Kimmel ve ark içinde tanımlanan., 1995 25. 4-5 ve 11-12 somite aşamaları rakamlar 2 ve 3 için görüntüleri elde etmek için kullanılan. - Arabellek (MAB) sabitleştirici %4 paraformaldehyde (PFA) /MT derleme hazırlamak (Tablo malzemeler için başvurmak) %8 1 mL birleştirerek PFA ücret 1 mL 2 X MAB ve 2 µL % 100 ekleme Triton X-100 başına toplam hacminin 1 mL.
Dikkat: PFA ve Triton X-100, cilt tahriş edici içeren çözümler işleme sırasında eldiven giymek. - 1 mL % 4 İngiltere'de yılın/MAB sabitleştirici 28.5, 5 min için düzeltme embriyo ° C. aspiratı sabitleştirici bir pipet ile eski yerine koymak o ile 1 mL taze sabitleştirici ve oda sıcaklığında (RT) bir rocker üzerinde 3 h için kuluçkaya.
Not: Örnekleri hızlı bir şekilde, onların biyolojik sıcaklığında (Zebra balığı 28.5 ° C) sıcaklık bağımlı MT bozulumu önlemek için giderilmelidir.
- Transfer sahnelenen, dechorionated embriyo 1,5 mL santrifüj tüpleri için. Bir cam Pasteur pipet kullanarak mümkün olduğu kadar embriyo orta kaldırın.
- Aspire sabitleştirici ve 1 mL 1 x Tris arabelleğe alınmış serum NP40 ekleyin (TBS-NP40) arabellek. Yavaşça RT bir rock'çı 5 min için üç kez üzerinde tahrik. Mağaza embriyo 4 ° C'de 1 mL taze 1 X TBS-NP40 7 günden fazla için.
Dikkat: NP-40, cilt tahriş edici içeren çözümler işlerken eldiven giymek.
50 ° c diseksiyon mikroskop yakın konumlandırılmış - immunolabeling için Sectioning embriyo
- ısı RT % 4 düşük erime noktası (LMP) özel çözüm sıcak bir tabak kullanarak açık hale gelinceye kadar kapalı bir kapta orta katıştırma ayarla . Konteyner örnekleri arasında kapalı ve ısıtmalı gömme işlemi (adımları 1.4.4-1.4.6) devam.
- Transfer embriyoların üzerinden 1.5 mL cam pipet kullanarak bir petri tüpler santrifüj kapasitesi ve 1 ile doldurun X TBS-NP40.
- Somitogenesis sahne embriyo (4-5 ve 11-12 somites) büyük sarısı hücrelerden Petri kabına bir diseksiyon mikroskop 26 büyütme altında iyi forseps kullanarak kaldırın. Embriyo tarafından kuyruk bud forseps bir çift ile tutun ve diğer çifti sarısı hücrelerle arka beyin doku korumak için peel away. Bir Petri kabına sarısı enkaz serbest bölgeye de yolked embriyo transfer.
Not: embriyo ayrı ayrı LMP özel erken sertliği önlemek için özel dolu kalıp içine Embed. - Dolgu bir 12 mm x 5 mm x 3 mm de 200 µL ile parça kalıp LMP özel bir micropipette kullanarak erimiş. Adımları 1.4.5.-1.4.6 gerçekleştirin. hızlı bir şekilde (içinde 20 kalıp doldurma s) önce LMP özel soğur RT ve katılaşır embriyo katıştırmak için.
- De yolked bir embriyo tarafından tailbud Petri kabına diseksiyon mikroskop altında konik sonuna doğru özel dolu kalıp aktarmak amacıyla iyi forseps kullanın.
- Kullanım iyi forseps vibratome istenen düzlemde keser gibi embriyo kalıp içine gelecek şekilde yönlendirin. Öyle ki arka beyin doku dorsal yüzeyi kenarına bakan ve konik bölge sonuna bakan ön yüzeyi ile kalıp uzunluğu paralel gidiyor embriyo yönlendirme tarafından enine bölümleri oluşturun. Adımları 1.4.4-1.4.6 için kalan embriyo yineleyin.
- Özel dik, 5 min için kuvvetlendirmek için gömme izin ver
- Özel en yüksek eksen oluşturmak 40 µm bölümlerini gömülü 1 ile dolu parça yemek ile bir vibratome kullanarak embriyo (adımları 1.4.1-1.4.7) x TBS-NP40. Faiz bölümlerini bir 24-şey tabak içinde 500 µL 1 transfer TBS-NP40 iyi forseps kullanarak x. Tek embriyo bölümlerini de yerleştirin.
Not: 18 daha fazla ayrıntı için başvurmak için bakın. Bölümler, her zaman içinde en az 250 µL arabellek ve düşük hızlı (10-25 rpm) özel katıştırma üzerinden ayırma önlemek kalan adımları için Rock'ta Susuz kalmasını sağlamak. Belgili tanımlık kütük parçası deterjanlar sunmak ve yıkama çözümler sıvı orta yüzey gerilimi azaltmak ve batma bölümlerin izin. Bölümler sırasında ve sonrasında tüm manipülasyonlar wells kalır kontrol edin. Yıkama sırasında yanlışlıkla çöpe bölümleri önlemek için dikkatli olun.
- Arabellek kaldırın ve çözüm engelleme 500 µL ekleyin. Rock RT. en az 1 h için
Not: % 5 sera kullanılmak üzere ikincil her antikor ana tür içeren bir engelleme çözüm kullanın (Tablo malzemeler için başvurmak). - Incubate 300 µL birincil antikorlar 36-72 h bir rocker üzerinde 4 ° C'de için engelleme arabellekte seyreltilmiş. Yıkama iki kez içinde 600 µL 1 TBS-NP40 30 dk her, için bir rocker üzerinde x RT.,
Not: Çift etiketli bölümleri toplam MTs (β-tübülin anti veya α-tübülin anti) ve istikrarlı MTs (anti-Glu-tübülin) veya dinamik MTs (Anti-Tyr tübülin) karşı birincil antikor kuluçka tarafından. Çift Kişilik toplam ve post-translationally etiketleme α-tübülin nüfus zaman yükseltilmiş olan birincil antikorlar farklı ana türler seçin. Antikor dilutions için Tablo malzemeler için başvurmak. - Incubate 300 µL ikincil antikor fluorophore Birleşik bir rock'çı karanlıkta 4 ° C'de 16-24 h için engelleme arabellekte seyreltilmiş. Yıkama iki kez içinde 600 µL 1 TBS-NP40 30 dk her, için bir rocker üzerinde x RT.,
Not: folyo bu noktadan itibaren ve Şoklama önlemek için her işleme sonra ikincil antikor içeren çok iyi yemek sarın. Birincil antikor ana bilgisayar immünoglobulin ile tepki ikincil antikorlar seçin. Ayrı, üst üste emisyon spectra var ikincil antikor fluorophores seçin. Antikor dilutions için Tablo malzemeler için başvurmak. - Kuluçkaya DAPI çözüm üzerinde bir rocker RT. üç kez TBS-NP40 RT 5 min her sallanan içinde yıkama 30 dk için 500 µL embriyoların.
Not: Nükleer etiketleme hücresel için bağlam 1.12 adımda gerçekleştirilen MT miktar sağlar. - Anti-fade ajan ile montaj orta bir damla tozsuz slayt ortasına yerleştirin. İyi forseps bölümleri montaj orta damlacık aktarmak için kullanın. Tozsuz coverslip örnek üstüne yerleştirin. Bir kuru, karanlık ve serin yerde görüntüleme gerçekleştirilene kadar folyo, sarılı, slaytlar depolamak.
Not: ince uçlu kalıcı bir kalem görüntüleme önce kullanarak slayt arka bölümlerde çember ne zaman mikroskop kullanarak bölümleri tanımlamak için yardımcı olacak. - Confocal mikroskop objektif bakan coverslip ile sahneye slayt affixing tarafından tarama ters bir lazer bölümlerde Mount Confocal görüntüleme. Bir denetim slaytta uygun optik (amaç, lazer ve gibi kazanç ve ofset kanal ayarları) belirlemek ve onları örnekleri 27 arasındaki tutarlı tutmak. Veri kaybını önlemek için piksel oversaturating önlemek.
- Kanal ayarları için seçilen ikincil antikor fluorophores kullanarak Z yığınlarının confocal çekim ve görüntü dosyaları 27 kaydedin. Z-yığınlar her bölüm için elde.
Not: rakamlar 2 ve 3 görüntüleri aşağıdaki satın alma ayarlarını kullanarak elde etmek için kullanılan parametreler çoğaltmak: modu XYZ; = objektif büyütme = 63 X yağı daldırma objektif; objektif sayısal diyafram 1.4; = Z-adım 0,1 µm; = Z-derinlik 16.23 = µm. aşağıdaki kanal ayarları kullanın: DAPI uyarma % 20 UV menzilli lazer, emisyon filtre aralığı ile 430-480 nm, photomultiplier (PMT) kazanç = 525 V ve Devresel ödeme mahsup =-1.72 = %; 448 nm fluorophore (Tablo malzemeler için başvurmak) uyarma ile % 20 488 nm lazer, emisyon filtre aralığı = 493-573 nm, devresel_ödeme kazanç 689 V ve Devresel ödeme mahsup =-0.2 = %; 594 nm fluorophore uyarma ile % 32 594 nm lazer, emisyon filtre aralığı = 608-706 nm, devresel_ödeme kazanç 768 V ve Devresel ödeme mahsup =-6.8 = %. - Ham veri dosyaları benzersiz, açıklayıcı bir dosya adlarıyla kaydetmek ve görüntü analiz yazılımı içinde düzenleme için bir kopya oluşturun.
- En fazla tahminlerini görüntülemek için Z-yığınlar derleme
- kamu malı 3 boyutlu görüntü analiz yazılımı (örneğin, ImageJ) kullanarak veri dosyası kopyayı açın. Her kanal bireysel görüntü sırası (Z-yığınlar) görünür onay.
- Aşağıdaki menü sırasını kullanarak görüntü kanallarına bölme: “ görüntüleri/renk/Split kanalları ”.
- Aşağıdaki menü sırasını kullanarak kanalları ilgi overlaying tarafından Birleştirilen görüntüyü oluşturun: " görüntüleri/renk/birleştirme kanalları. " 594 seçin nm, 488 nm ve DAPI kanallarını olmak yanlış kırmızı, yeşil ve mavi, anılan sıraya göre. Kontrol " oluştur kompozit " ve seçin " Tamam " 28.
Not: daha iyi detay MTs için belirli Şekil 2 ve 3, en fazla bir projeksiyon ile sadece iki diğer kanallar için yanlış renk seçme iletmek için DAPI kanal atlarsanız. - Birleştirilmiş Z-yığını incelemek ve başlangıç ve bitiş konumlarını uçakların iç en iyi Z-tüm görünür kanallar için not edin. Genellikle düzensiz yüzeyler bölümünün nedeniyle suboptimal sinyal var dış Z-uçaklar görevden. 29 Ayrıntılar için referans bakın.
- Aşağıdaki 3 boyutlu görüntü analiz menü sırası kullanılarak Z yığının en fazla yoğunluk projeksiyon yaparak tek bir 2-B resmi olarak birleştirilmiş Z-yığın görselleştirin: " görüntüleri/yığın/Z-proje. " başlangıç ve bitiş konumlarını iç en iyi girin Z-uçak adım 1.11.3 " başlangıç dilim " ve " dur dilim, " anılan sıraya göre. Seçin " Max yoğunluk " belgili tanımlık projeksiyon tip ve tıkırtı olarak " Tamam ". 28 daha fazla ayrıntı için referans bakın.
- Çözümleme MT etiketleme
- ticari 3 boyutlu görüntü analiz yazılımı açın. Seçin " kitaplığı oluştur " ve resim kitaplığı için açıklayıcı bir ad girin. ' I tıklatın " oluştur. " confocal mikroskop kütüphaneye içe üretilen ham görüntü dosyaları sürükleyin. Daha büyük dosyaları aktarmak için daha fazla zaman gerektirir.
- Analiz etmek için bir dosya seçin. Seçin " genişletilmiş odak " üzerinden " görünümü " kanal birleştirilmiş görüntü ana pencerede görüntülemek için menü.
- Eşik kaydırıcısını aracı her kanal için sola veya sağa doğru sinyal sağlamdır ve arka plan sinyali azalır kadar sürükleyerek ayarlayın. Her kanal için etiketli molekül (örneğin, dikdörtgen veya Mitotik hücre çekirdeği ama değil otomatik-floresan sitoplazma veya özel gösterilen DAPI kanal) gerçek bir sinyal gösterir dikkat.
- Select " serbest bölge, faiz (ROI) " aracı ve analiz edilecek faiz bölge anahat. Seçin " eylemleri " sekmesini ardından " ürün seçimi için " Resmi kırpmak için. Kırpılmış görüntü dosyasını yeni bir adla kaydedin. ' I tıklatın " ölçümleri " belirli nesneler için 3-b analiz ilgili filtre uygulama iletişim kuralı oluşturmak için sekme.
- Drag " nesneleri bulmak " protokolü penceresine. İlk protokol yeniden adlandırmak " DAPI. " DAPI kanal açılan menüden seçin. Aşağıdaki ayarlar DAPI iletişim kuralına sürükleyin ve bunları aşağıda yer " nesneleri bulmak " aşağıdaki sırayla (Tablo 1): " ObjectsŔ delikleri doldurun " Ayrı ObjectsŔ dokunmadan " Hariç nesneleri SizeŔ tarafından " ROIs değil müessir dışlamak ".
Not: Tablo 1 ' deki ayarların amacı ilk dağılımı sinyalleri atar bir eşik ayarlamak için ve boyut nesneleri analiz ediliyor boyutu ile tutarsız. Örneğin, bir sinyal değil kadar bir çekirdek çekirdek sayarken olun büyük ortadan kaldırmak. - Kalan montajı için işlem sırasını (Adım 1.12.9) filtreleri β-tübülin ve Tablo 1 ' de ayarları kullanarak diğer işaretleyiciler için gerçekleştir.
- Select " ölçü " alt kısmında her iletişim kuralı. Seçin " yoğunluğu ve birim ölçü " ve " iskelet uzunluğu ", ama sadece eski DAPI sinyal için tüm tübülin etiketleme için.
- Bir yatırım Getirisi ölçülecek bölgenin çevresinde çizin. Altında ölçümler gözlemlemek " Özeti " sonra bölgenin yazılım işlemleri sekmesi. Veri kopyalama ve uygulanabilir elektronik tablo, Tablo 2 gibi kaydedin. Daha sonraki analizler için elektronik tablonun bir yedek kopyasını oluşturun. Faiz (örneğin, uzunluk MT paket, MT demetleri/çekirdek ile ortaya, sayısı
- seçin Ölçümleri farklı işaretleri) elektronik tablodaki ve ortalama her grup için belirlemek için analiz.
Not: Ortalama MT paket uzunluğu toplamı = ' iskelet uzunluğu β-tübülin için demek ' embriyo toplam numarasına göre bölünmüş her embriyo için. Tablo 2 20 satır bakın. Değişkenleri ve deneysel grupları kolayca grafiği çizilecek elektronik tabloyu biçimlendirin.
2. De Novo MT derleme tahlil (protokol 2)
- Yapı ve test çok iyi akışı aracılığıyla aparatı ( şekil 1) iki gün önce deney.
Not: Cihaz birden çok deneysel grubun nocodazole tedavi malzemeleri malzemelerden tablo kullanarak aşağıdaki aynı anda Silinerek geçiş sağlar. Silikon mühürleyen en az 24 saat önce hiçbir toksisite riski embriyo için kuruma süresi gerektirir.- 50 mL santrifüj tüpü ikiye bölünmüş boyuna, bir jig veya şerit testere kullanarak.
- Kesilmiş 7 yarı daireler 70 µm naylon dışında 3 cm yarıçaplı mesh ve onları sığdırmak için Kırp sıkıca içine split yarısı tüp santrifüj kapasitesi. Akvaryum-güvenli silikon sealer kullanarak 10 mL geçiş işaretler paralel santrifüj tüpü içine yarı daireler tutkal. 2 gündür kuru ve bir ölçek su için 2-3 h. ıslatarak durulama önce cihazın
- Öyle ki akışı aracılığıyla cihazda muhafaza sıvı yüksekliği ¼ inch ( şekil 1, sayısı 2 ve 3) derinliğe sahip kil modelleme ile kesme santrifüj tüpü (dişli) üst kısmına hattı.
- Silinerek geçiş aparat pistonu 50 mL şırıngadan çıkarıp 12 inç iyi hortumunun ucu ekleme hazırlamak. Git ve modelleme kil kullanarak ortak mühür olarak tüp itin.
- Mesh sıvı tüm akışı aracılığıyla cihaz çalışmasına izin vermek için embriyo orta kullanarak önceden ıslak. Açı bütün bölümler ama yine o sıvı havuzları böylece buz üstünde belgili tanımlık aygıt kil RIM olduğu ön kapıdan boşaltır. Bir yüzük stand kullanarak askıya Silinerek geçiş aparat yukarıda akışı aracılığıyla cihazın buz ( şekil 1).
- Embriyo orta buz üzerinde 200 mL soğuk ve yeterli tüm hava kabarcıkları temizlenir ve akış hızı yaklaşık 7 mL/dak ayarlama akış hızı şırınga yüksekliğini değiştirmek olur emin olmak için Silinerek geçiş cihazlar içine dökmek.
- Enzimatik dechorionate embriyo
- non-spesifik proteaz çalışan bir çözüm olarak 10 mg/mL 1 mL sulandrarak non-spesifik proteaz hisse senedi 20 mL embriyo ortamda olun.
- Embriyo 1s timepoint istenen gelişimsel sahne ulaşmak için beklenen zaman önce üzerinde gerçekleştir kimyasal dechorionation. 100 mm Petri yemekler içeren embriyo orta kaldırarak Özet chorions sahnelenen embriyo ve 20 mL non-spesifik proteaz çalışma çözeltisi ekleme.
- Incubate embriyo 5 dk. 37 ° C'de
Not: Değil 5 dk aşan veya bu düşen embriyo yol açar gibi non-spesifik proteaz çözüm, daha yüksek bir konsantrasyon ayrı bir kez nocodazole ile tedavi kullanın. - Hızlı bir şekilde belirsiz proteaz pipet ve yemekleri ile yaklaşık 25 mL embriyo orta doldurma. Bir kez yineleyin.
- 1 mL cam pipet, transfer embriyoların 24 genç kullanarak hpf cam için onları zararlardan korumak için yemekleri.
- Kaldırarak el ile iyi forseps, bir çift kullanarak chorions 1.1.5 adımda anlatıldığı gibi tam dechorionation.
- Yer cam Petri istenen gelişimsel sahne gelinceye dechorionated embriyo 28.5 ° C kuluçka en az 30 dk içeren yemekleri.
- Depolymerize varolan MTs
- 5 µg/mL nocodazole çalışan bir çözüm ile 10 mL buz soğuk embriyo orta 50 µL 1 mg/mL stok nocodazole birleştirerek hazırlayın.
: Eldiven nocodazole, cilt tahriş edici ele alırken dikkatli olun. - Nocodazole tedavi grubunda 10 mL soğuk nocodazole çalışma çözüm ile embriyo orta değişimi. Petri yemekler gelişim aşaması (örneğin, 4-5 somite embriyo için 1 h) için uygun bir zaman için Buza koyun. Tedavi edilmeyen denetim embriyo bir kabında Silinerek geçiş örnekleri 2.3.4.1. adımda yanında düzeltilmesi buzda kenara.
- Transfer embriyoların bir yangın cilalı 1 mL cam pipet deneysel her grup için ayrı bölmeler kullanarak akış yoluyla aparatı için kullanma. Nocodazole silerek geç dökülen buz soğuk embriyo orta tarafından 50 mL şırınga üst içine başlatmak.
Not: deney grubu başına en az 30 embriyo kullanın. Deneysel grupları denetim embriyo veya çeşitli morpholino veya RNA enjekte embriyo oluşması. Silinerek geçiş yaklaşık 150 mL her 8-10 dk. Silinerek geçiş eklemek için embriyo orta toplam buz ile MT büyümesini inhibe devam ederken nocodazole gerektirir. Embriyo buz tutmak bu tahlil başarı için gerekli çünkü MTs kararsız soğuk sıcaklıklarda ve soğuk gecikmeler erken embriyo geliştirilmesinde. - İzin içeren cam Petri yemekler için embriyo transfer tarafından RT, silerek geç 20 dk sonra regrow MTs (28.5 ° C) embriyo orta bir yangın cilalı 1 mL cam pipet kullanarak sıcak. Embriyo transfer olarak bir zamanlayıcı başlatmak.
- Kontrol ve Silinerek geçiş embriyo 1dk düzeltmek, 5 min ve yaklaşık 10 embriyo 1.5 mL pipetting tarafından 10 dk santrifüj kapasitesi 1 mL % 4 İngiltere'de yılın/MAB düzeltme (28.5 ° C) ile dolu tüp ve'ndaki yönergeleri izleyerek 1.2.3 adım.
- 5 µg/mL nocodazole çalışan bir çözüm ile 10 mL buz soğuk embriyo orta 50 µL 1 mg/mL stok nocodazole birleştirerek hazırlayın.
- İmmunolabeling 1.3-1.5 açıklandığı gibi bölümler için örnekleri hazır olun.
- Immunolabel kayan bölümler ve görüntü embriyo olarak açıklanan bölümlerde 1.6-1,10 ile aşağıdaki değişiklikleri birincil antikor özellikleri: Kullanım 1:500 tavşan anti-γ-tübülin ve 1: 200 fare anti-β-tübülin.
- Süreci ve 1.12 adımda anlatıldığı gibi görüntüleri 3 boyutlu görüntü analiz yazılımı kullanarak analiz.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
İmmunolabeling kullanarak istikrarlı ve dinamik MTs analizi
Protokol 1' de, erken (sinirsel salma) sırasında MT alt Nüfus dağılımı ve Nöral tüp gelişimin geç (sinirsel çubuk), Glu-tübülin ve Tyr-tübülin işaretçileri istikrarlı ve dinamik MTs için sırasıyla kullanarak ortaya çıkıyor. Dinamik MTs ağırlıklı arka beyin sinir salma sahne (4-5 somites) (Şekil 2A-D). Salma sinirsel çubuk (11-12 somites), Gelişmiş epithelialization, bir sahne geliştikçe niteliksel daha az MTs ile özellikle ventral çubuk de Tyr-tübülin antikor (Şekil 2E-H), immunoreactive. Buna ek olarak, Glu-tübülin dağınık ve sinirsel salma (şekil 3A-D) boyunca punctate ama ventral sinir çubuk MT yolları (şekil 3E-H) boyunca zenginleştirilmiştir. Ok uçları nerede etiketleme artış belirli MT demetleri veya yapıları üzerine gelin.
Her ne kadar anti-Glu-tübülin ve Tyr-tübülin antikorları (bir çift etiketleme deney önlenmesi) aynı ana türler içinde üretilmiştir, bu sonuçları, istikrarlı ve dinamik MT işaretleri Zebra balığı arka beyin nadiren üst üste gösterir. İlk olarak, ventral sinir çubuk daha kararlı (şekil 3F) dinamik (Şekil 2F) MTs daha vardır. Dorsal sinir çubuk eğilim ters, Zebra balığı bir model ile tutarlı Nöral tüp kadar içinde dorsal doku dinamik kalır neurulation20kurdu. Mitotik iğ tamamen Milli, centrosome ile çakışık yalnızca temel sinir salma (Şekil 2D, ok uçları), Tyr-tübülin antikor ile etiketlenir iken İkincisi, istikrar marker ile etiketlenir Glu-tübülin) Şekil 3 D, ok uçları). Β-tübülin ayirt, her iki deneyleri için ortak tüm MTs dağıtımını deneyci bilgilendirir ve non-spesifik etiketleme kapatmak için bir temel sağlar.
3 boyutlu görüntü analiz yazılımı kullanarak nesneleri ölçme uygun bir tabloya (Tablo 2) organize veri büyük miktarda sonuçlanır. Uzunluğu, sayısı ve alan ölçümleri yapmak için yalnızca alt küme küme küme kümesini çözümlemek için kullanılabilir olan veri kullanıyorsunuz. Değil daha ileri düzeyde çözümlemek veri bileşenlerden biridir tespit nesnelerinin sayısı. Bölümler ve MTs için çekirdek oranı bir tek tedavi durumda benzer kalmalı gibi sayısı arasında değişkenlik değil gibi bu sayı bir iç kalite kontrol kullanılır. Bir aykırı her iki analiz ayarlanan filtrelerle yeniden çalıştırılması gereken veya görüntü çok kötü analiz etmek için etiketli bir göstergesidir. Böylece, tüm aykırı resimler ayarlanan ayarlarla reanalyzed. Aykırı bölüm zavallı etiketleme veya olağandışı nesne sayımları neden olabilir fiziksel hasar belirtileri için incelenmesi gerekir. Bir kez analiz tamamlandı ve kalite kontrol, yararlı bilgiler üzerinden elde edilebilir ham veri gibi ortalama süresi toplam MTS ve MTs veya toplam MTs (Tablo 3) istikrarlı MTs oranı istikrarlı. Bu ölçüm değerlerinin yanı sıra, birçok diğer ölçümler MTs veya ilişkisi hakkında çıkarımlar (çekirdeği, centrosome, vb) diğer hücresel yapılar çizmek için kullanılan 3 boyutlu görüntü analiz yazılımı kullanılarak elde edilebilir.
De novo MT derleme tahlil
Nocodazole tedavi MTs (şekil 4A, 4 D ve 4 G) diffüz etiketleme kaynaklanan depolymerizes. MTs regrow gibi centrosome (şekil 4B, 4E ve 4 H) genişletirler, ancak, bu tek bir düzlemde düzlemsel olmayan kendi yörüngeleri (şekil 4C, 4F ve 4I) nedeniyle açık olmayabilir. Yine de, bazı görüntü analiz yazılımı MT büyüme nocodazole Silinerek geçiş (Tablo 4) sonra bir değerlendirmesini sağlayan 3-b, uzunlukları ölçme yeteneğine sahip bulunmaktadır. Tablo 4 veri kümesinden alınan önemli bir gözlem MTs ortalama uzunluğu analiz Nöral tüp bütün bölgelerinde nocodazole silerek geç sonra zamanla artırmak için görünür olmasıdır. Yukarıda belirtildiği gibi 3 boyutlu görüntü analiz yazılımı elde edilen ölçümler diğer türleri (örneğin, oranı MTs çekirdek başına) MT verileri yorumlamak için hücresel bağlam sağlar.
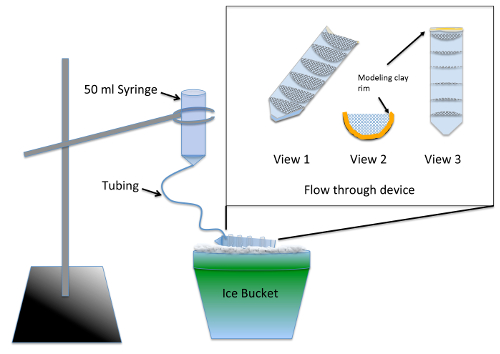
Resim 1 : Çizimi için Silinerek geçiş aleti de novo MT derleme tahlil. İlave bir close-up uzunlamasına kesilmiş bir 50 mL santrifüj tüpüne yapıştırılmış kafes yapılan akışı aracılığıyla cihazı var. Öyle ki birden fazla deneysel grup aynı anda işlenebilir mesh akışı aracılığıyla aygıt compartmentalizes. Kullanım sırasında embriyo orta şırınga için eklenir ve yavaş yavaş sabit bir durulama için tüm deneysel grupları sağlayan akış yoluyla aygıt, doldurmak için boru üzerinden akışı. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Resim 2: immunolabeling dinamik MTS'yi görüntü kullanımı Dechorionated embriyo uygun aşamaları (4-5'te A-D ve 12-13 somites E -h), kemiği arka beyin ve β-tübülin ( A ve Eyeşille) karşı antikor ile immunolabeled kesitli, tespit edildi dinamik MT nüfus ortaya çıkarmak için tüm MTs ve tyrosinated α-tübülin (kırmızı B ve F) işaretlemek için. Son derece dinamik MTs sarı etiket görünür (ok uçları d , H) alanlarda nereye olarak birleştirilmiş görüntüler (C, G) ve onların daha yüksek büyütme (D, H) görülebilir. Ölçek çubukları 25 µm (A-C ve E-G) ve 10 µm (D ve H) =. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Fkullanarak 3: istikrarlı MTS'yi görüntüye immunolabeling kullanımı Dechorionated embriyo, arka beyin ve immunolabeled aracılığıyla uygun aşamalarında ( A -D ve 12-13 somites E -h 4-5 somites) kesitli tespit edildi. Toplam MTs genel β-tübülin antikor ( A ve Eyeşil) ile görüntülenir süre istikrarlı MTs ile α-tübülin (Glu-tübülin) detyrosinated şeklinde karşı antikor (kırmızı B ve F) etiketlenir. Kırmızı ve sarı sinyalleri birleştirilmiş görüntüler (C, G) ve (D, H) onların daha yüksek büyütme alanlar yüksek MT istikrar (d, H ok uçları) gösterir. Ölçek çubukları 25 µm (A-C ve E-G) ve 10 µm (D ve H) =. Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Şekil 4: immunolabeling yeni doğmakta olan MTS'yi görüntü kullanımı Dechorionated embriyo 4-5 somites sabit ve kemiği ile arka beyin kesitli. Bölümler immunolabeled β-tübülin (D, E ve F) MTs büyüyen işaretlemek için ve γ-tübülin (A, Bve C) çekirdekleşme noktası/centrosome işaretlemek için vardı. Nöral tüp dorsal bölge (A, D; içinde kutulu B, E ve C-F) ve daha yüksek büyütme oranında gösterilir (G, H, ben, sırasıyla) çekirdeği (DAPI, mavi), centrioles (γ-tübülin, kırmızı) ve toplam ortaya çıkarmak için MTs (β-tübülin, yeşil). Beyaz ok uçları: colocalization MTs ve centrioles; Sarı ok: bir hücre ikinci centriole görülür. Ölçek çubukları = 25 µm (A-F) ve 10 µm (G-ı). Bu rakam daha büyük bir versiyonunu görüntülemek için buraya tıklayınız.

Tablo 1: 3 boyutlu görüntü analiz yazılımı nesneleri filtre uygulamak için varsayılan ayarlar.

Tablo 2: temsilcisi ham veri kümesi 3 boyutlu görüntü analiz yazılım analiz etmek için kararlı MTs kullanılarak elde. Her sütun tek bir bölümünden ölçümleri temsil eder. Dk: en küçük ölçüm; Max: en büyük ölçüm; SD: Standart sapma; SE: Standart hata.

Tablo 3: 3-b elde edilebilir veri kümeleri örnekleri resim istikrarlı MTs ölçmek için analiz yazılımı. Toplam (β-tübülin) ortalama uzunluğu ölçümleri seçin ve tüm örnekleri ( Tablo 2' ye bakın) ilgili etiketten için ortalama iskelet uzunluğu ortalama ve istikrarlı oranını düşülerek hesaplanan (Glu-tübülin) MTs MTs (Toplam için kararlı Glu-tubulin çizgiler β-tübülin çizgileri) ortalama Glu-tübülin sayısına göre bölünmüş ortalama β-tübülin sayısı düşülerek hesaplanan.

Tablo 4: Bu analiz etmek için 3 boyutlu görüntü analiz yazılımı elde edilebilir veri kümeleri örnekleri de novo MT derleme. Üç kurtarma zaman puan (1, 5 ve 10 dk) için nocodazole başarısız sonra elde edilen veri kümelerini karşılaştırma temsilcisi de novo MT derleme sonuçlarından deneme. Her zaman noktası için nükleer sayısı, centrioles (γ-tübülin puncta), toplam MTs (β-tübülin çizgiler) sayısı için elde edilen ölçümler gösterilir seçili görüntülü bölgelerinde (gelişmekte olan Nöral tüp kesiti) analiz.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Şu anda pek çok yöntem vardır MT dynamics erken Zebra balığı geliştirme görüntüleme için doku11,12,13,14sabit dan tagged moleküllerin canlı görüntüleme immunolabeling için değişen. Tek bir hücrede MTs dinamik ya da istikrarlı Devletleri'nde bulunabilir rağmen epithelialization içinde aşamalı olarak zaman içinde MTs bağları bir süreçtir. İstikrarlı ve dinamik MTs için işaretçileri kullanarak bu fenomen görselleştirmek için bir yol sunar. Burada sunulan yöntemi dinamik bir kesit istikrarlı MT nüfus embriyonik Zebra balığı doku geçiş ölçmek için 3-b görüntüleme yazılımı gücünü güçlendirir. Protokolü 2' de, yeni doğmakta olan MTs ayrı bir nüfusa etiket ve onların çekirdekleşme ve büyüme fazla mesai takip yöntemi kullanılır.
MTs içinde onların yerli durum depolymerize için onların eğilimi nedeniyle görüntü Rootkitler zordur. Böylece, temel bu yöntemin MTs hızlı fiksasyonu boyunca tüm embriyo bileşendir. Bu fizyolojik sıcaklıklarda fiksasyon başlayan ve hem MTs stabilize ve embriyo geçirgenliği artar bir arabellek kullanarak elde edilir. Fiksasyon zaman aşırı fiksasyon epitopları antikor bağlama ile müdahale, maske yapabilirsiniz iken kısıtlandığını fiksasyon tutuklama MTs başarısız olarak önemlidir. Önerilen fiksasyon zaman 3-4 h 24 h sonrası döllenme için orta gastrulasyon doldu embriyo ile çalışır. Büyük embriyo tüm 4 h gerekebilir iken embriyolar zaman ölçeği genç sonuna doğru için daha yakın 3 h için sabit olmalıdır. Kesit ve immunolabeling sabitleme bir hafta içinde meydana gerekir bu yüzden bile uygun fiksasyon ile MTs zamanla depolymerize.
Kez doku düzgün Sabit sorunları ile immunolabeling ortaya çıkabilir. Eğer çok fazla bölüm aynı kuyuda inkübe karşılaşılan en yaygın sorun özellikle, doku, Merkezi aracılığıyla zavallı penetrasyon olmuştur. Birincil ve ikincil antikorlar, embriyoların permeabilization geliştirmek için deterjanlar artan ile kombine birincil antikor ve kuluçka süre konsantrasyonu artan immunolabeling problemlerin çoğunu iyileştirmek. Antikor etiketleme fiksasyon konu veya immunolabeling sorunu nedeniyle başarısız olursa, desen etiketleme antikor inceleyerek nedenini belirlemek mümkündür. Zavallı fiksasyon yoğun membran etiketleme içinde neden olur ve sitoplazma içinde etiketleme diffüz, aşırı fiksasyon neden olur iken zayıf etiketleme MT mimari korur. Antikor, zavallı penetrasyonu ancak, doku merkezi alanlarında etiketleme olmadan görünür.
MT görüntüleri anlamlı bir şekilde analiz yeteneği yüksek kaliteli görüntüleme üzerinde bağlıdır. MT uzunluğu 3-b yakalamak için objektif ve sayısal diyafram için olası en az Z-adım boyu kullanılmalıdır. Burada gösterilen görüntü yakalanan edildi 63 X Petrol emersion amacı ile aşağıdaki üreten 1.4 sayısal diyafram ile: piksel = 240 nm, Z-adım 0,1 µm, Z-yığın boyutu = 16.252 µm =. Çünkü tek bir MT genişliği 25 nm, kabaca 10 kat aşağıda bir ışık mikroskobu, bu metrik için çözünürlük sınırının doğru olamaz ölçülen bu tekniği kullanarak. Bunun yerine, tek MT uzunlukları tüm üç boyutlu olarak ulaşılabilir en az piksel boyutundan büyük veya eşit ölçülebilir. Satır ve/veya ortalama çerçeve MT sinyal tanımı geliştirebilirsiniz. MT analizi yüksek kaliteli bölümler için rezerve edilmesinin gerekip. Zavallı fiksasyon ile doku görüntüsü ve analiz, hafif overfixation dikkatle lazer yoğunluğunu artırarak karşı dengeli ve iyi bir Dinamik Aralık koruyarak zayıf sinyal algılamak için kazanmak. Zavallı antikor penetrasyon, değil en iyi olsa da, resim alma ince bölümü (5-10 µm) Imaging'de kaynaklanan iyi etiketli bölgeye sınırlayarak düzeltilebilir. Etiketleme üzerinden yüksek arka plan filtre ayarlarını yaparak için telafi. Eğer herhangi bir Bu ayarlamalar yapılır, ancak, doğrulamak gerekli filtreleri eşik her uçağa Z yığının üzerinde çalışarak.
3 boyutlu görüntü analiz yazılımı deneyci MT uzunluk, alan, açı, bereket ve diğer ölçümler sabit doku Bölüm 3-b alan ölçmek sağlar. Burada anlatılan yöntem piyasada bulunan yazılım kullanarak bu verileri elde etmek için yönergeleri sağlar. Ancak, filtre uygulama modülleri ile ilgili eklentileri ve/veya makrolar, analiz için tüm kullanılabilir hale gelişmiş kamuya açık yazılım adapte olabilir. Önce analiz, raw resimleri arka plan ve belirsiz sinyaller miktar eklemeyi önlemek için thresholded olmalıdır. Bir kez analiz tamamlandı ve uygulanabilir bir elektronik tabloya veri aktarılır, birçok çıkarımlar veri kümesinden yapılabilir. Burada yapılan hesaplama Glu-tübülin çizgileri β-tübülin çizgiler veya istikrarlı MTs oranını başına toplam MTs için burada tüm MT sitoiskeleti bir ROI stabilize 1 gösterir biriydi. Deneyci nicel verilerine tamamlayacak bir cilalı etiketli görüntü dosyası biçimi (TIFF) üreten isterse görüntü ölçek çubukları ile 3 boyutlu görüntü analiz yazılımı ile zahmetsizdir.
Bu tahlil MT derlemede, içinde vivokarıştığı proteinler fonksiyonel analiz sağlar. İmmunolabeling seri bölümler alternatif gerçekleştirilirse, bu iletişim kuralı aynı embriyo dinamik ve istikrarlı MTs eğitim için kullanılabilir. Gelecekte, artan deterjanlar veya değiştirilmiş gömme açıları gibi değişiklikleri büyük embriyolar için bu yöntemlerin kullanımı ve anatomik sorular daha geniş bir yelpazesi sağlayacak.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Yazarlar ifşa gerek yok.
Acknowledgments
Confocal mikroskop fonları ile ABD Ulusal Bilim Vakfı (NSF üzerinden), grant #DBI-0722569 satın alınmıştır. Araştırma tarafından ABD Ulusal kurumları, sağlık/Ulusal Genel tıbbi Bilimler Enstitüsü (NIH/NIGMS) hibe #GM085290 ve ABD Savunma Bakanlığı (DOD) hibe #W81XWH-16-1-RM Brewster'a layık 0466 desteklenmiştir. E. Vital Howard Hughes tıp Enstitüsü öncesi üniversite ve lisans bilim eğitim programı aracılığıyla UMBC için bir hibe tarafından desteklenmiştir, #52008090 verin. S.P. Brown bir ABD bölümü, eğitim GAANN arkadaş grubu tarafından desteklenen, Meyerhoff Yüksek Lisans Bursu NIH/NIGMS grant tarafından finanse #GM055036 ve bir bilimsel araştırma ABD Savunma Bakanlığı hibe #W81XWH-16-1-0466 tarafından finanse edilen Asistanlığına Giriş.
Materials
| Name | Company | Catalog Number | Comments |
| Agarose | Used to treat petridishes. Prepare 1% agarose by heating a solution of 1 gram agarose per 100 ml 1X embryo medium in a microwave until polymerized. |
||
| Kpipes | Sigma | P7643 | |
| NaCl | Sigma | S7653 | |
| Tris-HCl | Sigma | T3253-500G | |
| KCl | Sigma | P9333-500G | |
| CaCl2·2H2O | Sigma | C5080 | |
| NP-40 | American Bioanalyticals | AB01424 | |
| EGTA | Sigma | E3889-25G | |
| MgCl2 | Sigma | M2670-500G | |
| Bovine serum albumin (BSA) | Fisher | BP1605 | |
| Triton-x | American Bioanalyticals | AB02025 | |
| Anti-Fade mounting medium | Invitrogen | P10144 | |
| Mouse anti-β-tubulin | Developmental studies Hybridoma Bank | E7 | 1/200 |
| Rabbit anti-γ-tubulin | Genetex | GTX113286 | 1/500 |
| Rabbit anti-α-tubulin | Genetex | GTX108784 | 1/1000* |
| Rabbit anti-detyrosinated-tubulin | Millipore | AB3201 | 1/200-1/1000* Titrate antibody with first use of new lot. |
| Rabbit anti-tyrosinated-tubulin | Millipore | ABT171 | 1/500 |
| Mouse anti-centrin | Millipore | 04-1624 | 1/1000 |
| Goat 488 anti-rabbit | Thermofisher | A11008 | 1/500 |
| Goat 594 anti-rabbit | Thermofisher | A11012 | 1/500 |
| Goat 594 anti-mouse | Thermofisher | A11005 | 1/500 |
| Goat 488 anti-mouse | Thermofisher | A11001 | 1/500 |
| Vibratome | Vibratome | 1500 | |
| Forceps | World Precision Instruments | 555227F | |
| 100 mm petri dish | Cell treat | 229693 | |
| 35 mm petri dish | Cell treat | 229638 | |
| 50 ml falcon tube | Fisher | 14-432-22 | |
| Woven nylon mesh 70 um | Amazon.com | B0043D1SZG | |
| Micropipette | Gilson | F123602 | |
| Glass pipette | Fisher | NC-999363-9 | |
| Aquarium sealant | Amazon.com, by MarineLand | Silicone Sealer 1 oz (Tube) | |
| Ring stand | Fisher | 14-675BO | |
| Microbore PTFE Tubing, 0.022"ID | Cole-Parmer | WU-06417-21 | |
| Modeling clay | Amazon.com | Sargent Art 22-4000 | Any wax or oil based non-toxic modeling clay will suffice |
| Clamp | Fisher | 02-215-466 | |
| 60ml syringe | Fisher | 14-820-11 | |
| Embryo medium (E3) | 34.8 g NaCl 1.6 g KCl 5.8 g CaCl2·2H2O 9.78 g MgCl2·6H2O To prepare a 60X stock, dissolve the ingredients in H2O, to a final volume of 2 L. Adjust the pH to 7.2 with NaOH. Autoclave. To prepare 1X medium, dilute 16.5 mL of the 60X stock to 1 L. |
||
| Blocking Solution | 50 ml TBS-NP-40 2.5 ml normal goat serum 1 g BSA 625 µl Triton-X |
||
| TBS-NP-40 (pH 7.6) | 155 mM NaCl 10 mM Tris HCl 0.1% NP-40 |
||
| 2x MAB (pH6.4) | 160 mM KPIPES 10 mM EGTA 2 mM MgCl2 |
||
| Commercial 3-D Image processing Software | PerkinElmer | Volocity (V 6.2) | |
| Dry block heater | VWR | 12621-108 | Used as a hot plate to melt agarose in Protocol 1. |
| Dissecting Microscope | Leica | MZ12 | |
| Confocal Microscope | Leica | SP5 | |
| Flat embedding mold | emsdiasum.com | BEEM 70904-01 | |
| Public domain image processing software | NIH | ImageJ (V 1.5) | |
| * Success varies by lot number | |||
References
- Akhmanova, A., Steinmetz, M. O. Tracking the ends: a dynamic protein network controls the fate of microtubule tips. Nat Rev Mol Cell Biol. 9 (4), 309-322 (2008).
- Conde, C., Cáceres, A. Microtubule assembly, organization and dynamics in axons and dendrites. Nat Rev Neurosci. 10 (5), 319-332 (2009).
- Kaverina, I., Straube, A. Regulation of cell migration by dynamic microtubules. Semin Cell Dev Biol. 22 (9), 968-974 (2011).
- Kollman, J. M., Merdes, A., Mourey, L., Agard, D. A. Microtubule nucleation by γ-tubulin complexes. Nat Rev Mol Cell Biol. 12 (11), 709-721 (2011).
- Howard, J., Hyman, A. A. Growth, fluctuation and switching at microtubule plus ends. Nat Rev Mol Cell Biol. 10 (8), 569-574 (2009).
- Schulze, E., Kirschner, M. Dynamic and stable populations of microtubules in cells. J Cell Biol. 104 (2), 277-288 (1987).
- Gundersen, G. G., Kalnoski, M. H., Bulinski, J. C. Distinct populations of microtubules: Tyrosinated and nontyrosinated alpha tubulin are distributed differently in vivo. Cell. 38 (3), 779-789 (1984).
- Li, R., Gundersen, G. G. Beyond polymer polarity: how the cytoskeleton builds a polarized cell. Nat Rev Mol Cell Biol. 9 (11), 860-873 (2008).
- Asakawa, K., Kawakami, K. A transgenic zebrafish for monitoring in vivo microtubule structures. Dev Dyn Off Publ Am Assoc Anat. 239 (10), 2695-2699 (2010).
- Wühr, M., Tan, E. S., Parker, S. K., Detrich, H. W., Mitchison, T. J. A model for cleavage plane determination in early amphibian and fish embryos. Curr Biol CB. 20 (22), 2040-2045 (2010).
- Tran, L. D., Hino, H., et al. Dynamic microtubules at the vegetal cortex predict the embryonic axis in zebrafish. Development. 139 (19), 3644-3652 (2012).
- Butler, R., Wood, J. D., Landers, J. A., Cunliffe, V. T. Genetic and chemical modulation of spastin-dependent axon outgrowth in zebrafish embryos indicates a role for impaired microtubule dynamics in hereditary spastic paraplegia. Dis Model Mech. 3 (11-12), 743-751 (2010).
- Yoo, S. K., Lam, P. -Y., Eichelberg, M. R., Zasadil, L., Bement, W. M., Huttenlocher, A. The role of microtubules in neutrophil polarity and migration in live zebrafish. J Cell Sci. 125 (23), 5702-5710 (2012).
- Andersen, E. F., Halloran, M. C. Centrosome movements in vivo correlate with specific neurite formation downstream of LIM homeodomain transcription factor activity. Development. 139 (19), 3590-3599 (2012).
- Lee, S. -J. Dynamic regulation of the microtubule and actin cytoskeleton in zebrafish epiboly. Biochem Biophys Res Commun. 452 (1), 1-7 (2014).
- Bulinski, J. C., Gundersen, G. G. Stabilization and post-translational modification of microtubules during cellular morphogenesis. BioEssays. 13 (6), 285-293 (1991).
- Magiera, M. M., Janke, C. Chapter 16 - Investigating Tubulin Posttranslational Modifications with Specific Antibodies. Methods Cell Biol. 115, 247-267 (2013).
- Hong, E., Jayachandran, P., Brewster, R. The polarity protein Pard3 is required for centrosome positioning during neurulation. Dev Biol. 341 (2), 335-345 (2010).
- Westermann, S., Weber, K. Post-translational modifications regulate microtubule function. Nat Rev Mol Cell Biol. 4 (12), 938-948 (2003).
- Jayachandran, P., Olmo, V. N., et al. Microtubule-associated protein 1b is required for shaping the neural tube. Neural Develop. 11, 1 (2016).
- Nam, S. -C. Role of Tau, a microtubule associated protein, in Drosophila photoreceptor morphogenesis. Genes N Y N 2000. 54 (11), 553-561 (2016).
- Abal, M., Piel, M., Bouckson-Castaing, V., Mogensen, M., Sibarita, J. -B., Bornens, M. Microtubule release from the centrosome in migrating cells. J Cell Biol. 159 (5), 731-737 (2002).
- Delgehyr, N., Sillibourne, J., Bornens, M. Microtubule nucleation and anchoring at the centrosome are independent processes linked by ninein function. J Cell Sci. 118 (8), 1565-1575 (2005).
- Manning, J. A., Lewis, M., Koblar, S. A., Kumar, S. An essential function for the centrosomal protein NEDD1 in zebrafish development. Cell Death Differ. 17 (8), 1302-1314 (2010).
- Kimmel, C. B., Ballard, W. W., Kimmel, S. R., Ullmann, B., Schilling, T. F. Stages of embryonic development of the zebrafish. Dev Dyn Off Publ Am Assoc Anat. 203 (3), 253-310 (1995).
- Beck, A. P., Watt, R. M., Bonner, J. Dissection and Lateral Mounting of Zebrafish Embryos: Analysis of Spinal Cord Development. JoVE J Vis Exp. (84), e50703 (2014).
- FÖldes-Papp, Z., Demel, U., Tilz, G. P. Laser scanning confocal fluorescence microscopy: an overview. Int Immunopharmacol. 3 (13-14), 1715-1729 (2003).
- Ferreira, T., Rasband, W. S. ImageJ User Guide - IJ 1.46. , Available from: https://imagej.nih.gov/ij/docs/guide/ (2010).
- Z-functions - ImageJ. , Available from: https://imagej.net/Z-functions (2017).



