Summary
本稿では、ラット脳の抵抗血管での血管の機能を評価するためのビデオ顕微鏡検査のプロトコル体外について説明します。原稿もレーザー レーザードップラー血流計を用いた蛍光に分類されたレクチンと組織潅流と微小血管密度を評価するための手法を説明します。
Abstract
このプロトコルの分離脳抵抗動脈 (と他の船舶) の血管機能を評価するための in vitroテレビ顕微鏡の使い方について説明し、レーザー ドップラー血流計 (LDF を使用して組織の血流を評価するための手法について説明します) と蛍光を用いた微小血管密度グリフォニア simplicifolia (GS1) レクチンをラベル付けします。現在の勉強方法貫圧力発生体内抵抗血管を分離、実質細胞の影響のない状態で生体内での研究と分子から得られる情報との間の重要なリンクを提供個体レベルでの統合的な応答に限られた洞察力を提供する還元主義的アプローチ。LDF とテクニックは、GS1 の蛍光標識レクチンと細動脈と毛細血管を選択的に識別するためには、分離抵抗血管の研究から得られた知識を拡張する捜査官を可能にする実用的なソリューションを提供します。本稿血管生理学一般実験モデルとしてラットの病理学の基礎的知識を得るためにこれらの技術の応用と専門の様々 な提供することができます「デザイナー」ラット系統遺伝子組み換え特定の遺伝子が重要な血管表現型に与える影響の重要な洞察力。ノックアウト マウス モデルで開発した科学的前提の厳しさを拡大する選択的な繁殖戦略と、ラットの遺伝子ノックアウト モデルを生産するための新しい技術によって開発されたラット系統でこれらの貴重な実験的アプローチを活用し、人の知識をよく理解の生理学的背景とサイズが大きいため生体への適合性、関連性の高い動物モデルを拡張します。
Introduction
多くの利用動脈導管動脈における血管機能の初期の研究の場合、大動脈です。太い動脈の力発生一般的に動脈のリング セグメントを組織内の力覚センにアタッチすることにより検討しました。大動脈の場合ヘリカル切削によってストリップ容器の平滑筋線維間の接続点との収縮によって発生する力の最良推定値を提供するために、力覚セン縦方向に指向されたので、その縦軸に沿って平滑筋。大動脈のヘリカル ストリップを切断するための標準的な方法は、血管の内腔にガラス棒を置いて、希望の角度で血管壁に切れ込み、カットは全体を生成する拡張された血管壁の露出の端の端につかまって容器のヘリカル ストリップ。その時点では、血管の内皮側だった容器ストリップを合力トランスデューサーに接続して、酸素の準備を水没前に破片を削除する一般的に消された、温度制御組織バス。最終的には、アプローチが Furchgott、Zawadski1、すなわち内皮の役割によって生理学の歴史の中で最も有名で重要な発見の一つにつながった由来リラックス因子 (EDRF)、その後に窒素酸化物で識別されます。血管機能を調節します。その発見につながる重要なイベントは調査官が外部表面と動脈の内皮側との接触を避けることでそのまま血管内皮細胞を維持し、大動脈のストリップは予想される展示していないことに気づいた状況アセチルコリン (ACh) が、ACh の応答の代わりにリラックスに収縮します。その観察に基づいて、調査官大動脈の標準はすばのストリップを (しかし、収縮力を生成できません) そのまま内皮と大動脈セグメントを接続いる「サンドイッチ」準備を開発し、ACh による変換緩和に収縮します。
この分野で現在広く使用されている 2 つの主要な進歩は、小さな抵抗動脈2,3でアクティブな収縮力を測定する製剤の開発(小腸間膜3のものなど) と抵抗動脈準備4,5,6を cannulated。最も早いレポートのいずれか、Mulvany とハルパーン3は自然発症高血圧ラット (SHR) の小腸間膜から分離抵抗血管の収縮力を勉強するワイヤー第 1 報準備の使い方を説明し、正常血圧 WKY コントロール。ワイヤー第 1 報システムの開発後、● キャニュレイテッド抵抗動脈準備は生体内での条件4,5,6に近い血管の研究を許可するように開発されました。 両方のアプローチは、貴重な結果を提供する、効果的な動脈の本質的なアクティブな調子を維持以上の追加のメリットがあります ● キャニュレイテッド動脈準備経壁圧と容器のレスポンス流量と血管内皮のせん断応力の変化の変化に筋活動を研究する研究者を許可して (を参照してくださいハルパーンとケリー6レビュー)。
本稿の主要な目標は重要なこれらのアクティブなトーンを調節するメカニズムに関する正確な情報を得るために分離、● キャニュレイテッド抵抗血管を用いたビデオ顕微鏡の昔ながらの手法を採用する方法を説明します血管、神経、体液、または実質のセルの独立に影響します。この基本情報は、採用の標準ラット モデルとの私たちの研究から例を新しい遺伝子ラット系統を設計、テレビで得られる血管の機能に関する洞察力の種類の考えを読者に提供します顕微鏡のアプローチ、およびすべてのコントロールおよび治験責任医師の選択、選択的近親交配によって生成される強力な新しいラット実験的モデルを含むと新開発の遺伝の実験グループを含む研究を用いることができます。エンジニア リング技術。
テレビ顕微鏡アプローチの精度のおかげで準備 ● キャニュレイテッド動脈径変化の測定は、血管の内皮依存性および内皮非依存性のメカニズムに関する非常に貴重な情報を提供できます。リラクゼーションだけでなく、高血圧、塩分の高い食事やその他の実験的介入で発生している血管の制御機構に重要である (および時々 予期しない) 変更。さらに、圧径関係の測定が分離し、Ca2 +との処置で最大限にリラックスして抵抗血管を cannulated-無料のソリューションまたは薬理学的血管拡張薬、評価を使用できます動脈血管リモデリングにより、動脈機能に影響を与えることができます動脈の受動的な機械的性質の変化の重要な洞察を提供することができる受動的な応力-ひずみ関係7を計算するための構造変化アクティブな制御機構の独立の (またはに加えて) を変更します。また、分離抵抗血管の研究から得た情報をことができます LDF、個体レベルの8,9 組織灌流の評価のための実用的な方法を利用した得られた情報によって補われることに注意してくださいすることが重要です。 ,10GS1 の蛍光標識レクチンを用いた微小血管密度の評価から得た情報によっては、具体的には、小細動脈と毛細血管の11の基底膜の糖鎖に結合して,12します後者のメソッドは、船生体内で、たとえば非灌流を数えることで微小血管密度の推定に古典的な困難を受けにくい微小血管密度の非常に正確な見積もりを提供します。血管の細動脈のアクティブな閉鎖のための血流の停止場所。これらのアプローチが分離抵抗動脈微小循環レベルでの組織の血流の変化に与える機能的変化を関連付けるための重要な洞察力を提供できる一緒に使用する場合● キャニュレイテッド動脈技術と組み合わせてこれらの貴重なアプローチの使用のいくつかの例は、本稿も提供されます。
本稿はザイモグラムの Sprague-dawley ラットの動脈の血管の変化を評価するビデオ顕微鏡検査の技術の使用に焦点を当てください。ただし、これらのテクニックが非常に貴重な品種改良や遺伝子技術を使用して、編集によって作成された専門性の高い遺伝子組み換えラット系統の表現型の変化を解明する証明されていることに注意してくださいすることが重要です。本稿では、どのようにビデオ顕微鏡検査の技術の例は最も広くダール食塩感受性 (SS) ラットの近交系ラットの歪みを含むモデル数貴重なラットの血管機能に関する重要な情報を提供しているを提供します。塩の機密 hypertenson18,19,20,21,22,23; のメカニズムを研究するのに実験モデルを使用塩を区別しないブラウン ノルウェー (BN) ラット系統 SS ラットの選択的な育成によって作成されるコンソミック ラット。コンソミック ラット パネルでブラウンのドブネズミからすべての染色体は、ダール SS24,25,26遺伝的背景に個別に交雑をされています。コンソミック ラット パネルの使用は、血圧と血管反応性24,25,26 を含む他の表現型の塩の感受性に貢献する特定の染色体に関する貴重な手がかりを提供しています。 ,,2728。
SS ラットおよび個々 の BN の染色体を運ぶコンソミック ラットを用いた選択的な繁殖戦略もダール SS 遺伝的に個々 のブラウン ノルウェー染色体交雑の小さなセグメント狭窄コンジェニック系統の世代を有効にしています。背景22,29。これらは、非常に貴重な入力の特定の遺伝子を提供したり、血圧、腎障害、血管反応性22,29などの重要な生理学的変数に影響を与えることができる染色体の地域を絞り込みます。ラットの遺伝ツールボックスに別の強力な追加、編集テクニック ZFNs、転写活性化ようなエフェクター核酸分解酵素 (TALENS) を含む高度な遺伝子を利用したラット遺伝子ノックアウト モデルの開発と最近 CRISPR Cas913 ,14,15,16,17。ラットをノックアウトする遺伝子を有効にこれらの強力な技術の出現は非常に重要な開発、遺伝子ノックアウト研究 (および使用し続ける) マウスを使用しているためほとんど専ら。本論文では実験的なコンポーネント別 ● キャニュレイテッド動脈技術とビデオ顕微鏡マスター抗酸化と細胞保護転写を欠けてノックアウト ラットの生理学的制御メカニズムを評価するための値を示します係数、核因子 (赤血球由来 2) - のような - 2 (NRF2)30,31, Sprague-dawley 遺伝的背景17TALEN 技術を使用して開発されました。NRF2 遺伝子の損失の機能検証を提供し、NRF2 を介した抗酸化物質の直接のアップレギュレーションに基づく可能性がある貴重な治療アプローチをテストに使用されたビデオ顕微鏡技術の in vitro実験、防御。NRF 2 は、ビタミン C や E32など抗酸化物質の直接投与を含む臨床試験の期待はずれの結果に照らして、人間の血管の酸化ストレスを闘う相当な治療の重要性の。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
大学のウィスコンシン州機関動物医療および使用委員会 (IACUC) 承認本稿に記載されているすべてのプロトコルとすべての手順に準拠して、国立衛生研究所 (NIH) オフィスの実験室の動物福祉 (OLAW)規制。
1. ソリューションおよび容器室の準備
- 一連の実験を行う前に準備 278 g/L; 塩化ナトリウムから成る塩ストック溶液 x 20 の 2 L14 g/L 塩化カリウム;11.52 g/L MgSO4.7 H2O;9.4 g/L CaCl2.2 H2o.また 80.8 g/L NaHCO3と 0.4 g/L, EDTA から成る濃縮緩衝在庫 × 20 の 2 L を準備し、20 倍の 2 L が集中して Ca2 +-無料原液 281.6 グラム/L の NaCl; から成る14 g/L KCl と 11.52 g/L MgSO4.7 H2o.
注: 原液 X 20 は、使用するまで冷蔵庫に格納することができます。 - 実験の日、準備 2 L 生理的食塩水 (PSS) の濃縮原液 x 20 から次のように: 1,800 mL の脱イオン水 2 L 三角フラスコまたは電動攪拌板のビーカーに加える塩在庫 x 20 の 100 mL。バランスを N2、および磁気攪拌棒でかき混ぜ、21% O2, 5% CO2を含む混合ガスによるソリューションを継続的に, 中 20 x 緩衝在庫の 100 mL を追加します。の pH を監視しながらゆっくりと 0.28 g NaH2PO4を追加します。パスツール ピペットから 6 N 塩酸または 6.5 N NaOH 溶液の滴を追加することによって pH 7.4 に必要に応じて調整します。PSS の準備し、pH の調整、PSS にグルコースの 1.98 g を追加します。
注意: ゆっくり最後ので PSS の pH を監視しながら NaH2PO4を追加するが重要です NaH2PO4アルカリ溶液添加 (pH > 7.4) によって示されるリン酸カルシウムの沈殿物を形作ることができる、曇りのソリューションまたはコンテナーの底に白い沈殿物の外観。
注: PSS の最終的な組成は 119 mM/L 塩化ナトリウム;4.7 mM/L 塩化カリウム;1.17 mM/L Mg24;1.6 mM/L CaCl2;1.18 mM/L NaH2PO4;24 mM/L NaHCO3;0.03 mM/L EDTA;5.5 mM/L ブドウ糖。研究所の中で、PSS の組成が異なるが、このレシピは血管緊張、血管内皮機能と分離抵抗血管における血管作動性反応の維持に最適。 - 最大径を決定して容器の最大拡張を生産して動脈のアクティブ トーンを評価するには、Ca2 +の 500 mL を準備-25 mL 20 X Ca2 +を追加することで、PSS を無料-無料の 450 mL の脱イオン水に塩のストック、上記 1.2 のステップに三角フラスコやビーカーと同様で緩衝在庫 x 20 の 25 の mL に続いて。監視と、溶液の pH を調整しながら NaH2PO4 0.07 g をソリューションに追加します。Ca2 +の細胞内 Ca2 +ストア通常 PSS の血管反応に影響を与える可能性を破壊を避けるために実験の終わりに PSS 貯水池と容器室に無料 PSS が追加されます。Ca2 +-PSS にグルコースを追加する必要はありません、動脈の最大緩和を生成する実験の終わりに無料のソリューションが追加されます。
注: が完了したら、最終的な組成の Ca2 +-無料の PSS は 120.6 mM/L 塩化ナトリウム;4.7 mM/L 塩化カリウム;1.17 mM/L Mg24;1.18 mM/L NaH2PO4;24 mM/L NaHCO3;0 mM/L CaCl2;0.03 mM/L EDTA。
注: 動脈の最大の拡張を必要とする多くの研究、ベラパミル (1 μ M) などカルシウム エントリ ブロッカーおよび/またはニトロプルシド ナトリウム (10 μ M) などの一酸化窒素ドナーを PSS からの Ca2 +の削除に加えて、ソリューションに追加ができます。 - 継続的に, 分離大動脈リング、腸管の平滑筋や他の組織 (図 1) を研究するために使用標準的な器官風呂で容器室に流れる PSS で PO2PCO2PSS の pH を維持します。テトラフルオロ エチレン チューブの合成フッ素樹脂を使用して、チューブのこのタイプは、ガス管、例えばラテックスの多くの他の形態と対照をなして、不浸透性ためオルガンお風呂にガソリン タンクを接続します。
- 小さな空気石の場所は PSS ガス組成を維持するために容器チャンバーで平衡ガス混合物に接続されています。
注: PO2変化に対する血管応答は O2、例えば21% O2, 10% O25 %o2 の様々 な割合を含む混合ガス容器室内腔液で PSS を平衡させることでテストできます。と 0% O25% CO2とバランス N233,34,35。厚い壁、どこ血管壁の中心に酸素の拡散には、制限があります、大きい動脈の酸素、例えば95% O2の割合が高いを使用できます。 - 容器燃焼温度を密接に監視の伝熱特性の個々 の部屋が異なる場合があります。
メモ: ● キャニュレイテッド抵抗血管の研究のため多くの商業的に準備された容器室利用ガス平衡貯水池から酸素の PSS を提供し、風呂の温度の非常に正確な制御との酸素を提供する蠕動性ポンプPSS。 - ストッパーと加熱し、ガスある容器室 (図 1 a) に流れる PSS オルガンお風呂に PSS を継続的に提供するための貯水池として機能するセントラル硝子管の大きい (2 L) の上のボトルに PSS を配置します。
- オルガンのバスソルトの PSS 配信用静水圧ヘッドを維持するためにオルガンお風呂で PSS の上部と同じレベルで上のボトルにセントラル硝子管の開口部を配置します。使用ポリエチレン チューブは、J 型のガラスまたは器官風呂にマリオット瓶から PSS を提供するプラスチック製のチューブに接続。
- 内腔潅流 (図 1 a)、「ポリエチレン チューブを使用して 60 cc のプラスチック注入目的流入圧力 (通常 80 mmHg ラット脳の研究を維持する位置に高架から成る PSS 貯水池に流入ピペットを接続動脈)、圧力で測定したトランスデューサー、活栓を介してシステムに接続されています。
- 圧力勾配に対応容器を通過する PSS を許可するポリエチレン管に流出ピペットと貯水池流入貯水池のように流出の線を接続します。流出の圧力を測定するのにと同様の活栓と圧力トランスデューサー接続を使用します。
注: 経壁圧を設定し、船を介してフローを制御するための手順は、下記のセクション 2。 - 実験の終わりには、商工会議所、配信線、蒸留水タンク システム徹底的にすすいでください。頻繁な間隔でクリーン チューブと配信行を置き換えるまたはシステムで、活栓を置き換えるし、定期的に細菌や汚染を引き起こす他の微生物の増殖を防ぐために酸洗する任意のガラスの PSS の貯留層を対象と血管の反応性に影響を与えます。
2. ● キャニュレイテッド動脈準備
- 5% イソフルラン Sprague-dawley ラットの麻酔し、1.5-2.5% 医療用酸素36を使用して麻酔を維持します。また、ケタミン (75.0 mg/kg)、アセプロマジン (2.5 mg/kg)、およびキシラジン (10.0 mg/kg); を含む筋肉内注射を管理します。ペントバルビ タール (50-60 mg/kg); の腹腔内投与またはプロトコルおよび/または捜査官設定に応じて麻酔の他の承認された方法。
- 深麻酔下でラットの首をはねるし、脳の抵抗血管の研究脳を削除します。
- 脳を除去した後慎重に隔離中大脳動脈 (MCA) (または興味、例えば、脳底動脈や後大脳動脈の他の動脈)37,38。岩国を分離するには、脳を冷たい PSS (図 2) でいっぱいのガラス シャーレに仰臥位にして配置します。
- 脳から MCA を切除するのに Vannas はさみとデュモン #5 ファインチップ鉗子を使用します。 鉗子を使用して MCA から任意の残留脳組織をきれいにし、先ほど説明した PSS を含む温度制御容器チャンバーに動脈を転送します。33,34 .
- 容器室に動脈を転送するには、ACA または後部の通信動脈セグメントによる切除の容器を軽くつかみ、慎重に商工会議所に置きます。
注: MCA、に加えて、● キャニュレイテッド容器システムはさまざまな骨格筋抵抗動脈33,39,40, 腸間膜動脈をなど小型船舶の準備に最適です。38,41,42、および大きい (一次) クレマスター筋43、細動脈と同様にひと冠動脈細動脈と殿部生検44,45、中に皮下の脂肪組織から得られた人間の細 46,47。 - MCA の内腔に先に進むヒントまでピペット基部に向かって引っ張ることで動脈を流入マイクロ ピペットに接続します。10-0 縫合糸 (図 1 b) 動脈周囲から以前からかわ単一繊維繊維から調製したループを結ぶことによって流入ピペットの動脈を保護します。2 番目の縫合糸ループ (図 1 b) 容器の周りを引き締め、流出ピペットに MCA の反対側の端を固定します。
注: 容器をマウントする前にマイクロ ピペットに縫合糸のループを配置、添付ファイルの最終的なポイントの近くに配置のリスクを最小に動脈で簡単にスリップして船が位置するときに迅速に保護できるように、動脈は、ピペットをオフにスライドします。
注: マイクロ ピペット ホウケイ酸ガラス キャピラリー管 (2 mm 外径; 内径 1 mm、長さ 10 cm) から準備が垂直マイクロ ピペットの引き手を使用しています。動脈をアタッチする前に、マイクロ ピペットの先端の直径と灌流システムの流入と流出の抵抗のミスマッチを防ぐためにできるだけ密接に一致します。 - 動脈は安全に、マイクロ ピペットに縛ら後、その場で長さに動脈をストレッチするのに流入ピペット ホルダーに接続されているマイクロメータを使用します。
- 動脈に一定圧力を維持するために 10-0 縫合糸からからかわ単一繊維のすべての側枝を縛る。
- 内圧 (貫) は、一時的に流入ピペットを閉じた後は一定であることを確かめて、リークの有無を確認します。任意の枝を結ぶまたは圧力が落ちる場合は、容器の穴をチェックします。経壁圧が一定であることを確認した後血流を復元します。
注: 絶縁抵抗動脈カニュレーション手先の器用さと実践が必要です。観察される主な注意事項は、ピペットを破ることを避けるし、動脈が、ピペットをスライドされませんを確認してください。それは容器に外傷は、血管内皮細胞を損傷することが、全体の手順中に孤立した動脈に優しくすることが重要血管平滑筋の正常な機能を妨害および/または。 - 解剖顕微鏡に接続されているし、ビデオのマイクロメータとテレビ モニター (図 1 b、1 C) に接続しているビデオカメラから成るビデオ顕微鏡セットアップ (図 1 a) を使用して動脈の内径を測定します。これにより、動脈の内側の壁に可動式の参照線を配置することによって手動で容器の直径を測定する観測者同様に、動脈の外側壁、血管壁の厚さを測定するために必要であれば。
注: いくつかのビデオのマイクロメータは、容器寸法の自動追跡を提供しています。
注: 顕微鏡ステージ マイクロメータと流入ビデオ マイクロメータの校正し、の正確な測定を保証するために実験の間の水銀マノメータ (0 mmHg、50 mmHg、100 mmHg、150 mmHg、200 mmHg) と圧力トランスデューサーを流出容器の直径、管腔内の圧力。
注: ラット MCA 実験のため標準的な制御の経壁圧は 80 mmHg です。上位と下位の圧力レベルの校正は最大限に拡張した動脈圧と受動圧径曲線筋貫壁性の変化に対する研究の精度を保証します。 - 一定のレベルで目的の経壁圧を維持する流入と流出の貯水池の高さを調整します。少量 (< 5 mmHg) によって流入貯水池を上げ、同じ量によって流出油層を下げる平均経壁圧を維持し、血管内腔6で血流を作成します。
注: 流入貯水池を上げ、等しい量によって流出油層を下げる、動脈内の圧力を distending 同じ平均貫を維持しますが、流れとせん断応力は、船は、静水圧勾配を生成することができます、さまざまな実験グループ48腔内せん断応力の変化に内皮依存性応答を評価する調査。 - 筋原性反応と血管拡張刺激に対する血管反応を評価するために動脈が実験前にアクティブ トーン (約 40%) の適切なレベルを示すことを確認します。容器、例えば、アクティブな休息トーンを通常示さない小の腸間膜動脈を除いて安静時アクティブ トーンを欠けている任意の動脈を破棄します。
注: 通常自発的なトーンを示さない、船のノルエピネフリンやフェニレフリンなどの血管収縮薬アゴニストを利用した相当額によって動脈を事前収縮します。事前動脈を収縮させるためアゴニストの投与量を選択するよい方法は、血管収縮剤、例えば、ノルエピネフリン41,42EC50線量を利用することです。しかし、薬理学的血管収縮剤は、安静時の条件自然アクティブ トーンを示す動脈に適用されませんする必要があります。 - ACh 濃度の増加添加時血管径を測定することにより ● キャニュレイテッド抵抗動脈の内皮依存性反応性をテスト (10-10 M-10-5 M) 容器室へ。添加濃度 (10-10 M-10-5 M) に一酸化窒素ドナーのニトロプルシド ナトリウムの増加時血管径を測定することにより一酸化窒素内皮非依存性血管平滑筋の感度をテスト、容器室。
注: 血管収縮剤やその他の血管拡張薬への感受性は、容器チャンバーにアゴニストの濃度を上げるを追加して同様の方法でテストすることができます。
注: 血管作動物質に加えて様々 な薬、阻害剤、およびその他の薬理学的エージェント追加できます内腔液および/または組織のお風呂に。PO2 (PCO2と pH と同様) の変更選択、管理できます内皮側または動脈の余分の内腔側に内腔液の分離の平衡によって校正ガスの混合物に接続されている空気石組織バス33,34,49で PSS を平衡に使用される混合物とは異なる。経壁圧の変化に筋の応答は流出ピペットを閉じるを上げることにより学ぶことができます (または下げる) PSS 貯水池の高さに流入のピペット49,50,51に接続腔内の圧力を軽減します。 - 特定の刺激に血管応答を仲介することで、内皮の役割をテストするため血管内皮を削除および血管内皮細胞の存在の有無でそれら刺激に対する血管反応を比較します。血管内皮細胞を削除するには、慎重に流出ピペットから動脈をほどくし、ゆっくり空気塊と動脈の内腔を灌流 (0.5 〜 1.0 mL)。空気潅流後再流出ピペット43船を結ぶ前に細胞の残骸を消去する PSS 灌流を復元します。
注: 内皮細胞の侵食手順だ血管内皮細胞が内皮依存血管拡張反応その容器の種類を生成する知られている血管作動薬 (通常 ACh) レスポンスをテストすることによって削除されていることを確認することが重要。ただし、特定の病理学の条件の場合は、内皮除去に続いて収縮反応を除去することを確認することが重要だ内皮依存性血管収縮薬は解放されます。 - 実験の最後に、Ca2 +を追加することによって、動脈の最大径を決定-出納および superfusate は PSS を無料します。アクティブな休息トーン (%) ((Dmax-D残り)/Dmax) として、Dmaxが Ca2 +の存在下で最大直径 100 x を計算する-無料のソリューション、D残りは休憩コントロール直径。
注: 異なる実験グループに最大限にリラックスした動脈の直径測定、アクティブな休息トーン、構造改造 (すなわち壁の厚さと内腔の直径の変化)、受動的な機械的性質の比較で貴重です(経壁圧の異なるレベルでパッシブの直径から計算応力-ひずみ関係)。
3. LDF と脳血流量の応答の評価
- 5% イソフルランと動物の麻酔、脳定位固定装置9,10でラットを固定します。
- 呼吸頻度、最後の潮 CO2、およびつま先ピンチ36と麻酔の深さを監視しながら一定の麻酔下の動物を維持します。
- 光結合10を提供するために歯科用ドリルを低速と鉱物油を使用して半透明に頭蓋骨を慎重に薄い。過度の熱が生成されないようにし、骨を貫通しないように注意します。
注: 移動粒子 (すなわち、赤い血液細胞) の数で決まる、ドップラー シフトを測定するために、プローブに戻って反映される基になる組織に到達するレーザー光により、頭蓋骨が薄くなるとその速度。 - マイクロマニピュレーターの LDF プローブを確保し、頭蓋骨の間伐面積の上に直接位置します。実験では、LDF の組織の 1 つの制限された領域内の流れを測定するように設計し、は動きの人工物に非常に敏感、LDF プローブまたは自体、準備の動きを防ぐために非常に重要です。
注: 初期位置からプローブの動きは比較は除外して、組織の別の領域で血流の推定値を提供します。LDF は絶対フロー値を提供しません、科目間の比較には適していません、それは個々 の科目で実験的介入への応答の組織灌流の変化を非侵襲的評価する優れた方法コントロールの値から LDF 信号の相対的な変化の平均および他の実験グループのコントロールから LDF 信号の変化に比較が可能します。
注: LDF は異なる実験的グループ8,9,10の全血管床のレベルで血流を規定する要因に洞察力を得るために便利な方法です。LDF と組織灌流の評価は、全体のベッドの観点に分離容器研究から得られた知識を吸収するための実用的なアプローチを提供します。抵抗動脈微小循環の血管制御機構の地域差を除いて LDF と得られる測定提供により得られた結果と概ね一致して組織血流コントロールの良い兆候● キャニュレイテッド動脈準備。
4. GS1 レクチンと骨格筋の微小血管密度の評価
- 挙睾筋を雄ラットから標準微細手術用ハサミで陰嚢を切開し、筋肉を把握するデュモン #5 鉗子を使用して削除します。
注: 薄い筋肉 (例えば挙睾筋と同様、伸筋総指筋と前脛骨筋前脛骨筋雄および雌ラットに見られる) に適している使用全体マウント レクチン研究として組織がセクションは、厚い組織に使用できます。 - シングル カットを使用して睾丸から挙睾筋を削除します。冷たい PSS に配置し、底部の内側表面にシリコーンのエラストマー裏地付きシャーレにピンでアウト。優しく・ デュモン #5 鉗子を使用して距離の結合組織をいじめます。
- 2 ml のバッファーに格納された PSS の筋サンプルをすすぐと、ローダミン標識 GS1 レクチン 12 ウェルの細胞培養プレート 2 mL で 50 分間 (20 μ g/mL PSS) に浸って/よく光を除外するアルミ箔に包まれています。
- レクチン溶液から組織を削除、ロッカーの上 5 分の「洗う」孵化と PSS で 3 回すすぎ、顕微鏡のスライドにそれらをマウントします。暗闇の中で組織をインキュベートし、蛍光性の損失を防ぐために暗闇の中でスライドを保存ことを確認します。
注: スライドをすぐに使用できない場合、保つことができる蛍光性の損失なしで冷蔵庫に。長期貯蔵スライドは劣化11を防ぐために冷凍庫で保存できます。 - 52の画像上にスーパーイン ポーズ コンピューター生成グリッド線またはスライドを表示する使用されているモニターに重なって表示されるグリッドのクリア オーバーレイとラベル付きの微小血管の交差点の数をカウントすることによって微小血管密度を評価します。
注: GS1 レクチンのアプローチは実証に使用されている: 塩誘起微小血管膨張53塩を防止する保護効果による塩供給動物17 における微小血管密度の復元におけるアンジオテンシン II 抑制、53,54;塩で飼育されたラット17で微小血管膨張を防ぐために低用量アンジオテンシン II 注入の保護効果を仲介する NRF2 の役割またアンジオテンシンの役割を評価する塩の慢性的な筋肉刺激による血管新生反応を維持するために II 飼育ラット54,55.GS1 レクチン技術の利点の 1 つは、同じ動物 ● キャニュレイテッド抵抗動脈または LDF の研究のための微小血管密度を評価するために使えます。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
● キャニュレイテッド抵抗血管の培養顕微鏡は、小さな抵抗動脈 (および大きい細動脈) のアクティブなトーンに影響を及ぼす要因の検討経壁圧正常生体内で実質細胞の不在影響します。種々 の血管拡張薬と血管収縮薬の刺激に血管と通常 PSS、Ca2 +の経壁圧上昇に対する筋の反応性を評価するとともに-無料 PSS を出納し、superfusate の終わりに追加できます最大容器の径や壁の厚さを決定する実験。後者の測定が血管の改造は、すなわち血圧や薬理学的エージェントの管理の変更への応答で発生する壁/ルーメン比の変化を評価する上で非常に貴重です。Ca2 +で最大限に拡張した血管径の計測-無料 PSS が 100、x ((D最大の -D の残り)/Dmax) として本質的なトーンを計算する便利な Dmaxと D残りが最大 (Ca2 +-PSS を無料) 制御の平衡圧力 (MCA の通常 80 mmHg) で、それぞれ直径 (PSS) を休んでと。我々 の経験で MCA のアクティブ トーン平均約 80 mmHg の経壁圧で 40% であります。直径を測定することによって、血管の受動的な機械的特性を評価する実用的な方法をも最大限に血管の直径を測定する動脈の経壁圧を distending とする結果を使用してさまざまなレベルでの応力-ひずみ関係と船7,56他の機械的特性を計算します。
図 3は、3 絞り込んだコンジェニック系統追加の選択的な育成のアプローチを活用した SS.13BNラット由来の概略図です。これらのラットの系統の染色体セグメントを含めるブラウン ノルウェー レニン遺伝子 (Ren1 BN) または (Ren1 SSA) 上だけまたはすぐ下 (Ren1 SSB) レニン遺伝子座をオフにカット (したがって維持している SS レニン遺伝子)。29の研究で、ブラウン ノルウェー レニン遺伝子を含む染色体セグメントにのみ 25 の遺伝子が含まれています。
図 4は、ACh の内皮依存性血管拡張反応を示しています (1 μ M) からダール SS ラットおよび 3 つの分離の岩国で狭くコンジェニック系統図 3に示します。これらの 3 つのコンジェニック系統かどう (Ren1 BN) または (Ren1 SSA) のすぐ上に切り取られているか (Ren1 SSB) レニン遺伝子の下約 25 の遺伝子に関心 (すなわち、レニン遺伝子座周辺) の地域を限定を併用します。それらの実験で動物が正常血圧と低い塩を供給 (0.4 %nacl) ダイエット。研究29内皮依存性拡張 ACh とは欠席 SS 親株と保持 SS レニン遺伝子コンジェニック系統が復活した SS の遺伝的背景に BN レニン遺伝子を運ぶコンジェニック系統の。その研究の結果 SS.13BNコンソミック ラット57,58を利用した先行研究の調査結果をサポートし、強力な証拠を提供し、内皮機能不全が正常血圧にいるときでも SS ラットの存在と低塩分の食事を供給します。慢性曝露の結果、レニン遺伝子の障害規制のため一緒に、それら研究29,,5758の結果は SS ラットにおける内皮機能障害という仮説を支持は血液中のアンジオテンシン II のレベル。
別研究59は、図 5、要約比較ダール SS ラットおよび染色体 5 (含むブラウン ノルウェー遺伝子を運ぶ SS.5BNコンソミック ラットからの ACh 分離岩国 (MCA) の内皮依存性血管拡張に対してシトクロム P450-4 a ω-ヒドロキシラーゼのさまざまなフォーム)。その研究では、動物の供給されたいずれか低い塩 (0.4 %nacl) または高い塩 (4 %nacl) ダイエット。SS ラットから MCA と対照をなして ACh に内皮依存拡張は SS.5BNコンソミック ラット低塩分の食事から MCA に維持されました。さらに、(と対照をなす SS.13BNコンソミック ラット57,58、Sprague-dawley ラット33,39,40、60、およびハムスターの結果61)、塩分の高い食事は CYP450 4 a の ω-水酸化酵素を示す SS.5BNラットの ACh による拡張を排除するために失敗しました、20 hydroxyeicosatetraenoic 酸 (20-HETE) は、血管の酸化ストレスや血管内皮の重要な貢献者SS ラットや他の系統の塩摂取の高度の機能障害。実験的観点から ACh に内皮依存性拡張を排除するために塩分の高い食事の障害 ● キャニュレイテッド抵抗血管の研究が社会通念から逸脱する予期しない結果を作り出すことができる方法の例を提供し、これらの重要な血管の機能に影響を与える複雑な制御機構の新たな理解に 。
図 6は、ACh に孤立した MCA の応答を示しています (1 μ M) 野生型とNrf2(-/-)でノックアウト ラット低塩分の食事 (0.4 %nacl)、高ダイエット塩 (4% 塩化ナトリウム)、または知られている NRF2 活性化30,62 を含む塩分の高い食事.塩による酸化ストレスのない場合は、ACh による拡張は、野生型とNrf2(-/-)ノックアウトのラットから MCA に似ていた。Sprague-dawley ラットの先行研究の結果と一致して、塩分の高い食事は、ACh による拡張野生型とNrf2(-/-)ノックアウトラットを排除しました。塩分の高い食事に NRF2 誘導剤の添加は、ノックアウト ラットにおけるNrf2遺伝子の成功の除去を示すNrf2(-/-)のラットではなく野生型ラットで ACh に内皮依存性拡張を復元血管の酸化ストレスを改善するための治療的なアプローチとして NRF2 をレギュレータの使用をサポートします。
図 7は、LDF の軟膜の微小循環のプログレッシブ削減血圧連続血液ボリューム引き出し Sprague-dawley ラットのいずれかによって生成されたレスポンスを比較測定の結果をまとめたもの通常の塩 (0.4 %nacl) 食事療法または高い塩 (4 %nacl) 4 週間ダイエット。ラット低塩分の食事と対照をなしてラットが塩分の高い食事展示灌流圧、脳血流の自己調節機構があることを示す削減の中に一定の血流を維持する能力が低下塩分の高い食事への長期露出によって損なわれます。それらの実験の結果は塩ラット60の摘出脳動脈の障害血管弛緩機構の存在と一貫性のある、LDF 測定を活用してサポートし、拡張する方法の良い例を提供します全く血管床のレベルに分離抵抗血管を用いる研究の調査結果。
抵抗動脈機能の評価だけでなく摘出動脈とレーザー ・ ドップラー血流計、微小血管密度と慢性的な筋肉刺激54,などの様々 な刺激に対する血管新生反応を使用してください。 組織灌流を使用してください。55は、蛍光標識した GS1 レクチンは、細動脈や毛細血管の基底膜の糖鎖に選択的に結合を利用した同じ動物で評価できます。典型的なレクチン (注高塩ラットの血管の密度が低い) の 2 週間、低塩食や塩分の高い食事を与え Sprague-dawley ラットの挙睾筋の染色を図 8に示します。微小血管密度コンピューター生成参照グリッド52、微小血管のレクチン標識の交差点を数えることで評価し、血管新生応答54,55を評価する優れた方法を提供するまたは検出して高血圧など高塩分摂取12,17,53の状態の微小血管についての損失を定量化します。

図 1:体外ビデオ顕微鏡のセットアップが分離、● キャニュレイテッド抵抗動脈 (A) を検討します。● キャニュレイテッド抵抗動脈はガラス マイクロ ピペット (B) とビデオ マイクロ メーター表示の内腔の直径の測定 ● キャニュレイテッド抵抗動脈 (C) に関連付けられます。● キャニュレイテッド動脈 (μ m) の内部の直径を表し、125 μ m パネル C は実験を行うオブザーバーで動脈の内側の壁に手動で置かれた可動参照線の間の距離のビデオ ディスプレイ パネル B のスケール バー.この図の拡大版を表示するのにはここをクリックしてください。

図 2:脳から中大脳動脈を分離して、マイクロ ピペットを穿刺の準備手順の概略図。この図の拡大版を表示するのにはここをクリックしてください。

図 3:ダール塩敏感な遺伝的背景にブラウン ノルウェー染色体 13 交雑の小さなセグメントを持つ狭くコンジェニック ラット系統の模式図。染色体セグメントがブラウン ノルウェー レニン遺伝子 (Ren1 BN) が含まれているか (Ren1 SSA) のすぐ上が表示されない (Ren1 SSB) レニン遺伝子の位置の真下や SS レニン遺伝子を保持します。この数字を変更してデュランらから転載29アメリカ生理学会の許可を得ています。この図の拡大版を表示するのにはここをクリックしてください。

図 4:分離の応答 cannulated SS 岩国ラット ・ 1 μ M アセチルコリン コンジェニック ラット系統 (図 2に示されている)。データはアセチルコリン前のコントロールの径を休んでから平均径変更 (Δ μ m) ±SEM として表現し、デュランらによって元の研究から replotted29この図の拡大版を表示するのにはここをクリックしてください。

図 5:動物のアセチルコリンを 1 μ M の分離、● キャニュレイテッド SS 岩国ラットと SS.5BNコンソミック ラット応答供給低い塩 (0.4 %nacl) または高い塩 (4 %nacl) ダイエット。データはアセチルコリン前のコントロールの径を休んでから平均径変更 (Δ μ m) ±SEM として表現し、Lukaszewiczらによって元の研究から replotted64この図の拡大版を表示するのにはここをクリックしてください。

図 6:Nrf2(-/-)ノックアウトのラットおよび野生型コントロールの分離、● キャニュレイテッド岩国で 1 μ M アセチルコリン供給低塩分の食事 (0.4% 塩化ナトリウム)、高ダイエット塩 (4% 塩化ナトリウム)、または知られている NRF2 活性化30,を含む高塩分の食事62. データはアセチルコリン前コントロールの径を休んでから平均径変更 (Δ μ m) ±SEM で表されます。この図の拡大版を表示するのにはここをクリックしてください。

図 7:脳血流は、LDF 軟膜微小循環の評価。ラット 4 週間のために塩分の高い食事を維持は、動脈血圧は連続血液ボリューム引き出しへの応答で減少した血流定数を維持するために彼らの能力で重要な減損を展示しました。データ コントロールの ±SEM の平均 % としてプロットされます * p < 同じ減塩食事療法対 0.05 平均動脈圧。この図の拡大版を表示するのにはここをクリックしてください。
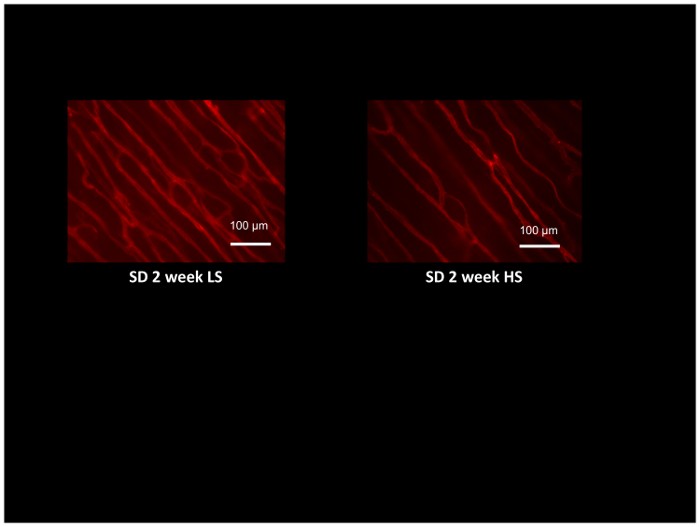
図 8:細動脈と毛細血管の微小血管密度の評価を識別する GS1 レクチンのローダミン標識の付いたラット挙筋の顕微鏡写真。挙筋は Sprague-dawley ラット低塩から得られた (LS; 0.4 %nacl) または高 (HS:4% 食塩水) ダイエットを 2 週間、塩し、LS コントロールに比べて HS 供給動物の微小血管の膨張を示します。スケールバー = 100 μ m.この図の拡大版を表示するのにはここをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
述べる導入で説明した、ようテレビ顕微鏡を使用し、分離抵抗動脈だけでなく、標準ラットモデル (とビデオで採用)、血管機能評価へのアプローチがまたで専門性の高い遺伝子設計されたラット系統は、小説を示し、これらのアプローチを活用した得ることができる強力な洞察力。アクティブ トーンを評価するこれらの強力な技術の使用と受動的な機械的性質抵抗小動脈内皮依存性規制を含む血管制御メカニズムの広いスペクトルに関する重要な情報を提供できます。抵抗血管でアクティブなトーンの正常と病態生理学的条件、受動性動脈の血管平滑筋機能は血管リモデリングに関連し、血管壁の力学の変化します。内皮機能不全は心血管関連死63, を含む人間の複数の不利な心血管イベントの強力な予後指標が示されているし、● キャニュレイテッド抵抗動脈準備がで特に貴重なもの内皮機能不全により、内皮機能障害のメカニズムの私達の理解を高めることです。
分離抵抗血管を用いたビデオ顕微鏡技術の in vitroの有効性を示すためには、我々 は例を新規コンソミック、ダール食塩感受性 (SS) ラットにおけるこれらの技術の使用の減少を示すラット系統を提供SS 親株24と比較された血圧の食塩感受性は。これらの研究は、血圧と SS ラットにおける血管病変の塩の感受性に貢献する特定の興味のある 2 つの染色体上の遺伝子に関連する血管制御機構を検討した.それらの染色体は染色体 13、レニン遺伝子18,22,29,57,58年を運ぶと染色体 5、CYP450 4 a ω 水酸化64 のアイソ フォームのための遺伝子を運ぶ ,65-20 HETE、腎機能と血管反応性66,67,68に主要な影響を持っているを生合成する酵素。ラットの遺伝ツールボックスに最近、強力な他は高度な遺伝子を含む編集のテクニックを利用したラット遺伝子ノックアウト モデルの開発: ZFNs;転写活性化ようなエフェクター核酸分解酵素 (TALENS)、最も最近 CRISPR Cas913,14,15,16,17。欠けている重要な抗酸化物質と細胞保護転写因子 NRF2 は、 Nrf2(-/-)のノックアウト ラットのモデルから分離された岩国の研究にこれらの技術を利用したビデオ顕微鏡体外を重要な提供していると以前、高架の不在で塩による内皮機能障害のメカニズムに不明な洞察力は圧力17 を血します。これらの専門にされたラットモデルを用いた実験の結果は、以前レポート17,29,57,58,59,の数で説明します。60,64,65.
それは明らかに分離、● キャニュレイテッド抵抗血管の研究が様々 な条件の下でこれらの非常に重要な血管の機能を制御する機構を理解する上で非常に貴重なそれは非常に運動することが重要、正確で信頼性の高い結果が得られることを確保するための注意事項の数。脳動脈および他の多くの血管層の抵抗血管トーヌスの展示物、レスポンスを評価するためにノルエピネフリンなどの血管収縮薬を事前に契約する必要がありますいくつかの動脈 (特に腸間膜動脈)血管拡張剤の刺激、およびより正確にシミュレート体内条件、血管が神経・体液性血管収縮の刺激、アドレナリン作動性神経終末からノルエピネフリンなどの影響を受けています。など、勉強する動脈の基本的な特性を理解することが重要だ、文献またはから慎重に予備実験を実施します。血管内皮細胞は、太い動脈、小動脈および細動脈微小循環の調節に重要な役割を果たしている、ために、分離と動脈穿刺時に血管内皮細胞の損傷を避けるために注意を行使する重要です。内皮整合性の古典的なテストは、アセチルコリンが血管拡張を引き起こすことデモンストレーションです。1 つの警告は、酸化ストレスの条件の下で血管内皮細胞が、そのままありますが ACh に血管が存在しないので、活性酸素の過剰を清掃、一酸化窒素血管拡張反応を防止します。これらのケースでは、tempol は、ACh および他の内皮依存性血管拡張の刺激への応答で血管拡張を復元する必要がありますなど活性酸素スカベン ジャーの存在下で ACh アプリケーションを繰り返すことによって血管内皮の整合性を検証できます。また、病理学の条件の数は、血管内皮細胞は血管平滑筋細胞の収縮と、動脈の狭窄を引き起こす物質を解放できます。いくつかのケースで内皮依存性拡張 (または収縮)シクロオキシゲナーゼ代謝産物、H2O2、酵素代謝物など他の物質を介して媒介されます。内皮依存性血管拡張や血管収縮物質の古典的なテストは、拡張または動脈の収縮は内皮除去によって除去されることを示すことです。最後に、内皮依存性血管拡張と血管収縮物質のアイデンティティを一般的に調べれば特異的阻害剤又は一酸化窒素合成酵素、抑制するインドメタシンを抑制する L 名などのスカベン ジャーの管理シクロオキシゲナーゼ代謝産物の形成、カタラーゼ H2O2、トロンボキサン合成酵素阻害剤、酵素阻害剤、または CYP450 4 a/20 HETE 経路の拮抗薬を清掃します。
それはまた重要な (そして有益な) を定量化するアクティブ量トーン実験の終わりに灌と superfusing と Ca2 +動脈-無料の PSS、またはパパベリンなど強力な血管拡張剤の最大線量を管理します。アクティブの典型的なレベル MCA でトーンを休んで、((Dmax-D残り)/Dmax) として計算される x 100 はの約 40%、最大D と D の残りの部分が最大 (Ca2 +-無料の PSS) とは別の直径 (PSS)それぞれのコントロール平衡圧 (MCA の通常 80 mmHg)。大幅により少なくアクティブ トーンまたは分節狭窄や狭窄を示す動脈の血管は、それらの標識に血管の外傷の説法は、解析から除外されます。Ca2 +で最大限に拡張した動脈の直径の測定-測定動脈径と計算応力-ひずみ関係による血管の受動的な機械的性質を評価する調査官ができます無料のソリューション中に最大限に拡張した血管7,56経壁圧の逐次高度。これらの受動的な応力-ひずみ関係が簡単に得られるし、血管の力学的特性の変化の貴重な指標を提供します。
ピペット、コネクタ、および貯水池を供給管の清浄度が実験の成功に不可欠です。この点では、それは実験を完了すると、リンス、ティッシュをきれいにする風呂、配信管、すべて貯水池を格納するために使用されるウォームし、船に到達する前に PSS のガス平衡後のチューブからすべてのソリューションを洗い流すことが重要商工会議所。活栓と配信システムのバルブもクリーンアップおよび PSS を運ぶチューブを必要として定期的に変更します。汚染されたチューブの古典的な兆候はカビや細菌によって生成される灰色の霧それらの変更は、通常細菌汚染によって生成される物質による血管反応性の損失を伴います。ただし、細菌や他の微生物による汚染はまだ任意の目に見える証拠の不在中に存在できます。
本稿では、血管の異なったベッドのすべての重要な抵抗の小動脈の研究に非常に適しています昔ながらの技術の使用の参考例と考えています。● キャニュレイテッド抵抗血管のビデオ顕微鏡体外が非常に貴重な洞察を提供する LDF と GS1 レクチンで微小血管密度の評価法などの組織の血流を評価するための標準的な手法と組み合わせれば、組織灌流とどのようにこれらは、病気の状態で変更することが制御する要因。血管平滑筋と標準ラットモデルでの血管内皮機能の基本的なメカニズムを研究するための強力な手段を提供することに加えて他の動物モデルにして個々 の抵抗血管を勉強するビデオ顕微鏡の使用は適用できます。人間の抵抗動脈。新規の遺伝子組み換えラットのモデルの分離の抵抗血管のビデオ顕微鏡の応用は、遺伝子の多数 (および今までに成長しているリスト) の変更された関数への応答で発生する表現型の変化を理解するための新しい扉を開きます。
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
著者は競合する金融興味を持ってないです。
Acknowledgments
著者は表現、心からケイティ Fink とリン Dondlinger のおかげで、この原稿の準備のために貴重な援助。
助成: NIH #R21-OD018309;#R56-HL065289;#R01 HL128242。
Materials
| Name | Company | Catalog Number | Comments |
| SS Rat | Medical College of Wisconsin | SS/JHsd/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| SS.5BN Consomic Rat | Medical College of Wisconsin | SS-Chr 5BN/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| SS.13BN Consomic Rat | Medical College of Wisconsin | SS-Chr 13BN/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Ren1-BN Congenic Rat | Medical College of Wisconsin | SS.BN-(D13hmgc41-D13)hmgc23/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Ren1-SSA Congenic Rat | Medical College of Wisconsin | SS.BN-(D13rat77-D13rat105/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Ren1-SSB Congenic Rat | Medical College of Wisconsin | SS.BN-(D13rat124-D13rat101/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Nrf2(-/-) Knockout Rat and Wild Type Littermates | Medical College of Wisconsin | SD-Nfe212em1Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Low Salt Rat Chow (0.4% NaCl)-AIN-76A | Dyets, Inc. | 113755 | |
| High Salt Rat Chow (4% NaCl)-AIN-76A | Dyets, Inc. | 113756 | |
| Colorado Video Caliper | Colorado Video, Inc. | Model 308 | |
| Video Camera | Hitachi | KPM1AN | |
| Microscope | Olympus Life Science | CKX41 | |
| Television Monitor | Panasonic | WVBM1410 | |
| Pressure Transducers | Stoelting | 56360 | |
| Blood Pressure Display Unit | Stoelting | 50115 | |
| Cannulated Artery Chamber | Living Systems Instrumentation | CH-1 | Single vessel chamber for general use |
| Temperature Controller for Single Chamber | Living Systems Instrumentation | TC-09S | |
| Gas Dispersion Tube, Miniature,Straight | Living Systems Instrumentation | GD-MS | Provides aeration in the vessel bath |
| Gas Exchange Oxygenator, Miniature | Living Systems Instrumentation | OX | Allows gas exchange with perfusate |
| Laser-Doppler Flowmeter | Perimed | PeriFlux 5000 LDPM | |
| GS1 Lectin | Vector Labs | RL-1102 | |
| Glass Capillary Tubes for Micropipettes | Fredrich Haer Co. | 27-33-1 | 2 mm ODX1 mm ID |
| Verticle Pipette Puller | David Kopf Instruments | Model 700C | |
| Nylon suture material (10/0)-3 PLY | Ashaway Line and Twine Manufacturing Co. | 114-ANM-10 | Single strands of 3 ply nylon suture teased out for use on vessels |
| Dumont #5 Forceps-Inox | Fine Science Tools | 11254-20 | |
| Vannas Scissors | Fine Science Tools | 15003-08 | |
| Protandim | Protandim | NRF2 Inducer: Contact Dr. Joe McCord (JOE.MCCORD@UCDENVER.EDU) | |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | |
| Sodium Bicarbonate | Fisher Chemical | S233-3 | |
| Dextrose (d-glucose) anhydrous | Fisher Chemical | D16-500 | |
| Magnesium Sulfate (MgSO4-7H2O) | Sigma Aldrich | M1880-500 G | |
| Calcium Chloride (CaCl2-2 H2O) | Sigma | C5080-500G | |
| Sodium Phosphate-Monobasic (NaH2PO4) | Sigma | S0751-500G | |
| Potassium Chloride (KCl) | Fisher Chemical | P217-500G | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | Sigma | ED255-500G |
References
- Furchgott, R. F., Zawadzki, J. V. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine. Nature. 288, 373-376 (1980).
- Bevan, J. A., Osher, J. V. A direct method for recording tension changes in the wall of small blood vessels in vitro. Agents Actions. 2, 257-260 (1972).
- Mulvany, M. J., Halpern, W. Contractile properties of small arterial resistance vessels in spontaneously hypertensive and normotensive rats. Circ. Res. 41, 19-26 (1977).
- Speden, R. N. The use of excised, pressurized blood vessels to study the physiology of vascular smooth muscle. Experientia. 41, 1026-1028 (1985).
- Osol, G., Halpern, W. Myogenic properties of cerebral blood vessels from normotensive and hypertensive rats. Am. J. Physiol. 249, H914-H921 (1985).
- Halpern, W., Kelley, M. In vitro methodology for resistance arteries. Blood Vessels. 28, 245-251 (1991).
- Feihl, F., Liaudet, L., Waeber, B. The macrocirculation and microcirculation of hypertension. Curr Hypertens Rep. 11, 182-189 (2009).
- Smits, G. J., Roman, R. J., Lombard, J. H. Evaluation of laser-Doppler flowmetry as a measure of tissue blood flow. J Appl Physiol. 61, 666-672 (1985).
- Hudetz, A. G., Roman, R. J., Harder, D. R. Spontaneous flow oscillations in the cerebral cortex during acute changes in mean arterial pressure. J Cereb Blood Flow Metab. 12, 491-499 (1992).
- Hudetz, A. G., Smith, J. J., Lee, J. G., Bosnjak, Z. J., Kampine, J. P. Modification of cerebral laser-Doppler flow oscillations by halothane, PCO2, and nitric oxide synthase blockade. Am J Physiol. 269, H114-H120 (1995).
- Hansen-Smith, F. M., Watson, L., Lu, D. Y., Goldstein, I. Griffonia simplicifolia I: fluorescent tracer for microcirculatory vessels in nonperfused thin muscles and sectioned muscle. Microvasc Res. 36, 199-215 (1988).
- Greene, A. S., Lombard, J. H., Cowley, A. W., Hansen-Smith, F. M. Microvessel changes in hypertension measured by Griffonia simplicifolia I lectin. Hypertension. 15, 779-783 (1990).
- Aitman, T., Dhillon, P., Geurts, A. M. A RATional choice for translational research? Dis Model Mech. 9, 1069-1072 (2016).
- Geurts, A. M., et al. Knockout rats via embryo microinjection of zinc-finger nucleases. Science. 325, 433 (2009).
- Geurts, A. M., et al. Generation of gene-specific mutated rats using zinc-finger nucleases. Methods Mol Biol. 597, 211-225 (2010).
- Geurts, A. M., Moreno, C. Zinc-finger nucleases: new strategies to target the rat genome. Clin Sci (Lond). 119, 303-311 (2010).
- Priestley, J. R., Kautenburg, K. E., Casati, M. C., Endres, B. T., Geurts, A. M., Lombard, J. H. The NRF2 knockout rat: a new animal model to study endothelial dysfunction, oxidant stress, and microvascular rarefaction. Am J Physiol Heart Circ Physiol. 310, H478-H487 (2016).
- Cowley, A. W., et al. Brown Norway chromosome 13 confers protection from high salt to consomic Dahl S rat. Hypertension. 37, 456-461 (2001).
- Rapp, J. P. Dahl salt-susceptible and salt-resistant rats. A review. Hypertension. 4, 753-763 (1982).
- Rapp, J. P., Wang, S. M., Dene, H. A genetic polymorphism in the renin gene of Dahl rats cosegregates with blood pressure. Science. 243, 542-544 (1989).
- Manning, R. D. Jr, Meng, S., Tian, N. Renal and vascular oxidative stress and salt-sensitivity of arterial pressure. Acta Physiol Scand. 179, 243-250 (2003).
- Moreno, C., et al. Multiple blood pressure loci on rat chromosome 13 attenuate development of hypertension in the Dahl S hypertensive rat. Physiol Genomics. 31, 228-235 (2007).
- Tobian, L., Lange, J., Iwai, J., Hiller, K., Johnson, M. A., Goossens, P. Prevention with thiazide of NaCl-induced hypertension in Dahl "S" rats. Evidence for a Na-retaining humoral agent in "S" rats. Hypertension. 1, 316-323 (1979).
- Mattson, D. L., et al. Chromosome substitution reveals the genetic basis of Dahl salt-sensitive hypertension and renal disease. Am J Physiol Renal Physiol. 295, F837-F842 (2008).
- Kunert, M. P., et al. Consomic strategies to localize genomic regions related to vascular reactivity in the Dahl salt-sensitive rat. Physiol Genomics. 26, 218-225 (2006).
- Cowley, A. W., Liang, M., Roman, R. J., Greene, A. S., Jacob, H. J. Consomic rat model systems for physiological genomics. Acta Physiol Scand. 181, 585-592 (2004).
- Kunert, M. P., Dwinell, M. R., Lombard, J. H. Vascular responses in aortic rings of a consomic rat panel derived from the Fawn Hooded Hypertensive strain. Physiol Genomics. 42A, 244-258 (2010).
- Liang, M., et al. Renal medullary genes in salt-sensitive hypertension: a chromosomal substitution and cDNA microarray study. Physiol Genomics. 8, 139-149 (2002).
- Durand, M. J., Moreno, C., Greene, A. S., Lombard, J. H. Impaired relaxation of cerebral arteries in the absence of elevated salt intake in normotensive congenic rats carrying the Dahl salt-sensitive renin gene. Am J Physiol Heart Circ Physiol. 299, H1865-H1874 (2010).
- Hybertson, B. M., Gao, B., Bose, S. K., McCord, J. M. Oxidative stress in health and disease: the therapeutic potential of Nrf2 activation. Mol Aspects Med. 32, 234-246 (2011).
- Itoh, K., et al. An Nrf2/small Maf heterodimer mediates the induction of phase II detoxifying enzyme genes through antioxidant response elements. Biochem Biophys Res Commun. 236, 313-322 (1997).
- Myung, S. K., et al. Efficacy of vitamin and antioxidant supplements in prevention of cardiovascular disease: systematic review and meta-analysis of randomised controlled trials. BMJ. 346, f10 (2013).
- Fredricks, K. T., Liu, Y., Lombard, J. H. Response of extraparenchymal resistance arteries of rat skeletal muscle to reduced PO2. Am J Physiol. 267, H706-H715 (1994).
- Fredricks, K. T., Liu, Y., Rusch, N. J., Lombard, J. H. Role of endothelium and arterial K+ channels in mediating hypoxic dilation of middle cerebral arteries. Am J Physiol. 267, H580-H586 (1994).
- Frisbee, J. C., Maier, K. G., Falck, J. R., Roman, R. J., Lombard, J. H. Integration of hypoxic dilation signaling pathways for skeletal muscle resistance arteries. Am J Physiol Regul Integr Comp Physiol. 283, R309-R319 (2002).
- Pavlov, T. S., Ilatovskaya, D. V., Palygin, O., Levchenko, V., Pochynyuk, O., Staruschenko, A. Implementing Patch Clamp and Live Fluorescence Microscopy to Monitor Functional Properties of Freshly Isolated PKD Epithelium. J Vis Exp. (103), (2015).
- Nelson, M. T., Conway, M. A., Knot, H. J., Brayden, J. E. Chloride channel blockers inhibit myogenic tone in rat cerebral arteries. J Physiol. 502 (Pt 2), 259-264 (1997).
- Brayden, J. E., Halpern, W., Brann, L. R. Biochemical and mechanical properties of resistance arteries from normotensive and hypertensive rats. Hypertension. 5, 17-25 (1983).
- Weber, D. S., Lombard, J. H. Elevated salt intake impairs dilation of rat skeletal muscle resistance arteries via ANG II suppression. Am J Physiol Heart Circ Physiol. 278, H500-H506 (2000).
- Weber, D. S., Lombard, J. H. Angiotensin II AT1 receptors preserve vasodilator reactivity in skeletal muscle resistance arteries. Am J Physiol Heart Circ Physiol. 280, H2196-H2202 (2001).
- Wang, J., Roman, R. J., Falck, J. R., de la Cruz, L., Lombard, J. H. Effects of high-salt diet on CYP450-4A omega-hydroxylase expression and active tone in mesenteric resistance arteries. Am J Physiol Heart Circ Physiol. 288, H1557-H1565 (2005).
- Raffai, G., et al. Modulation by cytochrome P450-4A omega-hydroxylase enzymes of adrenergic vasoconstriction and response to reduced PO2 in mesenteric resistance arteries of Dahl salt-sensitive rats. Microcirculation. 17, 525-535 (2010).
- Mishra, R. C., Wulff, H., Hill, M. A., Braun, A. P. Inhibition of Myogenic Tone in Rat Cremaster and Cerebral Arteries by SKA-31, an Activator of Endothelial KCa2.3 and KCa3.1 Channels. J Cardiovasc Pharmacol. 66, 118-127 (2015).
- Freed, J. K., Beyer, A. M., LoGiudice, J. A., Hockenberry, J. C., Gutterman, D. D. Ceramide changes the mediator of flow-induced vasodilation from nitric oxide to hydrogen peroxide in the human microcirculation. Circ Res. 115, 525-532 (2014).
- Beyer, A. M., Durand, M. J., Hockenberry, J., Gamblin, T. C., Phillips, S. A., Gutterman, D. D. An acute rise in intraluminal pressure shifts the mediator of flow-mediated dilation from nitric oxide to hydrogen peroxide in human arterioles. Am J Physiol Heart Circ Physiol. 307, H1587-H1593 (2014).
- Durand, M. J., et al. Vascular actions of angiotensin 1-7 in the human microcirculation: novel role for telomerase. Arterioscler Thromb Vasc Biol. 36, 1254-1262 (2016).
- Beyer, A. M., et al. Transition in the mechanism of flow-mediated dilation with aging and development of coronary artery disease. Basic Res Cardiol. 112, 5 (2017).
- Muller, J. M., Chilian, W. M., Davis, M. J. Integrin signaling transduces shear stress--dependent vasodilation of coronary arterioles. Circ Res. 80, 320-326 (1997).
- Liu, Y., Harder, D. R., Lombard, J. H. Interaction of myogenic mechanisms and hypoxic dilation in rat middle cerebral arteries. Am J Physiol Heart Circ Physiol. 283, H2276-H2281 (2002).
- Potocnik, S. J., et al. Endothelium-dependent vasodilation in myogenically active mouse skeletal muscle arterioles: role of EDH and K+ channels. Microcirculation. 16, 377-390 (2009).
- Harder, D. R. Pressure-dependent membrane depolarization in cat middle cerebral artery. Circ Res. 55, 197-202 (1984).
- Greene, A. S., Rieder, M. J. Measurement of vascular density. Methods Mol. Med. 51, 489-496 (2001).
- Hernandez, I., Cowley, A. W., Lombard, J. H., Greene, A. S. Salt intake and angiotensin II alter microvessel density in the cremaster muscle of normal rats. Am J Physiol. 263, H664-H667 (1992).
- Resende, M. M., Amaral, S. L., Moreno, C., Greene, A. S. Congenic strains reveal the effect of the renin gene on skeletal muscle angiogenesis induced by electrical stimulation. Physiol Genomics. 33, 33-40 (2008).
- Petersen, M. C., Munzenmaier, D. H., Greene, A. S. Angiotensin II infusion restores stimulated angiogenesis in the skeletal muscle of rats on a high-salt diet. Am J Physiol Heart Circ Physiol. 291, H114-H120 (2006).
- Frisbee, J. C., Weber, D. S., Liu, Y., DeBruin, J. A., Lombard, J. H. Altered structure and mechanics of skeletal muscle arteries with high-salt diet and reduced renal mass hypertension. Microvasc Res. 59, 323-328 (2000).
- Drenjancevic-Peric, I., Lombard, J. H. Introgression of chromosome 13 in Dahl salt-sensitive genetic background restores cerebral vascular relaxation. Am J Physiol Heart Circ Physiol. 287, H957-H962 (2004).
- Drenjancevic-Peric, I., Phillips, S. A., Falck, J. R., Lombard, J. H. Restoration of normal vascular relaxation mechanisms in cerebral arteries by chromosomal substitution in consomic SS.13BN rats. Am J Physiol Heart Circ Physiol. 289, H188-H195 (2005).
- Lukaszewicz, K. M., Paudyal, M. P., Falck, J. R., Lombard, J. H. Role of vascular reactive oxygen species in regulating cytochrome P450-4A enzyme expression in Dahl salt-sensitive rats. Microcirculation. 23, 540-548 (2016).
- Lombard, J. H., Sylvester, F. A., Phillips, S. A., Frisbee, J. C. High-salt diet impairs vascular relaxation mechanisms in rat middle cerebral arteries. Am J Physiol Heart Circ Physiol. 284, H1124-H1133 (2003).
- Priestley, J. R., et al. Reduced angiotensin II levels cause generalized vascular dysfunction via oxidant stress in hamster cheek pouch arterioles. Microvasc Res. 89, 134-145 (2013).
- Velmurugan, K., Alam, J., McCord, J. M., Pugazhenthi, S. Synergistic induction of heme oxygenase-1 by the components of the antioxidant supplement Protandim. Free Radic Biol Med. 46, 430-440 (2009).
- Widlansky, M. E., Gokce, N., Keaney, J. F., Vita, J. A. The clinical implications of endothelial dysfunction. J Am Coll Cardiol. 42, 1149-1160 (2003).
- Lukaszewicz, K. M., Falck, J. R., Manthati, V. L., Lombard, J. H. Introgression of Brown Norway CYP4A genes on to the Dahl salt-sensitive background restores vascular function in SS-5BN consomic rats. Clin Sci (Lond). 124, 333-342 (2013).
- Lukaszewicz, K. M., Lombard, J. H. Role of the CYP4A/20-HETE pathway in vascular dysfunction of the Dahl salt-sensitive rat. Clin Sci (Lond). 124, 695-700 (2013).
- Roman, R. J. P-450 metabolites of arachidonic acid in the control of cardiovascular function. Physiol Rev. 82, 131-185 (2002).
- Roman, R. J., Maier, K. G., Sun, C. W., Harder, D. R., Alonso-Galicia, M. Renal and cardiovascular actions of 20-hydroxyeicosatetraenoic acid and epoxyeicosatrienoic acids. Clin Exp Pharmacol. 27, 855-865 (2000).
- Roman, R. J., Alonso-Galicia, M. P-450 eicosanoids: A novel signaling pathway regulating renal function. News Physiol Sci. 14, 238-242 (1999).



