Summary
Detta manuskript beskriver in vitro- video mikroskopi protokoll för att utvärdera vaskulär funktion i råtta cerebral motstånd artärer. Manuskriptet beskriver också tekniker för att utvärdera microvessel densitet med fluorescently märkta lektin och vävnad perfusion med Laser Doppler Flowmetry.
Abstract
Detta protokoll beskriver användning av in vitro- TV-mikroskopi att utvärdera vaskulär funktion i isolerade cerebral motstånd artärer (och andra fartyg) samt tekniker för att utvärdera vävnadsperfusion som använder Laser Doppler Flowmetry (LDF ) och microvessel densitet utnyttja fluorescently märkt Griffonia simplicifolia (GS1) lektin. Nuvarande metoder för att studera isolerade motstånd artärer på transmural tryck stött i vivo och i avsaknad av parenkymal cell influenser ge en kritisk länk mellan in-vivo studier och information som erhålls från molekylär reduktionistiska synsätt som ger begränsad inblick i integrativ svaren på hela djurens nivå. LDF och tekniker för att selektivt identifiera arterioler och kapillärer med fluorescently-märkt GS1 lektin tillhandahålla praktiska lösningar för att aktivera utredarna att förlänga den kunskap som erhållits från studier av isolerade motstånd artärer. Detta dokument beskriver tillämpningen av dessa tekniker att få grundläggande kunskap om vaskulär fysiologi och patologi hos råtta som allmänna experimentell modell och i en mängd specialiserade manipulerade genetiskt ”designer” råtta stammar som kan ge viktig insikt av specifika gener påverkar viktiga vaskulär fenotyper. Utnyttja dessa värdefulla experimentella metoder i råtta stammar som utvecklats av selektiv avel strategier och ny teknik för att producera gen knockout modeller hos råtta, kommer att expandera stringens av vetenskapliga lokaler utvecklats i knockout musmodeller och utvidga kunskap till en mer relevant djurmodell, med förstådda fysiologisk bakgrund och lämplighet för fysiologiska studier på grund av sin större storlek.
Introduction
De tidigaste studierna av vaskulär funktion i artärerna utnyttjas conduit artärer, och i många fall aorta. Styrkebidrag i stora artärer studerades generellt genom att fästa en ring segmentet av artären till en kraftgivare i badkar vävnad; När det gäller aorta, remsor genom att skära spiralformade av fartyget så att de glatta muskelfibrerna var orienterade i längdriktningen mellan fästpunkten och kraft givaren, att tillhandahålla den bästa uppskattningen av den kraft som genereras genom sammandragning av den glatta muskulaturen längs sin längsgående axel. Den standard tekniken för att skära spiralformade remsor av artärer var att placera en glasstav i lumen av fartyget, göra ett snitt i kärlväggen i önskad vinkel och håller till slutet av den synliga kanten av kärlväggen som snittet förlängdes för att producera en hel spiralformade remsa av fartyget. På den punkten, den endothelial sidan av fartyget var allmänt utplånas för att ta bort skräp innan bifoga fartyget remsan till kraftgivare och dränka preparatet i en syresatt och tempererad vävnad bad. Så småningom, härrör att synsätt ledde till en av de mest berömda och viktiga upptäckterna i historien om fysiologi av Furchgott och Zawadski1, nämligen rollen av endotel avslappnande faktor (EDRF), därefter identifieras som kväveoxid, i reglerar vaskulär funktion. Den avgörande händelse som leder till denna upptäckt var en situation där utredarna underhålls en intakt endotel genom att undvika kontakt av endothelial sidan av artären med utländska ytor, och märkte att aorta remsan inte uppvisade den förväntade kontraktion till acetylkolin (ACh), men istället avslappnad svar på ACh. Baserat på denna iakttagelse, utredarna utvecklat en ”sandwich” beredning där de fästa en aorta segment med en intakt endotel (men inte för att generera kontraktila kraft) till en standard spiralformade remsa av aorta och konverterade den ACh-inducerad sammandragning i en avkoppling.
Två stora framsteg på detta område som i stor utsträckning används idag är utvecklingen av förberedelserna för att mäta aktiva kontraktila kraft i litet motstånd artärer2,3 (till exempel de i intestinal krös3 ) och kanylerade motstånd artär preparat4,5,6. I en av de tidigaste rapporterna, Mulvany och Halpern3 beskrivs användningen av tråd myograph preparatet att studera aktiva kontraktila kraft i isolerade motstånd artärer från intestinal tarmkäxet från spontant hypertensiva råttor (SHR) och normotensiva WKY kontroller. Efter utvecklingen av tråd myograph systemet utvecklades kanylerade motstånd artär preparat för att möjliggöra studier av fartyg närmare till i vivo villkor4,5,6. Medan båda metoderna ger värdefulla resultat, har kanylerade artär preparatet extra fördelarna med mer effektivt bevara inneboende aktiva tonen i artärerna; och gör att utredarna att studera aktiva myogenic svar på förändringar i transmural tryck och fartyget svar på förändringar i flödet och endotel skjuvspänning (se recension av Halpern och Kelley6).
Ett större mål av detta dokument är att beskriva hur man anställa den häfdvunna tekniken för video mikroskopi använda isolerade, kanylerade motstånd artärerna för att få exakt information om de mekanismer som reglerar aktiv tonen i dessa avgörande fartyg, oberoende av neurala, humorala eller parenkymal cell influenser. Denna grundläggande information, anställa en standard råtta modell och exempel från våra studier av nytt genetiskt konstruerade råtta stammar, kommer att ge läsaren en uppfattning om vilka typer av insikter om vaskulär funktion som kan vinnas med TV mikroskopi metoder, och som kan användas i studier där alla kontroll och experimentella grupp(er) av prövarens val, inklusive kraftfulla nya experimentella råtta modeller produceras av selektiv inavel och nyutvecklade genetiska ingenjörsteknik.
Tack vare precision av TV-mikroskopi strategier, kan mätning av diameter förändringar i kanylerade artär preparat ge värdefull information om endotel-beroende och endotel-oberoende mekanismer av vaskulär avkoppling, samt viktiga (och ibland oväntade) förändringar i vaskulär kontrollmekanismer som inträffar med hypertoni, hög salt kost och andra experimentella ingrepp. Dessutom, mätning av tryck-diameter relationer i isolerade och kanylerade motstånd artärer som maximally är avslappnad genom behandling med Ca2 +-gratis lösning eller ett farmakologiska vasodilaterande läkemedel, tillåter utredaren att bedöma strukturella förändringar i artärer på grund av vaskulär remodeling och för att beräkna passiva stress-stam relationer7 som kan ge viktiga insikter om förändringar i artärerna som kan påverka arteriell funktion passiva mekaniska egenskaper oberoende av (eller i tillägg till) förändringar i aktiva kontrollmekanismer. Det är också viktigt att notera att information som erhålls från studier av isolerade motstånd artärer kan kompletteras med information som erhållits genom att använda LDF, en praktisk metod för att utvärdera vävnadsperfusion på hela djurens nivå8,9 ,10, och av information de fått från att bedöma microvessel densitet med fluorescently märkta GS1 lektin, som specifikt binder till glykoprotein beståndsdelarna i basalmembranet små arterioler och kapillärer11 , 12. den senare metoden ger en mycket noggrann uppskattning av microvessel densitet som inte omfattas av de klassiska svårigheter i att uppskatta microvessel densitet genom att räkna fartyg i vivo, till exempel saknade icke-perfusion fartyg där blodflödet stoppas på grund av aktiva stängningen av arterioler. När de används tillsammans, kan dessa metoder ge viktig insikt för att korrelera funktionella förändringar i isolerade motstånd artärerna till förändringar i vävnadsperfusion på blodcirkulationens nivå. och några exempel på användning av dessa värdefulla metoder i samband med kanylerade artär tekniker kommer också att ges i det nuvarande manuskriptet.
Detta dokument fokuserar på användning av video mikroskopi tekniker att utvärdera vaskulära förändringar i artärerna i utkonkurrerat dö ut Sprague-Dawley-råttor. Det är dock viktigt att notera att dessa tekniker har visat sig vara mycket värdefullt att belysa fenotypiska förändringar i högspecialiserade genmanipulerade råtta stammar skapad av selektiv avel eller gen redigering med tekniker. I detta manuskript tillhandahåller vi exempel på hur video mikroskopi tekniker har gett viktig information angående vaskulär funktion i ett antal värdefulla råtta modeller, inklusive den Dahl salt-känsliga (SS) råtta-an inavlade råtta stam som är den mest används experimentell modell för att studera mekanismerna bakom salt känsliga hypertenson18,19,20,21,22,23. och consomic råttor skapas via selektiv avel av SS råttor med salt-okänsliga Brown Norge (BN) råtta stam. I panelerna consomic råtta varit varje kromosom från Brown Norge råttan introgressed individuellt in i Dahl SS24,25,26 genetiska bakgrunden. Användning av consomic råtta paneler har lämnat värdefulla ledtrådar om specifika kromosomer som bidrar till salt känslighet av blodtryck och andra fenotyper, däribland vaskulär reaktivitet24,25,26 ,27,28.
Selektiv avel strategier använder SS råttor och consomic råttor bär enskilda BN kromosomer har också aktiverat generationen av förträngda congenic stammar med små segment av enskilda Brown Norge kromosomer introgressed Dahl SS genetiska bakgrund22,29. Dessa kan ge mycket värdefull input på specifika gener eller smala regioner i kromosomer som kan påverka avgörande fysiologiska variabler, såsom blodtryck, njurskador och vaskulär reaktivitet22,29. Ett annat kraftfullt tillägg till råtta genetiska verktygslådan är utvecklingen av råtta gen knockout modeller utnyttja avancerade gen redigering tekniker inklusive motvilligt, transkriptionell aktivator-liknande-effektor nukleaser (TALENS), och mest nyligen CRISPR-Cas913 ,14,15,16,17. Tillkomsten av dessa kraftfulla tekniker som aktivera gener att vara utslagen hos råtta är en oerhört viktig utveckling eftersom genen knockout studier hittills har använt (och fortsätta att använda) möss nästan uteslutande. En annan experimentell komponent i detta dokument visar värdet av kanylerade artär tekniker och video mikroskopi att utvärdera fysiologiska kontrollmekanismer i knockout råttor saknar master antioxidant och cell skyddande transkription faktor, nuclear factor (erytroid-derived 2) - som - 2 (NRF2)30,31, som utvecklades med hjälp av TALEN teknik i Sprague-Dawley genetisk bakgrund17. I dessa experiment användes in vitro- video mikroskopi tekniker att tillhandahålla funktionell kontroll av förlust av NRF2 genen och testa ett potentiellt värdefulla terapeutiska tillvägagångssätt baserat på direkt uppreglering av NRF2-medierad antioxidant försvar. NRF-2 är av betydande terapeutisk betydelse i kampen mot vaskulär oxidativ stress hos människor, mot bakgrund av de nedslående resultaten av kliniska prövningar som inbegriper direkt administrering av antioxidanter som vitamin C och E32.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
De Medical College i Wisconsin institutionella Animal Care och användning kommittén (IACUC) godkänd alla protokoll som beskrivs i detta dokument och alla förfaranden är i överensstämmelse med den National Institutes of Health (NIH) Office av laboratorium djur välfärd (OLAW) förordningar.
1. beredning av lösningar och fartyget kammare
- Innan du utför en serie experiment, förbereda 2 L 20 x koncentrerad salt stamlösning bestående av 278 g/L NaCl. 14 g/L KCl; 11.52 HB MgSO4. 7H2O; och 9,4 HB CaCl2. 2H2O. Förbereder också 2 L 20 x koncentrerad buffertlagret bestående av 80,8 redov NaHCO3 och 0,4 g/L EDTA, och 2 L 20 x koncentrerad Ca2 +-gratis stamlösning bestående av 281,6 g/L NaCl. 14 g/L KCl och 11.52 HB MgSO4. 7H2O.
Obs: 20 X stamlösningar kan förvaras i kylskåp fram till användning. - På dagen för experimentet, förbereda 2 L av fysiologisk saltlösning (PSS) från 20 x koncentrerad stamlösningar som följer: Tillsätt 100 mL av 20 x salt lager till 1 800 mL avjoniserat vatten i en 2 L Erlenmeyerkolven eller bägare på en motoriserad omrörning tallrik. Tillsätt 100 mL av 20 x buffertlagret samtidigt kontinuerligt equilibrating lösningen med en gasblandning som innehåller 21% O2, 5% CO2, balans N2och omrörning det med magnetisk omrörning bar. Tillsätt långsamt 0.28 g NaH2PO4 medan övervakning pH; Justera vid behov till pH 7,4 genom att lägga till droppar 6 N HCl eller 6,5 N NaOH-lösning från en Pasteur-pipett. När PSS är beredd, och pH justeras, lägga till PSS 1.98 g glukos.
Obs: Det är viktigt att sakta lägga NaH2PO4 senast medan övervakning pH i PSS eftersom tillägg av NaH2PO4 till en alkalisk lösning (pH > 7,4) kunde bilda en kalciumfosfat fällningen, som indikeras av den utseendet på en grumlig lösning eller en vit fällning i botten av behållaren.
Obs: Den slutliga sammansättningen av PSS är 119 mM/L NaCl. 4.7 mM/L KCl; 1.17 mM/L Mg2så4. 1.6 mM/L CaCl2; 1.18 mM/L NaH2PO4; 24 mM/L NaHCO3; 0,03 mM/L EDTA; och 5,5 mM/L glukos. Även om sammansättningen av PSS kan skilja sig mellan laboratorier, är detta recept mycket lämplig för att behålla kärltonus och endotelfunktion Svaren till vasoaktiva medel i isolerade motstånd artärer. - Att bestämma maximal diameter och bedöma aktiva tonen i artären genom att producera maximalt dilatation av fartyget, förbereda 500 mL Ca2 +-gratis PSS genom att lägga till 25 mL av de 20 X Ca2 +-gratis salt lager till 450 mL avjoniserat vatten , följt av 25 mL 20 x buffertlager i en Erlenmeyerkolv eller bägare liknande steg 1.2 ovan. Lägga till 0,07 g av NaH2PO4 i lösningen medan övervakning och justera pH-värdet i lösningen. Den Ca2 +-gratis PSS läggs till PSS reservoar och fartyget kammaren i slutet av experimentet att undvika ozonnedbrytande intracellulära Ca2 + butiker som kan påverka fartygets svaren i normala PSS. Eftersom den Ca2 +-gratis lösning tillsätts i slutet av experimentet att producera maximal avkoppling av artärerna, det finns ingen anledning att lägga till glukos till PSS.
Obs: När du är klar, den slutliga sammansättningen av de Ca2 +-gratis PSS är 120,6 mM/L NaCl. 4.7 mM/L KCl; 1.17 mM/L Mg2så4. 1.18 mM/L NaH2PO4; 24 mM/L NaHCO3; 0 mM/L CaCl2; och 0,03 mM/L EDTA.
Obs: För många studier som kräver maximal dilatation av artären, en kalcium posten blockerare såsom verapamil (1 µM) och/eller kväveoxid givare såsom natriumnitroprussid (10 µM) kan läggas till lösning, förutom att ta bort Ca2 + från PSS. - Upprätthålla den PO2, PCO2och pH av PSS genom kontinuerligt equilibrating PSS flödar in i fartyget kammaren i ett standard orgel bad används för att studera isolerad aorta ringar, tarmens muskulatur eller andra vävnader (figur 1). Använda syntetiska fluorpolymer av tetrafluoreten slangar för att ansluta bensintanken till orgel badet eftersom denna typ av slangar är gas ogenomtränglig, i motsats till många andra former av slangar, t.ex., latex.
- Placera en liten air sten ansluten till Jämviktstiden gasblandningen i fartyget kammaren för att upprätthålla den PSS gassammansättning.
Obs: Fartyget svar på förändringar i PO2 kan testas genom equilibrating PSS i fartyget kammare och luminala perfusatet med gasblandningar som innehåller olika procentsatser av O2, t.ex., 21% O2, 10% O2, 5% O2 , och 0% O2, med 5% CO2 och balans N233,34,35. För större artärer med tjockare väggar, där diffusion av syre in i centrera av kärlväggen kan vara en begränsning, kan en högre andel av syre, t.ex., 95% O2 användas. - Noga följa temperaturen i fartyget kammaren, eftersom enskilda rummen kan variera i sin värme överföring egenskaper.
Obs: Många kommersiellt förberedda fartyget kammare används för studier av kanylerade motstånd artärer utnyttja en Peristaltisk pump för att leverera syresatt PSS från en gas-jämviktas reservoar och ge mycket exakt kontroll av bad temperatur och syresättning av PSS. - Placera PSS i en stor (2 L) Mariotte flaska, med propp och centrala glasrör att fungera som en reservoar att kontinuerligt leverera PSS in orgel badet som värmer och gas-balanserar PSS flödar in i fartyget kammaren (figur 1A).
- Placera öppnandet av centrala glasröret i Mariotte flaskan på samma nivå som toppen av PSS i orgel badet, att upprätthålla en konstant hydrostatiskt Tryckhuvud för leverans av PSS in i orgel badet. Användning polyeten slangen ansluten till en J-formad glas eller plast rör att leverera PSS från Mariotte flaskan in i orgel badet.
- För luminala perfusion (figur 1A), Använd polyeten slangen för att ansluta inflöde pipetten till en PSS reservoaren består av en 60 cc spruta av plast upphöjts till en position som bibehåller önskad inflöde trycket (oftast 80 mmHg för studier av råtta cerebral (artärer), mätt med ett tryck givare ansluten till systemet via en Avstängningskranen.
- Anslut utflöde pipetten till ett polyeten rör att tillåta PSS att flöda genom kärlet som svar på en tryckgradient och ansluta raden utflöde till en reservoar som liknar reservoaren inflöde. Använda en liknande Avstängningskranen och trycket givaren anslutning för att mäta utflöde tryck.
Obs: Förfaranden för inställning transmural tryck och kontrollera flödet genom kärlet beskrivs i avsnitt 2, nedan. - Vid slutet av experimentet, skölj den kammare, leverans linjer och reservoar-system med destillerat vatten. Med täta intervall, Byt ut slangar och leverans linjer, ren eller ersätta Avstängningskranar i systemet, och regelbundet utsätta någon glas PSS reservoarer för en syra tvätta att förhindra tillväxt av bakterier och andra mikroorganismer som orsakar kontaminering och påverka fartyget reaktivitet.
2. kanylerade artär förberedelse
- Söva en Sprague-Dawley råtta med 5% isofluran och underhåll av anestesi med 1,5-2,5% medicinskt syre36. Alternativt kan du administrera en intramuskulär injektion innehållande ketamin (75,0 mg/kg), Acepromazin (2,5 mg/kg) och xylazin (10,0 mg/kg); en intraperitoneal injektion av pentobarbital (50-60 mg/kg); eller någon annan godkänd metod för anestesi, beroende på protokoll eller prövaren preferenser.
- Halshugga råtta under djup anestesi och ta bort hjärnan för studier av cerebral motstånd artärer.
- Efter avlägsnande av hjärnan, noggrant isolera den mellersta cerebral artären (MCA) (eller andra artärer av intresse, t.ex., basilaris artär eller posterior cerebral artär)37,38. Att isolera MCAs, placera hjärnan liggande i ett glas petriskål fylld med iskall PSS (figur 2).
- Använda Vännäs sax och en Dumont #5 fin spets pincett för att punktskatt MCA från hjärnan. Rengör eventuella kvarvarande hjärnvävnad från MCA använder tången och överföra artären till en temperatur kontrollerade fartyget kammare som innehåller PSS som tidigare beskrivits. 33 , 34 .
- För att överföra artären till fartyget kammaren, försiktigt hålla exciderad fartyget av ACA eller bakre kommunicerande artären segment och placera den försiktigt in i kammaren.
Obs: Utöver MCA, systemets kanylerade fartyget är lämplig för en mängd olika små fartyg preparat, inklusive skelettmuskulaturen motstånd artärer33,39,40, mesenteriska motstånd artärer 38 , 41 , 42och stor (första order) arterioler av cremaster muskel43, samt mänskliga koronar arterioler och mänskliga arterioler erhållits från subkutan fettvävnad under gluteala biopsi44,45, 46,47. - Tillmäta den inflöde mikropipett artären genom att dra det mot basen pipett tills spetsen förskott till lumen av MCA. Säkra artären på inflöde pipetten genom att knyta en ögla beredd från en enda strand fiber tidigare retad från 10-0 suturer runt artär (figur 1B). Säkra den motsatta änden av MCA till utflöde pipetten genom att skärpa en andra sutur slingan runt kärlet (figur 1B).
Obs: Placera suturen öglorna på Mikropipetter före montering fartyget och placera dem nära den sista punkten i bifogad fil, så att de kan vara enkelt gled över artären och snabbt säkrade när fartyget är i position, vilket minimerar risken för den artär glider av pipetterna.
Obs: Mikropipetter förbereds av borosilikatglas kapillär slangar (2 mm yttre diameter, 1 mm innerdiameter, 10 cm lång) med hjälp av vertikala mikropipett avdragare. Innan fästa artären, matcha tip diametrarna på Mikropipetter så nära som möjligt för att förhindra avvikelser av inflöde och utflöde motstånd i systemet perfusion. - När artären är säkert bunden till Mikropipetter, använda den mikrometer ansluten till innehavaren inflöde pipetten för att sträcka artären till dess i situ -längd.
- Binda alla sidogrenar med singeln strandar retad från 10-0 suturer för att upprätthålla ett konstant tryck i artären.
- Kontrollera frånvaron av läckor genom att se till att det konstant intraluminal (transmural) trycket efter tillfälligt stänga inflöde pipetten. Binda alla grenar eller kontrollera om hål i fartyget om trycket sjunker. Återställa perfusion efter att ha kontrollerat att transmural trycket förblir konstant.
Obs: Kanylering av isolerade motstånd artärer kräver fingerfärdighet och praxis. De huvudsakliga försiktighetsåtgärderna som skall iakttas är att undvika att bryta av pipetter och se till att artären inte glider av pipetterna. Det är viktigt att vara varsam med isolerade artärerna under hela förfarandet, eftersom trauma att fartyget kan skada endotel och/eller störa normal funktion av den vaskulära glatta muskulaturen. - Mäta den inre diametern av artären med hjälp av en video mikroskopi setup (figur 1A) bestående av en kamera kopplad till ett dissekera Mikroskop och ansluten till en video mikrometer och TV-monitor (siffror 1B, 1 C). Detta tillåter observatören att mäta fartygets diametrar manuellt genom att placera lös referenslinjer på den inre väggen i artären och, om så önskas, på den yttre väggen i artären samt, för att mäta fartyg väggtjocklek.
Obs: Vissa video mikrometrar erbjuda automatisk spårning av fartygets dimensioner.
Obs: Kalibrera den video Mikrometern med ett Mikroskop objektmikrometern och inflödet och kassautflöde tryckgivare med kvicksilver manometer (0 mmHg, 50 mmHg, 100 mmHg, 150 mmHg och 200 mmHg) mellan experiment för att säkerställa noggranna mätningar av fartyg diameter och intraluminal trycket.
Obs: Standard styrtrycket transmural för råtta MCA experiment är 80 mmHg. Kalibrering för högre och lägre trycknivåer försäkrar noggrannhet för studier av myogenic svar på förändringar i transmural tryck och passiva trycket-diameter kurvor i maximally dilaterade artärer. - Justera höjden på de inflöde och utflöde reservoarerna för att upprätthålla önskad transmural trycket på en konstant nivå. Att höja reservoaren inflöde av en liten mängd (< 5 mmHg) och sänka reservoaren utflöde av samma belopp underhåller det betyda transmural trycket och skapar perfusion flöde i fartyget lumen6.
Obs: Att höja reservoaren inflöde och sänka reservoaren utflöde med lika stora belopp upprätthåller den samma betyder transmural distending tryck i artären, men genererar ett hydrostatiskt tryckgradient som orsakar flödet och skjuvspänning i fartyget, så att den utredare att utvärdera endotel-beroende svar på förändringar i intraluminal skjuvspänning i olika experimentella grupper48. - För att bedöma myogenic svar och fartyget på vasodilaterande stimuli, se till att artären uppvisar en lämplig grad av aktiva ton (ca 40%) före experimentet. Kassera alla artärer som saknar aktiva tonen i vila med undantag av fartyg, t.ex., små mesenterica artärer som inte normalt uppvisar aktiv vila tonen.
Obs: För fartyg som inte normalt uppvisar spontana tonen, pre tygla artärerna av motsvarande belopp utnyttja en vasokonstriktor agonist såsom noradrenalin eller fenylefrin. En bra metod för att välja dosen av den agonist används till pre tygla artären är att utnyttja en EG50 dos av vasokonstriktor agent, t.ex., noradrenalin41,42. Farmakologiska vasokonstriktor ombud bör dock inte gälla artärer som uppvisar spontana aktiva tonen under vila villkor. - Test av den kanylerade motstånd artären reaktivitet på endotel-beroende genom att mäta fartygets diametrar under tillägg av ökande koncentrationer av ACh (10-10 m-10-5 M) till fartyget kammaren. Testa endotel-oberoende kväveoxid känsligheten hos den vaskulära glatta muskulaturen genom att mäta fartygets diametrar under tillägg av ökande koncentrationer (10-10 m-10-5 M) av den kväveoxid givare natriumnitroprussid till den fartyg kammare.
Obs: Ljuskänslighet vasokonstriktor agenter och andra vasodilaterande agonister kan testas på ett liknande sätt genom att lägga till ökande koncentrationen av agonist till avdelningen i fartyget.
Obs: Utöver vasoaktiva medel, olika läkemedel, hämmare och andra farmakologiska agenter kan läggas till vävnad badet eller den luminala perfusatet. Förändringar i PO2 (liksom PCO2 och pH) kan selektivt administreras till den endothelial sidan eller extra-luminala sida av artären av separata Jämviktstiden av den luminala perfusatet med en air sten ansluten till en kalibrerad gasblandning olika från blandningen används temperera PSS vävnad bad33,34,49. Myogenic Svaren till förändringar i transmural tryck kan studeras genom att stänga utflöde pipetten och att höja (eller sänka) höjden av reservoaren PSS ansluten till inflöde pipett49,50,51 till öka eller minska intraluminal trycket. - För att testa rollen av endotel i medla fartyget Svaren till specifika stimuli, ta bort den vaskulära endotelet och jämför fartyget Svaren till dessa stimuli i närvaro eller frånvaro av endotel. Ta bort endotelet, noggrant untie artären från utflöde pipetten och långsamt BEGJUTA lumen av artären med en luft-bolus (0,5-1,0 mL). Återställa PSS perfusion avmarkera det cellulära skräpet innan nytt binda fartyget till utflöde pipett43efter luft perfusion.
Obs: Efter endothelial denudation proceduren, det är viktigt att kontrollera att endotelet tas bort genom att testa vaskulär Svaren till en agonist (vanligtvis ACh) kända för att producera endotel beroende vasodilatation i denna fartygstyp. Dock i vissa patologiska förhållanden släpps endotel-beroende vasoconstrictors, i vilket fall, det är viktigt att kontrollera att constrictor svaret elimineras följande endothelial avlägsnande. - Vid slutet av experimentet, bestämma maximal diameter av artären genom att lägga till Ca2 +-gratis PSS till perfusatet och superfusate. Beräkna aktiv vila tonen (%) som ((Dmax-Dresten) / dmax) x 100, där Dmax är maximal diameter i närvaro av Ca2 +-gratis lösning och Dresten är vilande kontroll diameter.
Obs: Diameter mätningar av maximally avslappnad artärerna i olika experimentella grupper är värdefulla i jämföra aktiv vila ton, strukturella remodeling (dvs.ändringar i vägg tjocklek och lumen diameter) och passiv mekaniska egenskaper (stress-stam relationer beräknas från passiva diametrar på olika nivåer av transmural tryck).
3. utvärdering av cerebrala blod flöde svaren med LDF
- Söva djuret med 5% isofluran och säkra råtta i en stereotaxic apparat9,10.
- Behålla djuret under konstant anestesi samtidigt övervaka andningen frekvens, slutet tidal CO2och djup anestesi med en tå nypa36.
- Noggrant tunna skallen att genomskinlighet med hjälp av en låg hastighet dental borr och mineralolja för att tillhandahålla optisk koppling10. Var försiktig att undvika genererar hetta och undvika genomträngande benet.
Obs: Gallring av skallen tillåter laserljuset att nå underliggande vävnad och reflekteras tillbaka till sonden för att mäta den Dopplereffekten, vars storlek bestäms av antalet rörliga partiklar (dvs, röda blodkroppar) och deras hastighet. - Säkra LDF sonden i en micromanipulator och placera den direkt över området tunnas i skallen. Under experimentet är det mycket viktigt att förhindra förflyttning av antingen LDF sonden eller för att förbereda sig, som LDF är utformad för att mäta flöde i ett begränsat område av vävnad och är extremt känsliga för rörelse artefakter.
Obs: Varje förflyttning av sonden från utgångsläget kommer att ge en uppskattning av blodflödet i ett annat område av vävnad, utgör hinder för jämförelser. Medan LDF ger inte absolut flödesvärden och lämpar sig inte för jämförelse mellan ämnen, är det ett utmärkt sätt att noninvasivt värdera förändringar i vävnadsperfusion som svar på experimentella ingrepp i enskilda ämnen; och relativa förändringar i LDF signalen från kontrollvärdena kan i genomsnitt och jämfört med förändringar i LDF signalen från kontroll i andra experimentella grupper.
Obs: LDF är en bekväm metod att få insikt i faktorer som reglerar blodflödet i nivå med hela vaskulära sängen i olika experimentella grupper8,9,10. Utvärdering av vävnadsperfusion med LDF ger ett praktiskt tillvägagångssätt för att tillgodogöra sig kunskaper från isolerade fartyget studier i en hel säng perspektiv. Spärra regionala skillnader i vaskulär kontrollmekanismer motstånd artärer och mikrocirkulationen ger mätningar som erhållits med LDF en bra indikation på vävnad blod flödeskontroll som är allmänt förenligt med resultat som erhållits med kanylerade artär preparat.
4. utvärdering av skelettmuskulaturen Microvessel densitet med GS1 lektin
- Ta bort cremaster muskeln från en mansperson råtta genom att skära öppna pungen med standard fina kirurgisk sax och sedan använda en Dumont #5 pincett för att förstå muskeln.
Obs: Tunna muskler(t.ex., cremaster muskeln, samt extensor digitorum longus och tibialis anterior muskler som finns i både han- och honråttor) är idealiska för användning som hela fästen för lektin studier, även om histologiska avsnitt kan användas för tjockare vävnader. - Ta bort cremaster muskeln från testikeln med ett enda snitt. Placera den i iskall PSS och fästa den ut i en petriskål med silikon elastomer foder längst inuti yta. Försiktigt reta bort bindväv med Dumont #5 pincett.
- Skölj av muskel prov med 2 mL buffrad PSS och sedan doppa dem i rodamin-märkt GS1 lektin (20 µg/mL PSS) för 50 min i en 12-väl cell kultur plattan med 2 mL/väl som är insvept i aluminiumfolie att utesluta ljus.
- Ta bort vävnader från lektin lösningen, skölj dem tre gånger i PSS med 5 min ”tvätta” inkubationer på en rocker och montera dem på objektglas. Se till att Inkubera vävnader i mörkret och lagra bilder i mörkret för att förhindra förlust av fluorescens.
Obs: Om bilderna inte kan användas omedelbart, de kan förvaras i kylskåp med ingen förlust av fluorescens. För långvarig lagring, kan bilderna förvaras i frys att förhindra försämring11. - Utvärdera microvessel densitet genom att räkna antalet korsningar av de märkta microvesselsna med datorgenererade rutnätslinjer ovanpå den bild52, eller med en tydlig rutnät överlägg ovanpå bildskärmen används för att visa bilderna.
Obs: GS1 lektin metoder har använts för att demonstrera: salt-inducerad mikrovaskulära förtunning53, den skyddande effekten av att förhindra salt inducerad angiotensin II dämpning i återställa microvessel densitet i salt matad djur17 ,53,54; rollen av NRF2 medla den skyddande effekten av låg dos angiotensin II infusion för att förhindra microvessel förtunning i salt matad råttor17; och också för att utvärdera rollen av angiotensin II att upprätthålla angiogena Svaren till kronisk muskelstimulering i salt utfodras råttor54,55. En fördel med GS1 lektin tekniken är att den kan användas för att bedöma microvessel densitet i de samma djur som används för studier av kanylerade motstånd artärer eller LDF.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
In vitro mikroskopi av kanylerade motstånd artärer möjliggör studier av faktorer som påverkar active tonen i litet motstånd artärer (och större arterioler) vid normal i vivo transmural tryck och i avsaknad av parenkymal cell påverkan. Förutom att bedöma Reaktiviteten hos fartygen till olika vasodilaterande och kärlsammandragande stimuli och myogenic Svaren till transmural tryck höjd i normala PSS, den Ca2 +-gratis PSS kan läggas till perfusatet och superfusate i slutet av försöket att bestämma den maximala fartyget diameter och väggtjocklek. De senare mätningarna är mycket värdefulla i bedömningen av vaskulär remodeling, dvsförändringar i vägg/lumen förhållandet som kan uppstå som svar på förändringar i blodtryck eller administration av farmakologiska medel. Mätningar av diametern på maximally vidgade fartyg i Ca2 +-gratis PSS är användbara för att beräkna inneboende tonen som ((Dmax-Dresten) / dmax) x 100, där Dmax och Dresten är maximalt (Ca2 +- gratis PSS) och vilar diameter (PSS), respektive vid Jämviktstiden styrtrycket (oftast 80 mmHg för MCA). I vår erfarenhet, aktiva tonen i MCA i genomsnitt omkring 40% vid en transmural tryck på 80 mmHg. Mäta diametern på maximally dilaterade artärer är också ett praktiskt sätt att utvärdera de passiva mekaniska egenskaperna av fartyg genom att mäta diametern av artärerna på olika nivåer av transmural distending trycket och använder resultaten till beräkna stress-stam relationer och andra mekaniska egenskaper fartyg7,56.
Figur 3 är en schematisk representation av tre trånga congenic stammar härrör från SS.13BN råtta utnyttja ytterligare selektiv avel metoder. I dessa råtta stammar, de kromosomala segment inkluderar antingen den Brown Norge renin allelen (Ren1 miljarder) eller är avskurna precis ovanför (Ren1-SSA) eller bara nedanför (Ren1-SSB) det renin gen locus (därmed behålla den SS renin allelen). Att studera29, det kromosomala segment som innehåller den Brown Norge renin allelen innehöll endast 25 gener.
Figur 4 illustrerar svaret på endotel-beroende vasodilatorn ACh (1 µM) i isolerade MCAs från Dahl SS hanråttor och tre minskat congenic stammar visas i figur 3. Kombinerad användning av dessa tre congenic stammar som inkludera (Ren1 miljarder) eller skärs av strax ovanför (Ren1-SSA) eller nedanför (Ren1-SSB) renin genen begränsad regionen av intresse (dvs., området kring det renin gen locus) till cirka 25 gener. I dessa experiment, djuren var normotensiva och matas en låg salthalt (0,4% NaCl) kost. Denna studie29 endotel-beroende dilatation till ACh var frånvarande i SS föräldrarnas stam och i båda congenic stammar behålla den SS renin-allelen, men återställdes i congenic stam bär den BN renin allelen i SS genetiska bakgrunden. Resultaten av denna studie stödde resultaten av tidigare studier utnyttjar SS.13BN consomic råttor57,58 och lämnade starka bevis att endotelial dysfunktion är SS råttor, även när de är normotensiva och ges en låg salt kost. Tas är tillsammans, resultaten av dessa studier29,57,58 stöder hypotesen att endotelial dysfunktion i SS råttor på grund av nedsatt förordning av renin genen, vilket resulterar i kronisk exponering för låga nivåer av angiotensin II i blodet.
En annan studie59, sammanfattas i figur 5, jämfört med svaren på endotel-beroende vasodilatorn ACh i isolerade MCAs (MCA) från Dahl SS hanråttor och SS.5BN consomic råttor bära kromosom 5 (innehållande Brown Norge gener för olika isoformer av cytokrom P450-4A ω-hydroxylas). I denna studie, djuren matades antingen en låg salthalt (0,4% NaCl) eller hög salthalt (4% NaCl) kost. I motsats till MCA från SS råttor bibehölls endotel beroende dilatation till ACh i MCA från SS.5BN consomic råttorna matas låg salt kost. Dessutom (och i motsats till resultaten från SS.13BN consomic råttor57,58, Sprague-Dawley råttor33,39,40,60och gyllene hamstrar 61), en hög salt kost lyckats eliminera ACh-inducerad dilatation i SS.5BN råttor, som anger att CYP450-4A ω-hydroxylas och 20-hydroxyeicosatetraenoic syra (20-HETE) är viktig bidragsgivare till vaskulär oxidant stress och endotelceller dysfunktion i SS råttor och under förhöjda salt intaget i andra stammar. Från en experimentell perspektiv, hög salt kost misslyckande att eliminera endotel-beroende dilatation till ACh innehåller ett exempel på hur studier av kanylerade motstånd artärer kan ge oväntade fynd som avgår från konventionell visdom och kan leda till en ny förståelse av komplexa kontrollmekanismer som påverkar funktionen av dessa avgörande fartyg.
Figur 6 visar svaret av isolerade MCA till ACh (1 µM) i vildtyp och Nrf2(- / -) knockout råttor utfodras en låg salt kost (0,4% NaCl), hög salt kost (4% NaCl), eller en hög salt kost som innehåller en känd NRF2 aktivator30,62 . I avsaknad av salt-inducerad oxidativ stress var ACh-inducerad dilatation likartad i MCA från vildtyp och Nrf2(- / -) knockout råttor. Överensstämmer med resultaten från tidigare studier av Sprague-Dawley-råttor, hög salt kosten elimineras ACh-inducerad dilatation i vildtyp och Nrf2(- / -) knockout råttor. Tillägg av den NRF2-induceraren till hög salt diet återställd endotel-beroende dilatation till ACh i vildtyp råttor, men inte i Nrf2(- / -) råttor, demonstrerar framgångsrika eliminering av Nrf2 genen i knockout råttor, och stödja användningen av NRF2 upp-regulatorer som en terapeutisk metod att förbättra vaskulär oxidativ stress.
Figur 7 sammanfattar resultaten av LDF mätningar jämföra svaren från pial mikrocirkulationen till en progressiv minskning arteriellt blodtryck som produceras av successiva blod volym uttag i Sprague-Dawley-råttor som underhålls på antingen en normal salt (0,4% NaCl) diet eller en hög salthalt (4% NaCl) kost i fyra veckor. I motsats till råttor utfodras en låg salt kost, utfodras råttor hög salt kost utställningen en nedsatt förmåga att behålla en konstant blodflöde under sänkningar av perfusionstrycket, vilket indikerar att mekanismerna som ansvarar för cerebrala blod flöde självregleringen är äventyras av långvarig exponering till en hög salt kost. Resultaten av dessa experiment är förenliga med närvaro av nedsatt relaxering mekanismer i isolerade cerebrala artärer salt matad råttor60 och ge ett bra exempel på hur LDF mätningar kan användas för att stödja och utöka den resultaten av studier som sysselsätter isolerade motstånd artärerna till nivån för hela vaskulära sängen.
Förutom utvärdering av motstånd artär funktion använder isolerade artärer och vävnadsperfusion med laser-Doppler flowmetry, microvessel densitet och angiogena Svaren till olika stimuli såsom kronisk muskel stimulering54, 55 kan utvärderas i samma djur utnyttjar fluorescently-märkt GS1 lektin, som selektivt binder till glykoprotein beståndsdelarna i basalmembranet i arterioler och kapillärer. Figur 8 visar typiska lektin färgning i cremaster muskeln Sprague-Dawley-råttor utfodras en låg salt kost eller hög salt kost i 2 veckor (Observera lägre tätheten av microvesselsna i hög salt fed råttor). Microvessel densitet bedöms genom att räkna genomskärningarna av lektin-märkt microvesselsna med en datorgenererad referens rutnät52, och ger en utmärkt metod för att utvärdera angiogena Svaren54,55 eller till identifiera och kvantifiera förlusten av microvesselsna vid sjukdomar som högt blodtryck och förhöjda salt intaget12,17,53.

Figur 1: In vitro video mikroskopi setup sysselsatt att studera isolerade, kanylerade motstånd artärer (A). Kanylerade motstånd artär knuten till glas Mikropipetter (B) och video mikrometer display visar mätning av lumen diameter i kanylerade motstånd artär (C). Skalstapeln i Panel B representerar den inre diametern av kanylerade artär (µm) och 125 µm i Panel C är video visning av avståndet mellan rörliga referenslinjer placeras manuellt på innerväggarna i artären observatören genomför experimentet . Klicka här för att se en större version av denna siffra.

Figur 2: Schematisk bild av förfarandet för att isolera den mellersta cerebral artären från hjärnan och förbereda det för kanylering med Mikropipetter. Klicka här för att se en större version av denna siffra.

Figur 3: Schematisk bild av förträngda congenic råtta stammar med små segment av Brown Norge kromosom 13 introgressed in i Dahl salt känsliga genetiska bakgrunden. Kromosomala segment antingen innehöll den Brown Norge renin allelen (Ren1 miljarder) eller skärs av strax ovanför (Ren1-SSA) eller strax under (Ren1-SSB) det renin gen locus och således behålla den SS renin allelen. Denna siffra har modifierats och särtryck ur Durand o.a. 29 med tillåtelse av American fysiologiska Society. Klicka här för att se en större version av denna siffra.

Figur 4: Svar av isolerade, kanylerade MCAs av SS råttor och congenic råtta stammar (illustreras i figur 2) till 1 µM acetylkolin. Data är uttryckt som genomsnittlig diameter förändring (Δ µm) ±SEM från Vila kontroll diameter före acetylkolin och är ombyggt från ett original studie av Durand o.a. 29 Klicka här för att se en större version av denna siffra.

Figur 5: Svar av isolerade, kanylerade MCAs av SS råttor och SS.5BN consomic råttor till 1 µM acetylkolin i djur utfodras låg salthalt (0,4% NaCl) eller hög salthalt (4% NaCl) kost. Data är uttryckt som genomsnittlig diameter förändring (Δ µm) ±SEM från Vila kontroll diameter före acetylkolin och är ombyggt från ett original studie av Lukaszewicz o.a. 64 Klicka här för att se en större version av denna siffra.

Figur 6: Svar till 1 µM acetylkolin i isolerade, kanylerade MCAs Nrf2(- / -) knockout råttor och vildtyp kontroller matas låg salt kost (0,4% NaCl), hög salt kost (4% NaCl), eller hög salt kost som innehåller en känd NRF2 aktivator30, 62. data är uttryckt som genomsnittlig diameter förändring (Δ µm) ±SEM från Vila kontroll diameter före acetylkolin. Klicka här för att se en större version av denna siffra.

Figur 7: Cerebralt blodflöde bedömas av LDF i pial mikrocirkulationen. Sprague-Dawley-råttor som underhålls på en salt kost i fyra veckor uppvisade en signifikant försämring i deras förmåga att upprätthålla blod flöde konstant som arteriella blodtrycket sänktes svar på successiva blod volym uttag. Data är ritade som genomsnittlig procent av kontroll ±SEM * p < 0,05 vs. låg salt kost samtidigt menar artärtryck. Klicka här för att se en större version av denna siffra.
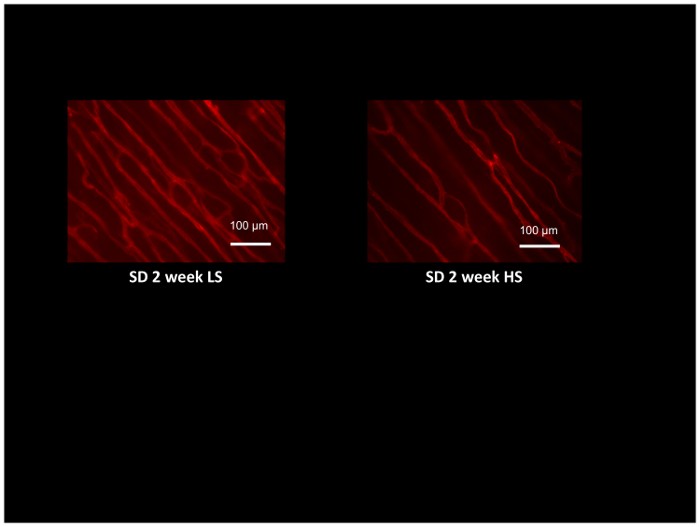
Figur 8: Mikrograf råtta cremaster muskler märkt med rodamin-märkt GS1 lektin att identifiera arterioler och kapillärer för bedömning av microvessel densitet. Cremaster muskler erhölls från Sprague-Dawley-råttor utfodras låg salthalt (LS; 0,4% NaCl) eller hög salt (HS:4% NaCl) kost i 2 veckor och demonstrera mikrovaskulära förtunning i HS matad djur jämfört med LS kontroller. Skalstapeln = 100 µm. vänligen klicka här för att visa en större version av denna siffra.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Som nämnts i inledningen, denna uppsats beskriver användningen av TV-mikroskopi och isolerade motstånd artär närmar sig för att utvärdera vaskulär funktion inte bara i standard råtta modeller (som anställda i videon), men också i högt specialiserade genetiskt bakåtkompilerade råtta stammar, som visar roman och kraftfulla insikter som kan vinnas genom att använda dessa metoder. Användningen av dessa kraftfulla tekniker att utvärdera active tonen och passiv mekaniska egenskaper av litet motstånd artärer kan ge viktig information om ett brett spektrum av vaskulär kontrollmekanismer inklusive endotel-beroende förordning av aktiva tonen i motstånd artärer, vaskulär glatt muskulatur funktion under normala och patofysiologiska förhållanden och passiva egenskaper av artärer relaterade till vaskulär remodeling och förändringar i kärlväggen mekanik. Endoteldysfunktion har visat sig vara en kraftfull prognostiska indikator på flera kardiovaskulära händelser hos människa inklusive kardiovaskulära dödsfall63och kanylerade motstånd artär preparat är särskilt värdefulla i att upptäcka endoteldysfunktion och öka vår förståelse av endoteldysfunktion mekanismer.
För att illustrera effekten av in vitro- video mikroskopi tekniker anställa isolerade motstånd artärer, gett vi exempel på användning av dessa tekniker i Dahl salt känsliga (SS) råttor och i romanen consomic råtta stammar som uppvisar en reducerad av blodtryck jämfört SS föräldrarnas stam24salt känslighet. Dessa studier undersökt vaskulär kontrollmekanismer relaterade till gener på två kromosomer som är av särskilt intresse i att bidra till salt känslighet av blodtryck och vaskulära förändringar i SS råtta. Dessa kromosomer är kromosom 13, bära de renin gen18,22,29,57,58, och kromosom 5, bär gener för isoformer av CYP450-4A ω-hydroxylas64 ,65— det enzym som syntetiserar 20-HETE, som har stora effekter på njurfunktionen och vaskulär reaktivitet66,67,68. En annan nyligen och kraftfullt tillägg till råtta genetiska verktygslådan är utvecklingen av råtta gen knockout modeller utnyttja avancerade gen redigering tekniker inklusive: motvilligt; transkriptionell aktivator-liknande-effektor nukleaser (TALENS), och mest nyligen CRISPR-Cas913,14,15,16,17. In vitro video mikroskopi utnyttja dessa tekniker för att studera isolerade MCAs från en Nrf2(- / -) knockout råtta modell som saknar avgörande antioxidant och cell skyddande transkriptionsfaktor NRF2, har gett viktiga och tidigare okänd insikt om mekanismerna för salt-inducerad endoteldysfunktion i avsaknad av en förhöjd blod tryck17. Specifika resultat av experiment som utnyttjar dessa specialiserade råtta modeller beskrivs i ett antal tidigare rapporter17,29,57,58,59, 60 , 64 , 65 .
Det är uppenbart att studier av isolerade, kanylerade motstånd artärer är oerhört värdefulla för att förstå de mekanismer som reglerar funktionen av dessa kritiskt viktiga fartyg under olika villkor, det är mycket viktigt att utöva en antal försiktighetsåtgärder för att säkerställa att korrekta och tillförlitliga resultat. Medan cerebrala artärer och motstånd artärerna i många andra kärlbäddar uppvisar inneboende tonen, måste vissa artärer (särskilt mesenterica motstånd artärer) vara pre kontrakterade med kärlsammandragande medel såsom noradrenalin för att utvärdera Svaren till vasodilaterande stimuli, och att mer noggrant simulera i vivo villkor, där fartygen är under inflytande av neurala och humorala kärlsammandragande stimuli, såsom noradrenalin frigörs från adrenerga nerv terminaler. Som sådan, det är viktigt att känna till de grundläggande egenskaperna för artärerna till studeras, antingen från litteraturen eller från noggrant genomförda preliminära experiment. Eftersom endotelet spelar en viktig roll i regleringen av stora artärer, små artärer och arterioler i mikrocirkulationen, är det viktigt att iaktta försiktighet för att undvika att skada endotel under isolering och kanylering av artären. Det klassiska testet för endotel integritet är demonstrationen att ACh orsakar dilatation av fartyget. En varning är att under förhållanden av oxidativ stress, fartyget endotelet kan vara intakt, men vasodilatation till ACh är frånvarande eftersom höga halter av superoxid rensa kväveoxid förhindra vasodilaterande svaret. I dessa fall kan endothelial integritet verifieras genom att upprepa programmet ACh i närvaro av en superoxid asätare såsom tempol, som bör återställa vasodilatation svar på ACh och andra endotel-beroende vasodilaterande stimuli. Också, i ett antal sjukdomstillstånd, endotelet kan frigöra ämnen som orsakar sammandragning av vaskulära glatta muskelceller och sammandragning av artär; och i vissa fall endotel-beroende dilatation (eller sammandragning) medieras via andra ämnen såsom cyklooxygenas metaboliter, H2O2, epoxygenase metaboliter, etc. Det klassiska testet för en endotel-beroende vasodilaterande eller kärlsammandragande ämne är att visa att den dilatation eller förträngning av artär elimineras av endothelial borttagning. Slutligen, identitet av olika endotel-beroende vasodilaterande och kärlsammandragande ämnen generellt kan fastställas genom administrering av hämmare eller asätare, såsom L-namn att hämma kväveoxid syntas, indometacin hämma bildandet av cyklooxygenas metaboliter, katalas att rensa H2O2, tromboxan syntas hämmare, epoxygenase hämmare eller antagonister av CYP450-4A/20-HETE-vägen.
Det är också viktigt (och lärorikt) för att kvantifiera mängden aktiva tonen i slutet av experimentet av startas och superfusing artären med en Ca2 +-gratis PSS eller administrera en maximal dos på en kraftfulla vasodilaterande medel såsom papaverin. En typisk nivå av aktiv vila tonen i MCA, beräknas som ((Dmax-Dresten) / dmax) x 100, är cirka 40%, där Dmax och Dresten är maximalt (Ca2 +-gratis PSS) och vilar diameter (PSS), respektive på kontroll Jämviktstiden trycket (oftast 80 mmHg för MCA). Fartyg med väsentligen mindre aktiva tonen eller artärer visar segmentell förträngningar eller utspädningar utesluts från analys, som dessa tecken är tecken på trauma till fartyg. Mätning av diametrarna av maximally dilaterade artärer i Ca2 +-gratis lösning kan också utredaren att utvärdera de passiva mekaniska egenskaperna av fartyg genom att mäta arteriell diameter och beräkning av stress-stam relationer under sekventiell förhöjningar transmural tryck i maximally vidgade fartyg7,56. Dessa passiva stress-stam relationer är lätt erhållas och en värdefull indikation om eventuella ändringar i de mekaniska egenskaperna av fartygen.
Renhet av pipetter, kopplingar och slangar levererar behållarna är helt avgörande för framgångsrika experiment. I detta sammanhang är det viktigt att spola alla lösningar ur slangen efter experimentet har slutförts, och att skölja och rengöra vävnaden bad, leverans slangen och alla reservoarer används för att lagra, varm, och gas-låt jämvikta PSS innan fartyget kammaren. Avstängningskranar och ventiler i leverans systemet bör också rengöras och ändras med jämna mellanrum, som ska alla slangar som transporterar PSS. Ett klassiskt tecken på förorenade slangar är ett grått töcken som genereras av mögel och bakterier; och dessa förändringar åtföljs av förlust av normala reaktivitet i blodkärlen på grund av ämnen som produceras av bakteriell kontaminering. Kontaminering av bakterier och andra mikroorganismer kan dock fortfarande finnas i avsaknad av några synliga bevis.
Vi anser att detta dokument ger ett bra exempel för användning av häfdvunna tekniker som är exceptionellt väl lämpade för studier av alla viktiga litet motstånd artärerna i olika kärlbäddar. När de kombineras med standardmetoder för att utvärdera vävnadsperfusion, såsom LDF och GS1 lektin metoden för att utvärdera microvessel densitet, in vitro- video mikroskopi av kanylerade motstånd artärer ger extremt värdefull insikt i den faktorer som styr vävnadsperfusion och hur dessa kan ändras i sjukdomstillstånd. Förutom att tillhandahålla ett kraftfullt medel för att studera grundläggande mekanismer i vaskulär glatt muskulatur och endotelfunktion i standard råtta modeller, kan användning av video mikroskopi att studera individuella motstånd artärer appliceras till andra djurmodeller och mänskliga motstånd artärer. Tillämpningen av video mikroskopi av isolerade motstånd artärer av romanen genmanipulerade råtta modeller öppnar nya dörrar till förståelse fenotypiska förändringar som sker som svar på förändrad funktion av en mångfald och ständigt växande lista av gener.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Författarna har ingen konkurrerande finansiella intressen.
Acknowledgments
Författarna uttrycker sin uppriktiga tack Katie Fink och Lynn Dondlinger för deras ovärderliga hjälp i utarbetandet av detta manuskript.
Bidragsstöd: NIH #R21-OD018309; #R56-HL065289; och #R01-HL128242.
Materials
| Name | Company | Catalog Number | Comments |
| SS Rat | Medical College of Wisconsin | SS/JHsd/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| SS.5BN Consomic Rat | Medical College of Wisconsin | SS-Chr 5BN/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| SS.13BN Consomic Rat | Medical College of Wisconsin | SS-Chr 13BN/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Ren1-BN Congenic Rat | Medical College of Wisconsin | SS.BN-(D13hmgc41-D13)hmgc23/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Ren1-SSA Congenic Rat | Medical College of Wisconsin | SS.BN-(D13rat77-D13rat105/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Ren1-SSB Congenic Rat | Medical College of Wisconsin | SS.BN-(D13rat124-D13rat101/Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Nrf2(-/-) Knockout Rat and Wild Type Littermates | Medical College of Wisconsin | SD-Nfe212em1Mcwi strain | Contact Dr. Aron Geurts (ageurts@mcw.edu) |
| Low Salt Rat Chow (0.4% NaCl)-AIN-76A | Dyets, Inc. | 113755 | |
| High Salt Rat Chow (4% NaCl)-AIN-76A | Dyets, Inc. | 113756 | |
| Colorado Video Caliper | Colorado Video, Inc. | Model 308 | |
| Video Camera | Hitachi | KPM1AN | |
| Microscope | Olympus Life Science | CKX41 | |
| Television Monitor | Panasonic | WVBM1410 | |
| Pressure Transducers | Stoelting | 56360 | |
| Blood Pressure Display Unit | Stoelting | 50115 | |
| Cannulated Artery Chamber | Living Systems Instrumentation | CH-1 | Single vessel chamber for general use |
| Temperature Controller for Single Chamber | Living Systems Instrumentation | TC-09S | |
| Gas Dispersion Tube, Miniature,Straight | Living Systems Instrumentation | GD-MS | Provides aeration in the vessel bath |
| Gas Exchange Oxygenator, Miniature | Living Systems Instrumentation | OX | Allows gas exchange with perfusate |
| Laser-Doppler Flowmeter | Perimed | PeriFlux 5000 LDPM | |
| GS1 Lectin | Vector Labs | RL-1102 | |
| Glass Capillary Tubes for Micropipettes | Fredrich Haer Co. | 27-33-1 | 2 mm ODX1 mm ID |
| Verticle Pipette Puller | David Kopf Instruments | Model 700C | |
| Nylon suture material (10/0)-3 PLY | Ashaway Line and Twine Manufacturing Co. | 114-ANM-10 | Single strands of 3 ply nylon suture teased out for use on vessels |
| Dumont #5 Forceps-Inox | Fine Science Tools | 11254-20 | |
| Vannas Scissors | Fine Science Tools | 15003-08 | |
| Protandim | Protandim | NRF2 Inducer: Contact Dr. Joe McCord (JOE.MCCORD@UCDENVER.EDU) | |
| Sodium Chloride | Fisher Bioreagents | BP358-212 | |
| Sodium Bicarbonate | Fisher Chemical | S233-3 | |
| Dextrose (d-glucose) anhydrous | Fisher Chemical | D16-500 | |
| Magnesium Sulfate (MgSO4-7H2O) | Sigma Aldrich | M1880-500 G | |
| Calcium Chloride (CaCl2-2 H2O) | Sigma | C5080-500G | |
| Sodium Phosphate-Monobasic (NaH2PO4) | Sigma | S0751-500G | |
| Potassium Chloride (KCl) | Fisher Chemical | P217-500G | |
| Ethylenediaminetetraacetic acid disodium salt dihydrate (EDTA) | Sigma | ED255-500G |
References
- Furchgott, R. F., Zawadzki, J. V. The obligatory role of endothelial cells in the relaxation of arterial smooth muscle by acetylcholine. Nature. 288, 373-376 (1980).
- Bevan, J. A., Osher, J. V. A direct method for recording tension changes in the wall of small blood vessels in vitro. Agents Actions. 2, 257-260 (1972).
- Mulvany, M. J., Halpern, W. Contractile properties of small arterial resistance vessels in spontaneously hypertensive and normotensive rats. Circ. Res. 41, 19-26 (1977).
- Speden, R. N. The use of excised, pressurized blood vessels to study the physiology of vascular smooth muscle. Experientia. 41, 1026-1028 (1985).
- Osol, G., Halpern, W. Myogenic properties of cerebral blood vessels from normotensive and hypertensive rats. Am. J. Physiol. 249, H914-H921 (1985).
- Halpern, W., Kelley, M. In vitro methodology for resistance arteries. Blood Vessels. 28, 245-251 (1991).
- Feihl, F., Liaudet, L., Waeber, B. The macrocirculation and microcirculation of hypertension. Curr Hypertens Rep. 11, 182-189 (2009).
- Smits, G. J., Roman, R. J., Lombard, J. H. Evaluation of laser-Doppler flowmetry as a measure of tissue blood flow. J Appl Physiol. 61, 666-672 (1985).
- Hudetz, A. G., Roman, R. J., Harder, D. R. Spontaneous flow oscillations in the cerebral cortex during acute changes in mean arterial pressure. J Cereb Blood Flow Metab. 12, 491-499 (1992).
- Hudetz, A. G., Smith, J. J., Lee, J. G., Bosnjak, Z. J., Kampine, J. P. Modification of cerebral laser-Doppler flow oscillations by halothane, PCO2, and nitric oxide synthase blockade. Am J Physiol. 269, H114-H120 (1995).
- Hansen-Smith, F. M., Watson, L., Lu, D. Y., Goldstein, I. Griffonia simplicifolia I: fluorescent tracer for microcirculatory vessels in nonperfused thin muscles and sectioned muscle. Microvasc Res. 36, 199-215 (1988).
- Greene, A. S., Lombard, J. H., Cowley, A. W., Hansen-Smith, F. M. Microvessel changes in hypertension measured by Griffonia simplicifolia I lectin. Hypertension. 15, 779-783 (1990).
- Aitman, T., Dhillon, P., Geurts, A. M. A RATional choice for translational research? Dis Model Mech. 9, 1069-1072 (2016).
- Geurts, A. M., et al. Knockout rats via embryo microinjection of zinc-finger nucleases. Science. 325, 433 (2009).
- Geurts, A. M., et al. Generation of gene-specific mutated rats using zinc-finger nucleases. Methods Mol Biol. 597, 211-225 (2010).
- Geurts, A. M., Moreno, C. Zinc-finger nucleases: new strategies to target the rat genome. Clin Sci (Lond). 119, 303-311 (2010).
- Priestley, J. R., Kautenburg, K. E., Casati, M. C., Endres, B. T., Geurts, A. M., Lombard, J. H. The NRF2 knockout rat: a new animal model to study endothelial dysfunction, oxidant stress, and microvascular rarefaction. Am J Physiol Heart Circ Physiol. 310, H478-H487 (2016).
- Cowley, A. W., et al. Brown Norway chromosome 13 confers protection from high salt to consomic Dahl S rat. Hypertension. 37, 456-461 (2001).
- Rapp, J. P. Dahl salt-susceptible and salt-resistant rats. A review. Hypertension. 4, 753-763 (1982).
- Rapp, J. P., Wang, S. M., Dene, H. A genetic polymorphism in the renin gene of Dahl rats cosegregates with blood pressure. Science. 243, 542-544 (1989).
- Manning, R. D. Jr, Meng, S., Tian, N. Renal and vascular oxidative stress and salt-sensitivity of arterial pressure. Acta Physiol Scand. 179, 243-250 (2003).
- Moreno, C., et al. Multiple blood pressure loci on rat chromosome 13 attenuate development of hypertension in the Dahl S hypertensive rat. Physiol Genomics. 31, 228-235 (2007).
- Tobian, L., Lange, J., Iwai, J., Hiller, K., Johnson, M. A., Goossens, P. Prevention with thiazide of NaCl-induced hypertension in Dahl "S" rats. Evidence for a Na-retaining humoral agent in "S" rats. Hypertension. 1, 316-323 (1979).
- Mattson, D. L., et al. Chromosome substitution reveals the genetic basis of Dahl salt-sensitive hypertension and renal disease. Am J Physiol Renal Physiol. 295, F837-F842 (2008).
- Kunert, M. P., et al. Consomic strategies to localize genomic regions related to vascular reactivity in the Dahl salt-sensitive rat. Physiol Genomics. 26, 218-225 (2006).
- Cowley, A. W., Liang, M., Roman, R. J., Greene, A. S., Jacob, H. J. Consomic rat model systems for physiological genomics. Acta Physiol Scand. 181, 585-592 (2004).
- Kunert, M. P., Dwinell, M. R., Lombard, J. H. Vascular responses in aortic rings of a consomic rat panel derived from the Fawn Hooded Hypertensive strain. Physiol Genomics. 42A, 244-258 (2010).
- Liang, M., et al. Renal medullary genes in salt-sensitive hypertension: a chromosomal substitution and cDNA microarray study. Physiol Genomics. 8, 139-149 (2002).
- Durand, M. J., Moreno, C., Greene, A. S., Lombard, J. H. Impaired relaxation of cerebral arteries in the absence of elevated salt intake in normotensive congenic rats carrying the Dahl salt-sensitive renin gene. Am J Physiol Heart Circ Physiol. 299, H1865-H1874 (2010).
- Hybertson, B. M., Gao, B., Bose, S. K., McCord, J. M. Oxidative stress in health and disease: the therapeutic potential of Nrf2 activation. Mol Aspects Med. 32, 234-246 (2011).
- Itoh, K., et al. An Nrf2/small Maf heterodimer mediates the induction of phase II detoxifying enzyme genes through antioxidant response elements. Biochem Biophys Res Commun. 236, 313-322 (1997).
- Myung, S. K., et al. Efficacy of vitamin and antioxidant supplements in prevention of cardiovascular disease: systematic review and meta-analysis of randomised controlled trials. BMJ. 346, f10 (2013).
- Fredricks, K. T., Liu, Y., Lombard, J. H. Response of extraparenchymal resistance arteries of rat skeletal muscle to reduced PO2. Am J Physiol. 267, H706-H715 (1994).
- Fredricks, K. T., Liu, Y., Rusch, N. J., Lombard, J. H. Role of endothelium and arterial K+ channels in mediating hypoxic dilation of middle cerebral arteries. Am J Physiol. 267, H580-H586 (1994).
- Frisbee, J. C., Maier, K. G., Falck, J. R., Roman, R. J., Lombard, J. H. Integration of hypoxic dilation signaling pathways for skeletal muscle resistance arteries. Am J Physiol Regul Integr Comp Physiol. 283, R309-R319 (2002).
- Pavlov, T. S., Ilatovskaya, D. V., Palygin, O., Levchenko, V., Pochynyuk, O., Staruschenko, A. Implementing Patch Clamp and Live Fluorescence Microscopy to Monitor Functional Properties of Freshly Isolated PKD Epithelium. J Vis Exp. (103), (2015).
- Nelson, M. T., Conway, M. A., Knot, H. J., Brayden, J. E. Chloride channel blockers inhibit myogenic tone in rat cerebral arteries. J Physiol. 502 (Pt 2), 259-264 (1997).
- Brayden, J. E., Halpern, W., Brann, L. R. Biochemical and mechanical properties of resistance arteries from normotensive and hypertensive rats. Hypertension. 5, 17-25 (1983).
- Weber, D. S., Lombard, J. H. Elevated salt intake impairs dilation of rat skeletal muscle resistance arteries via ANG II suppression. Am J Physiol Heart Circ Physiol. 278, H500-H506 (2000).
- Weber, D. S., Lombard, J. H. Angiotensin II AT1 receptors preserve vasodilator reactivity in skeletal muscle resistance arteries. Am J Physiol Heart Circ Physiol. 280, H2196-H2202 (2001).
- Wang, J., Roman, R. J., Falck, J. R., de la Cruz, L., Lombard, J. H. Effects of high-salt diet on CYP450-4A omega-hydroxylase expression and active tone in mesenteric resistance arteries. Am J Physiol Heart Circ Physiol. 288, H1557-H1565 (2005).
- Raffai, G., et al. Modulation by cytochrome P450-4A omega-hydroxylase enzymes of adrenergic vasoconstriction and response to reduced PO2 in mesenteric resistance arteries of Dahl salt-sensitive rats. Microcirculation. 17, 525-535 (2010).
- Mishra, R. C., Wulff, H., Hill, M. A., Braun, A. P. Inhibition of Myogenic Tone in Rat Cremaster and Cerebral Arteries by SKA-31, an Activator of Endothelial KCa2.3 and KCa3.1 Channels. J Cardiovasc Pharmacol. 66, 118-127 (2015).
- Freed, J. K., Beyer, A. M., LoGiudice, J. A., Hockenberry, J. C., Gutterman, D. D. Ceramide changes the mediator of flow-induced vasodilation from nitric oxide to hydrogen peroxide in the human microcirculation. Circ Res. 115, 525-532 (2014).
- Beyer, A. M., Durand, M. J., Hockenberry, J., Gamblin, T. C., Phillips, S. A., Gutterman, D. D. An acute rise in intraluminal pressure shifts the mediator of flow-mediated dilation from nitric oxide to hydrogen peroxide in human arterioles. Am J Physiol Heart Circ Physiol. 307, H1587-H1593 (2014).
- Durand, M. J., et al. Vascular actions of angiotensin 1-7 in the human microcirculation: novel role for telomerase. Arterioscler Thromb Vasc Biol. 36, 1254-1262 (2016).
- Beyer, A. M., et al. Transition in the mechanism of flow-mediated dilation with aging and development of coronary artery disease. Basic Res Cardiol. 112, 5 (2017).
- Muller, J. M., Chilian, W. M., Davis, M. J. Integrin signaling transduces shear stress--dependent vasodilation of coronary arterioles. Circ Res. 80, 320-326 (1997).
- Liu, Y., Harder, D. R., Lombard, J. H. Interaction of myogenic mechanisms and hypoxic dilation in rat middle cerebral arteries. Am J Physiol Heart Circ Physiol. 283, H2276-H2281 (2002).
- Potocnik, S. J., et al. Endothelium-dependent vasodilation in myogenically active mouse skeletal muscle arterioles: role of EDH and K+ channels. Microcirculation. 16, 377-390 (2009).
- Harder, D. R. Pressure-dependent membrane depolarization in cat middle cerebral artery. Circ Res. 55, 197-202 (1984).
- Greene, A. S., Rieder, M. J. Measurement of vascular density. Methods Mol. Med. 51, 489-496 (2001).
- Hernandez, I., Cowley, A. W., Lombard, J. H., Greene, A. S. Salt intake and angiotensin II alter microvessel density in the cremaster muscle of normal rats. Am J Physiol. 263, H664-H667 (1992).
- Resende, M. M., Amaral, S. L., Moreno, C., Greene, A. S. Congenic strains reveal the effect of the renin gene on skeletal muscle angiogenesis induced by electrical stimulation. Physiol Genomics. 33, 33-40 (2008).
- Petersen, M. C., Munzenmaier, D. H., Greene, A. S. Angiotensin II infusion restores stimulated angiogenesis in the skeletal muscle of rats on a high-salt diet. Am J Physiol Heart Circ Physiol. 291, H114-H120 (2006).
- Frisbee, J. C., Weber, D. S., Liu, Y., DeBruin, J. A., Lombard, J. H. Altered structure and mechanics of skeletal muscle arteries with high-salt diet and reduced renal mass hypertension. Microvasc Res. 59, 323-328 (2000).
- Drenjancevic-Peric, I., Lombard, J. H. Introgression of chromosome 13 in Dahl salt-sensitive genetic background restores cerebral vascular relaxation. Am J Physiol Heart Circ Physiol. 287, H957-H962 (2004).
- Drenjancevic-Peric, I., Phillips, S. A., Falck, J. R., Lombard, J. H. Restoration of normal vascular relaxation mechanisms in cerebral arteries by chromosomal substitution in consomic SS.13BN rats. Am J Physiol Heart Circ Physiol. 289, H188-H195 (2005).
- Lukaszewicz, K. M., Paudyal, M. P., Falck, J. R., Lombard, J. H. Role of vascular reactive oxygen species in regulating cytochrome P450-4A enzyme expression in Dahl salt-sensitive rats. Microcirculation. 23, 540-548 (2016).
- Lombard, J. H., Sylvester, F. A., Phillips, S. A., Frisbee, J. C. High-salt diet impairs vascular relaxation mechanisms in rat middle cerebral arteries. Am J Physiol Heart Circ Physiol. 284, H1124-H1133 (2003).
- Priestley, J. R., et al. Reduced angiotensin II levels cause generalized vascular dysfunction via oxidant stress in hamster cheek pouch arterioles. Microvasc Res. 89, 134-145 (2013).
- Velmurugan, K., Alam, J., McCord, J. M., Pugazhenthi, S. Synergistic induction of heme oxygenase-1 by the components of the antioxidant supplement Protandim. Free Radic Biol Med. 46, 430-440 (2009).
- Widlansky, M. E., Gokce, N., Keaney, J. F., Vita, J. A. The clinical implications of endothelial dysfunction. J Am Coll Cardiol. 42, 1149-1160 (2003).
- Lukaszewicz, K. M., Falck, J. R., Manthati, V. L., Lombard, J. H. Introgression of Brown Norway CYP4A genes on to the Dahl salt-sensitive background restores vascular function in SS-5BN consomic rats. Clin Sci (Lond). 124, 333-342 (2013).
- Lukaszewicz, K. M., Lombard, J. H. Role of the CYP4A/20-HETE pathway in vascular dysfunction of the Dahl salt-sensitive rat. Clin Sci (Lond). 124, 695-700 (2013).
- Roman, R. J. P-450 metabolites of arachidonic acid in the control of cardiovascular function. Physiol Rev. 82, 131-185 (2002).
- Roman, R. J., Maier, K. G., Sun, C. W., Harder, D. R., Alonso-Galicia, M. Renal and cardiovascular actions of 20-hydroxyeicosatetraenoic acid and epoxyeicosatrienoic acids. Clin Exp Pharmacol. 27, 855-865 (2000).
- Roman, R. J., Alonso-Galicia, M. P-450 eicosanoids: A novel signaling pathway regulating renal function. News Physiol Sci. 14, 238-242 (1999).



