Overview
Source : Laboratoire de Jeff Sanoussi - University of Massachusetts Amherst
La distribution d’un groupe de biomarqueurs organiques appelée glycérol-dialkyl glycérol-tetraethers (GDGTs), produit par une suite d’archaea et bactéries, ont été trouvés dans des sédiments modernes à changer d’une manière prévisible en réponse à l’air ou l’eau température1,2. Par conséquent, la distribution de ces biomarqueurs dans une séquence de sédiments d’âge connu peut servir à reconstituer l’évolution de la température de l’air et/ou l’eau sur des échelles de temps décennales au millénaire (Figure 1). La production d’enregistrements de temps à haute résolution des climats passés, appelés paléoclimatologie, dépend de l’analyse rapide des centaines, peut-être des milliers d’échantillons. Des techniques d’extraction plus âgés, comme la sonication ou Soxhlet, sont trop lents. Cependant, la technique de Accelerated Solvent Extraction plus récente a été conçue avec efficacité à l’esprit.
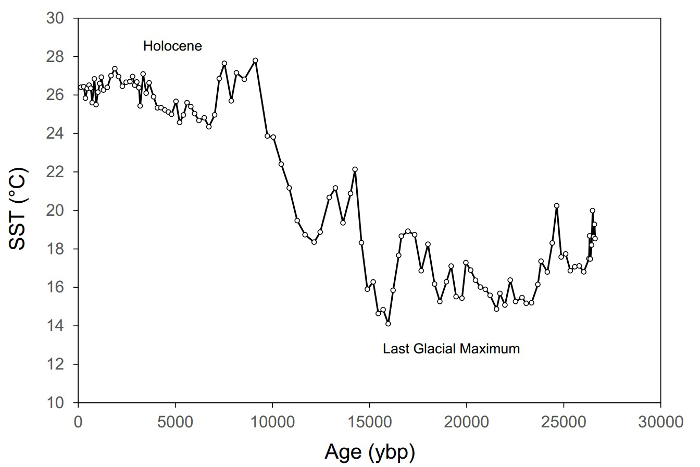
Figure 1. Un exemple d’enregistrement paléoclimat indiquant des changements dans la température de surface de mer (SST) dans l’est de la mer Méditerranée au cours des dernières années ~ 27 0003. Ce disque comprend ~ 115 échantillons et repose sur l’isoprenoidal proxy86 SST GDGT basé sur TEX.
Principles
Extraction par solvant accélérée est une méthode de (Thermo Scientific Dionex) essaiera d’extraction qui utilise des températures élevées (~ 100 ° C) et pression (~ 1 200 lb/po2) pour augmenter la cinétique des procédés d’extraction. L’extracteur, appelé Accelerated Solvent Extractor, ou ASE (Figure 2), peut contenir jusqu'à 24 échantillons individuels. Une fois que l’ASE est chargé et configuré pour s’exécuter, il est entièrement automatisé. L’ASE permet la maîtrise du processus complet d’extraction électronique : température d’extraction, pression, volume de solvant, mélange de solvants, durée, rinçage et répétition sont tous réglables d’un échantillon à l’autre. Plus bio géochimie laboratoires utilisent maintenant l’ASE comme la méthode standard d’extraction par solvant.

La figure 2. Un extracteur accéléré de solvant (ASE).
Extraction par solvant accélérée est une technique rapide, efficace et haut débit utilisée pour séparer les biomarqueurs organiques par un grand nombre d’échantillons de sédiments géologiques.
Traditionnellement, les méthodes d’extraction comme la sonication ou Soxhlet sont utilisées, cependant, l’inconvénient de ces protocoles est qu’ils sont trop lents pour traiter assez de matériel pour la reconstruction paléoclimatique détaillée. Une technique plus récente, l’Accelerated Solvent Extraction ou méthode de l’ASE, a été développé avec efficacité et un débit élevé à l’esprit.
La méthode de l’ASE utilise une combinaison de haute température et haute pression pour extraire des échantillons et peut réaliser des échantillons multiples en un seul, relativement rapide préparation course.
Cette vidéo est le troisième d’une série décrivant comment extraire des biomarqueurs de sédiments. Il couvrira la procédure et donnent un aperçu des mérites de l’ASE sur sonication ou extraction Soxhlet.
En extraction accélérée par solvant, les échantillons sont chargés dans des cellules en acier qui sont ensuite chargées sur un carrousel. Flacons de collecte pour chaque cellule de l’échantillon sont également chargés sur un carrousel séparé. L’instrument charge une cellule de l’échantillon dans un four interne. Solvant est pompée d’une bouteille de solvant à travers une série de vannes jusqu'à atteindre une pression suffisante.
Cette pression est maintenue pendant un laps de temps dictées par l’échantillon et l’analyte. Ensuite, le solvant est vidé de la cellule par une conduite en acier dans le flacon de collection correspondant. Le processus peut être répété plusieurs fois. La température, la pression et la durée peuvent être personnalisés pour l’échantillon.
La température élevée utilisée pour augmenter la cinétique de l’extraction haute pression empêche les solvants volatils. Le flacon contient à présent un extrait lipidique total, et ce qui reste dans la cellule est appelée un résidu. Il est composé de matériaux non organiques ainsi que des matières organiques qui ne sont pas extractible à solvant, appelé kérogène.
Maintenant que nous sommes familiers avec les principes qui sous-tendent l’extraction accélérée par solvant, examinons un comment cela s’effectue en laboratoire.
Après le prélèvement d’échantillons d’intérêt ; Freeze-Dry, homogénéiser et décontaminer tel que démontré dans une autre vidéo de cette série.
Une fois que tous les échantillons ont été préparés, assembler une cellule pour chacun d’eux à extraire et un supplémentaire pour un essai à blanc. Pour ce faire, vissez un embout sur le corps de la cellule. Pince à épiler préalablement rincé solvant, placer un filtre en fibre de verre brûlé sur le dessus de chacun d’eux. Lentement et doucement appuyer le filtre avec le piston.
Étiqueter les corps cellulaires en nombre pour chaque échantillon et l’étiquette de l’essai à blanc séparément. Placez une tible pesant étain sur une échelle de laboratoire et de la tare. Rincer une spatule avec un solvant, puis utilisez-la pour transférer 5 à 10 g d’échantillon à l’étain pesage et enregistrer la masse.
Transférer tout le matériel dans l’étain pesage à sa cellule correspondante. Placer un autre filtre en fibre de verre sur le dessus et tassez doucement jusqu'à ce qu’il atteigne le haut de l’échantillon.
Ajouter un dispersant, tels que la terre de diatomées ou du sable, jusqu'à ce qu’il est presque plein, en prenant soin d’éviter les débris dans le filetage du corps cellulaire. Chapeau haut de la cellule avec un autre embout. Répétez ces étapes pour chaque échantillon et le blanc.
L’étiquette de chaque flacon de collection avec le nombre de cellule ou vide correspondant et couvrez-les avec un bouchon de flacon. Placer chaque cellule dans une fente numérotée sur le plateau supérieur en ASE. Définir les paramètres de la méthode d’extraction en utilisant le clavier sur l’ASE pour extraire à 100 ° C et 1 200 lb/po2. Extraire chaque échantillon 3 fois avec une prise statique de 10 min, puis rincez le corps cellulaire avec 50 % de son volume total entre statiques cales.
Ensuite, assurez-vous que la bouteille de solvant contienne assez pour extraire tous les échantillons. Rincer les lignes instrument 3 fois avant de commencer la course. Enfin, appuyez sur start.
Retirer la cuvette de l’ASE. Maintenant que les biomarqueurs ont été extraits, ils doivent être purifiés avant l’analyse.
Extraction par solvant accéléré est une technique polyvalente, qui peut être utilisée pour une variété d’applications, dont certaines sont abordés ici.
Extraction par solvant accélérée permet également sur d’autres types d’échantillon, y compris la nourriture. Analyse des résidus pour tester la contamination par les pesticides est souvent effectuée dans des installations réglementaires et industrielles pour vérifier l’innocuité et la qualité des produits alimentaires comme les fruits ou les légumes. ASE peut être utilisé pour extraire des pesticides organochlorés d’échantillons d’aliments et déterminer les types ou les niveaux de résidus présents dans les produits. Cette information peut alors servir à établir si le produit est apte à la consommation humaine ou animale. Par exemple, dieldrine devrait se situe au 0 à 0,1 partie par million sur produits alimentaires, selon le produit.
Alimentation des composants nutritionnels peuvent également être extraits à l’aide d’ASE. Par exemple, des produits comme le chocolat, qui peut avoir la haute teneur en matières grasses gravimétrique, peuvent être extraites. À l’aide d’ASE à l’éther de pétrole comme solvant, graisse peut être séparée des échantillons de chocolat et soumise à une analyse quantitative pour déterminer une pourcentage précis de teneur en matières grasses par une quantité connue de chocolat. En utilisant cette information, les organismes de réglementation peuvent vérifier les réclamations faites par les fabricants de chocolat, ou fabricants peuvent obtenir des informations pour créer les étiquettes des aliments précis.
Vous avez juste regardé introduction de Jupiter à l’extraction de biomarqueurs de lipides à l’aide d’extraction accélérée par solvant ou ASE. On trouvera des méthodes d’analyse et de traitement ultérieur dans les vidéos suivantes.
Merci de regarder !
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. collecte des matériaux nécessaires
- Extraire des échantillons. Échantillons (dans ce cas, sédiments) sont gelés, lyophilisés, écrasés et homogénéisés avant l’extraction et extraite en groupes afin de maximiser l’efficacité.
- Selon la taille de l’échantillon, utiliser les flacons de collection avec des volumes de 40 ou 60 mL. Pour cette expérience, les flacons en verre de borosilicate (40 mL) et solvants sécuritaires casquettes sont utilisés. Brûler les flacons, pipettes en verre borosilicate et pesage tins à 550 ° C pendant 6 h avant afin d’assurer l’élimination des contaminants organiques possibles.
- Méthanol et le dichlorométhane (DCM) sont courantes dans les laboratoires de géochimie organiques plus. Les utiliser individuellement, (méthanol suivie tout d’abord, DCM) pour rincer les outils de laboratoire et de la verrerie avant utilisation. Un mélange de dichlorométhane au méthanol (MeOH ; 9:1) est utilisé dans nombreux laboratoires d’extraire efficacement des biomarqueurs avec un large éventail de polarités. Solvants doivent être exempts de contaminants organiques.
- Obtenir un extracteur de solvant accéléré à utiliser pour cette expérience.
2. préparation des cellules de l’échantillon
- Monter une cellule de l’échantillon pour chaque échantillon à extraire, ainsi qu’un essai à blanc.
- Pour chaque cellule, vissez un embout à une extrémité du corps cellulaire.
- Placer un filtre en fibre de verre brûlé sur le dessus de chaque cellule à l’aide de la pince à épiler préalablement rincé solvant. Puis, lentement et doucement enfoncez le filtre dans la cellule à l’aide du plongeur de filtre.
- Étiqueter les corps cellulaires de nombre (par exemple 1-22) pour chaque échantillon et écrire « en blanc » sur la cellule vide.
- Remplir le vide avec la terre de diatomées (ou sable) et couvrez-les avec un deuxième embout. Serrer à la main.
3. préparation des échantillons
- Placez une tible pesant étain sur l’échelle du laboratoire, puis tare.
- Rincer la spatule de laboratoire avec le solvant, puis utilisez-la pour transférer une masse appropriée de l’échantillon dans l’étain pesage et enregistrer la masse.
- La masse de l’échantillon varie en fonction de sa teneur en matière organique. Matière organique relativement maigre matériel (boue marine) peut exiger plusieurs grammes, tandis que la matière organique riche matériel (tissus foliaires) peut-être nécessiter beaucoup moins.
- Transférer la totalité du matériel dans l’étain pesage dans une cellule préparée de l’ASE.
- Placez un autre filtre en fibre de verre sur le dessus de la cellule, puis lentement et doucement appuyer jusqu'à ce qu’il atteigne la partie supérieure de l’échantillon à l’aide du piston filtre.
- Ajouter de la terre de diatomées (ou sable) à la cellule jusqu'à ce qu’il est presque plein. Veillez à éliminer tous les débris des filetages corps cellulaire.
- Chapeau haut de la cellule avec un autre embout.
- Répétez les étapes 3,1 à 3,6 pour chaque échantillon.
4. préparation des flacons de Collection
- Étiquetez chaque flacon avec le numéro d’une cellule correspondante (par exemple 1-22 ou en blanc) et le cap avec bouchon de flacon de collection ASE.
5. extraction
- Placez chaque cellule dans une fente numérotée sur le plateau supérieur en ASE.
- Placer le flacon de collection correspondant dans le même emplacement de numéro sur le plateau inférieur de l’ASE.
- Créez la méthode d’extraction en utilisant le clavier sur l’ASE. Extrait à 100 ° C et 1 200 lb/po2. Extrait de chaque échantillon x 3 avec une prise statique de 10 min et rincer le corps cellulaire avec 50 % de son volume total entre statiques cales.
- Assurez-vous que la bouteille de solvant contient suffisamment solvant pour extraire tous les échantillons.
- Rincer l’ASE 3 x avant de commencer la course en appuyant sur la touche « rinçage » sur le pavé directionnel à ASE.
- Appuyez sur start.
Subscription Required. Please recommend JoVE to your librarian.
Results
À la fin de l’extraction, il y a un extrait de lipides totaux (TLE) pour chaque échantillon. Chaque flacon contient maintenant la matière organique extractible de sédiment, sol ou des tissus végétaux. Ces DFIT peut être analysés et leurs constituants chimiques identifiés et quantifiés.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Le DFIT des échantillons extraits contiennent un large éventail de différents composés organiques, y compris les GDGTs qui serviront à reconstruire les températures antiques. Glycérol-dialkyl glycérol-tetraethers sont une grande suite de biomarqueurs qui montrent la sensibilité aux températures de croissance. Il y a deux groupes de GDGTs, ramifiés et isoprénoïdes, qui se distinguent par le caractère des patrons des ramification sur les groupes alkyles de base ()Figure 3). Dans l’océan, un groupe cosmopolite d’archaea, appelé Thaumarchaeota, produire isoprenoidal GDGTs4. GDGTs ramifiés sont produites sur terre dans les sols5, lacs et en sédiments de lac6 par des bactéries non encore identifiés, probablement Acidobacteria7. Les archaea et bactéries ajuster le nombre de branches de méthyle et de structures en anneau dans le groupe alkyle de base selon la température de croissance, et parce que les GDGTs sont stables dans les sédiments pendant des millions d’années, enregistrements longue haute résolution du changement climatique sont générés à l’aide de leur.
Le proxy de température de l’eau de TEX86 paléo est basé sur le rapport de certain isoprenoidal GDGTs, chacun contenant des atomes de carbone 86 dans son noyau d’alkyle (Figure 3) :
TEX86 = (GDGT-2 + GDGT-3 + GDGT-4') /
(GDGT-1 + 2-GDGT + GDGT-3 + GDGT-4')
Température de l’eau de paléo est ensuite déduite à l’aide d’un étalonnage, comme l’équation originelle :
TEX86 = 0.015T + 0,28 (R2 = 0,92)
Proposé par Schouten et al. 1, où T est paléotempérature. Plusieurs autres étalonnages régionales et locales ont été développés pour affiner le proxy à utiliser dans les grands lacs ou dans les régions tropicales, par exemple.

Figure 3. Structures chimiques des isoprenoidal et ramifiés GDGTs. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Subscription Required. Please recommend JoVE to your librarian.
References
- Schouten, S. et al. Distributional variations in marine crenarchaeotal membrane lipids: a new tool for reconstructing ancient sea water temperatures?, Earth and Planetary Science Letters, 204(1-2), 265-274 (2002).
- Weijers, J. W. H. et al. Environmental controls on bacterial tetraether membrane lipid distribution in soils, Geochimica et Cosmochimica Acta, 71(3), 703-713 (2007).
- Castaneda, I. S. et al. Millennial-scale sea surface temperature changes in the eastern Mediterranean (Nile River Delta region) over the last 27,000 years, Paleoceanography, 25, 13 (2010).
- Damste, J. S. S. et al. Crenarchaeol: the characteristic core glycerol dibiphytanyl glycerol tetraether membrane lipid of cosmopolitan pelagic crenarchaeota, J Lipid Res, 43(10), 1641-1651 (2002).
- Hopmans, E. C. et al. A novel proxy for terrestrial organic matter in sediments based on branched and isoprenoid tetraether lipids, Earth and Planetary Science Letters, 224(1-2), 107-116 (2004).
- Tierney, J. E., Russell J. M. Distributions of branched GDGTs in a tropical lake system: Implications for lacustrine application of the MBT/CBT paleoproxy, Organic Geochemistry, 40(9), 1032-1036 (2009).
- Damste, J. S. S. et al. 13,16-Dimethyl Octacosanedioic Acid (iso-Diabolic Acid), a Common Membrane-Spanning Lipid of Acidobacteria Subdivisions 1 and 3, Appl Environ Microb, 77(12), 4147-4154 (2011).




