Overview
Quelle: Tamara M. Powers, Department of Chemistry, Texas A & M Universität
Während die meisten organischen Moleküle diamagnetisch sind, Staaten wobei alles, was ihre Elektronen in Anleihen, viele Übergang Metall komplexe gepaart sind paramagnetisch, sind die Erden hat mit ungepaarten Elektronen. Rückrufaktion Hund'sche Regel, die besagt, dass für orbitale ähnliche Energien, Elektronen die orbitale maximiert die Zahl der ungepaarten Elektronen vor pairing füllen werden. Übergangsmetalle haben teilweise aufgefüllt d-orbitale, dessen Energien sind in unterschiedlichem Ausmaß durch Koordinierung der Liganden an das Metall gestört. So, die d-orbitale sind in Energie einander ähnlich, jedoch nicht alle entartet. Dies ermöglicht eine komplexe diamagnetisch, mit alle Elektronen gepaart oder paramagnetisch mit ungepaarten Elektronen.
Zu wissen, die Zahl der ungepaarten Elektronen in einem Metall komplexe kann Hinweise geben in der Oxidationsstufe und der Geometrie des Metalls komplexe sowie in die Liganden (Kristallfeld) Feldstärke der Liganden. Diese Eigenschaften einen enormen Einfluss auf die Spektroskopie und Reaktivität der Übergang Metall komplexe und sind also wichtig, zu verstehen.
Eine Möglichkeit, die Anzahl der ungepaarten Elektronen wird zur Messung der magnetischen Suszeptibilität χ, der Koordinierung Verbindung. Magnetische Suszeptibilität ist das Maß der Magnetisierung der ein Material (oder Verbindung), wenn in einem angelegten Magnetfeldes platziert. Gepaarte Elektronen sind leicht durch einen angelegten Magnetfeldes abgestoßen, und diese Abstoßung steigt linear als die Stärke des Magnetfeldes erhöht. Auf der anderen Seite ungepaarte Elektronen sind ein Magnetfeld (in größerem Umfang) angezogen, und die Attraktivität steigt linear mit der magnetischen Feldstärke. Daher wird eine Verbindung mit ungepaarten Elektronen ein Magnetfeld angezogen werden. 1
Wenn wir der magnetischen Suszeptibilität messen, erhalten wir Informationen über die Zahl der ungepaarten Elektronen aus das magnetische Moment μ. Die magnetische Suszeptibilität bezieht sich auf das magnetische Moment μ von Gleichung 12:
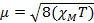 (1)
(1)
Die Konstante 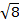 = [(3kB) / Nβ2)], wo β = Bohr Magneton des Elektrons (0,93 X 10-20 Erg Gauß-1), N = Avogadro's Zahl und kB = Boltzmann-Konstante
= [(3kB) / Nβ2)], wo β = Bohr Magneton des Elektrons (0,93 X 10-20 Erg Gauß-1), N = Avogadro's Zahl und kB = Boltzmann-Konstante
XM = molare magnetische Suszeptibilität (cm3/mol)
T = Temperatur (K)
µ = magnetisches Moment, gemessen in Einheiten von Bohr Magneton, µB = 9,27 x 10-24 JT-1
Das magnetische Moment für komplexe ist gegeben durch die Gleichung 21:
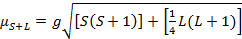 (2)
(2)
g = Gyromagnetic Verhältnis = 2.00023 µB
S = Spin-Quantenzahl = ∑ms = [Anzahl der ungepaarten Elektronen, n] / 2
L = orbital Quantenzahl = ∑ml
Diese Gleichung hat Orbital und Spin Beiträge. Für die erste Zeile Übergang Metall komplexe, die orbitale Beitrag ist klein und daher kann weggelassen werden, damit das Drehen nur magnetische Moment gegeben ist Gleichung 3:
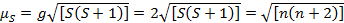 (3)
(3)
Das Spin-nur magnetische Moment kann somit direkt die Zahl der ungepaarten Elektronen geben. Diese Annäherung kann auch für schwerere Metalle erfolgen, obwohl orbital Beiträge für zweite und dritte Reihe Übergangsmetallen wichtig sein könnten. Dieser Beitrag kann so bedeutend, dass es das magnetische Moment genug, das die Verbindung mehr Elektronen ungepaarten haben bläst scheint, als dies der Fall ist. Daher möglicherweise zusätzliche Charakterisierung für diese komplexe erforderlich.
In diesem Experiment wird die Lösung magnetisches Moment des tris(acetylacetonato)iron(III) (Fe(acac)3) bestimmt experimentell mit Evans Methode in Chloroform.
Principles
Es gibt viele Methoden zur Messung der magnetischen Suszeptibilität. Imspäten 19 Jahrhundert entwickelte Louis Georges Gouy Gouy Gleichgewicht, das ist eine sehr präzise Methode zur Messung der magnetischen Suszeptibilität. Bei diesem Ansatz wird eine analytische Waage verwendet, um Masse ein Magnet und die Veränderung der Masse beobachtet durch das Platzieren einer paramagnetischen Probe zwischen den Polen des Magneten ist im Zusammenhang mit der magnetischen Suszeptibilität. Diese Methode ist nicht praktisch, da Aussetzung der Probe zwischen den Polen des Magneten nicht trivial ist. Dies erfordert vier Messungen der Masse zwischen dem Magneten bewegen kann, und für Luft-empfindliche Proben, diese Messung muss innerhalb einer Glovebox durchgeführt werden. Moderne magnetische Suszeptibilität Salden sind verfügbar, aber dies erfordert den Kauf von solch ein Gleichgewicht.
Eine andere Methode ist, ein Magnetometer Tintenfisch (Superconducting Quantum Störung Gerät) zu verwenden. Dies erfordert mehrere mg festen Probe und es sei denn, andere magnetischen Messungen auf der Probe erfolgen ist nicht praktisch oder kostengünstige für paramagnetische komplexe, die in Lösungen gebildet werden können.
Schließlich, und was hier gezeigt werden, ist die Verwendung eines NMR-Spektrometers zur Messung der magnetischen Suszeptibilität. Dieser Ansatz wurde von Dennis Evans im Jahr 1959 entwickelt. Es ist einfach und stützt sich auf die Wirkung, die ein Paramagnet in Lösung auf die chemische Verschiebung einer Referenz-Verbindung, in der Regel das Lösungsmittel hat. Erhebung von Daten auf alle NMR-Spektrometer durchgeführt werden kann, die Daten sind einfach zu interpretieren und Probenvorbereitung ist einfach und erfordert wenig Material. Es ist die standard-Methode zum Abrufen von Daten der magnetischen Suszeptibilität für anorganische komplexe geworden.
Die Messung der magnetischen Suszeptibilität von der Evans-Methode beruht auf der Tatsache, dass ungepaarten Elektronen aus dem Paramagnet in Lösung zu einer Änderung der chemischen Verschiebung aller Arten in Lösung (Abbildung 1 führt). So, mit der Feststellung des chemischen Verschiebung Unterschied eines Lösungsmittels Moleküls in an- und Abwesenheit einer paramagnetischen Spezies, die magnetische Suszeptibilität über Gleichung 4 (für ein Hochfeld-NMR-Spektrometer)3 erhalten Sie
 (4)
(4)
Δf = Frequenzdifferenz zwischen dem verschobenen Resonanz und die reinen Lösungsmittel Resonanz in Hz
F = Spektrometer Radiofrequenz in Hz
c = Konzentration der paramagnetischen Arten (Mol/mL)
Daten ergibt sich ohne weiteres durch das Sammeln von einer 1H-NMR-Spektrum einer Probe, die eine Kapillare von reinen Lösungsmittel mit einer Lösung aus der Paramagnet rund um die Kapillare innerhalb der NMR-Röhrchen (Abbildung 2) enthält.

Abbildung 1. Beispiel 1H-NMR-Spektrum des Experiments

Abbildung 2. Bild einer Kapillare im NMR-Röhrchen-setup
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. Vorbereitung der Kapillare einfügen
- Verwenden eine leichtere oder andere Gasflamme, Schmelzen Sie die Spitze des langen Pasteurpipette. Drehen Sie sanft die Pipettenspitze in der Flamme, bis eine kleine Birne Formen. Lassen Sie das Glas abkühlen lassen.
- In einer Durchstechflasche funkeln bereiten die 50: 1 (Volumen) Lösung von deuterierter: Proteo Chloroform. Pipette 2 mL deuterierte Lösungsmittel und dazu fügen 40 µL Proteo Lösungsmittel. Verschließen Sie das Fläschchen.
- Fügen Sie ein paar Tropfen des Lösungsmittelgemisches sorgfältig verschlossenen Glaspipette hinzu. Streichen Sie sanft versiegelten Pipettenspitze, so dass die Flüssigkeit in der Kapillare gelangt. Wiederholen Sie, bis die Lösung eine Tiefe von hat ~ 2 Zoll vom Boden der Kapillare. Stellen Sie sicher, dass keine Luftblasen gibt.
- Verschließen Sie die Pipette mit einem 14/20 Gummiseptum. Mit einer 3-mL-Spritze begrenzt mit einer Nadel, stechen Sie die Nadel in die Pipette und 3 mL Luft herausziehen. Dadurch entsteht einen Unterdruck, den nächsten Schritt zu erleichtern.
- Die Spitze der Kapillare zu versiegeln. Horizontal spannen Sie die Pipette zu einem Ring Stand. Verwenden Sie ein Feuerzeug, um das Glas über der Lösung im unteren Teil der Pipette zu erweichen. Sobald das Glas erweicht, beginnen Sie, drehen Sie die Spitze der Pipette und ziehen die Pipettenspitze von der eingespannten Basis. Lassen Sie die versiegelte Kapillare abkühlen.
2. Vorbereitung des paramagnetischen Lösung
- Mit Hilfe einer Analysenwaage, Masse ein Funkeln-Fläschchen und Deckel. Beachten Sie die Masse.
- Masse ca. 5-10 mg der Fe(acac)3 in der Durchstechflasche funkeln aus, und beachten Sie die Masse. Fe(ACAC)-3 hat einen sehr hohe Lösung magnetisches Moment. Daher wird 5 bis 10 mg eine große Änderung der chemischen Verschiebung generieren. In der Regel ist 10-15 mg eine geeignetere Masse für Evans Methode Proben verwenden.
- Pipette ~ 600 µL bereit Lösungsmittelgemisches in das Fläschchen mit der paramagnetischen Arten. Verschließen Sie das Fläschchen, und beachten Sie die Masse. Stellen Sie sicher, dass die solide vollständig auflöst.
3. Vorbereitung der NMR-Probe
- Ein standard NMR-Röhrchen sorgfältig Rückgang der Kapillare einfügen in einem Winkel, um sicherzustellen, dass es nicht bricht.
- Pipette in die Lösung mit der paramagnetischen Arten.
- Röhrchen Sie die NMR. Für luftempfindlichen Proben Parafilm Umwickeln der GAP.
(4) die Datenerhebung
- Erwerben Sie und speichern Sie eine standard- 1H-NMR-Spektrum.
- Beachten Sie die Temperatur der Sonde.
- Beachten Sie die Radiofrequenz.
5. Analyse und Ergebnisse
- Mit der Masse und Dichte des Lösungsmittels, berechnen Sie das Volumen des Lösungsmittels benutzt, um die paramagnetischen Lösung vorzubereiten.
- Berechnen Sie die Konzentration (M) der paramagnetischen Lösung.
- Berechnen Sie die Spitze Trennung der Lösungsmittel Resonanz zwischen der reinen Lösungsmittel (in der Kapillare) und durch die Paramagnet (außerhalb von der Kapillare) verschoben (Δppm). Geschieht dies in ppm, wandelt es in Hz von Gleichung 5:
 (5)
(5)
F = Spektrometer Radiofrequenz in Hz - Berechnen Sie die magnetische Suszeptibilität mit Gleichung 4.
- Das magnetische Moment mit Gleichung 1zu berechnen.
- Vergleichen Sie das magnetische Moment mit erhalten, die für n ungepaarte Elektronen aus Gleichung 3vorhergesagt. Die magnetische Suszeptibilität werden geringfügig größer als der erwartete nur-Spin-Wert in der Tabelle angegeben, aber sollte geringer sein als die n + 1 ungepaarte Elektronen entspricht.
- Geben Sie die Zahl der ungepaarten Elektronen für die paramagnetischen Arten.
6. Fehlersuche
- Wenn zwei gut aufgelöst Lösungsmittel Gipfel nicht eingehalten werden, versuchen Sie Folgendes:
- Verwenden Sie ein Spektrometer mit eine größere Feldstärke, um die chemische Verschiebung Unterschied (in ppm) von den beiden Gipfeln zu erhöhen.
- Machen Sie die Probe konzentrierter, so dass die Schicht größer.
- Manchmal ist der Wert nicht sinnvoll. Wenn ein Wert zu niedrig gewonnen wird, versuchen Sie Folgendes:
- Wiederholen Sie, größere Sorgfalt in massing, die Lösungsmittel und paramagnetischen Arten.
- Stellen Sie sicher, dass die paramagnetischen Tierspezies rein ist. Auch Lösungsmittel Verunreinigungen in den Kristallen wirkt sich die Masse und damit Konzentration.
- Für große Moleküle kann die Diamagnetism so bedeutsam sein, dass eine diamagnetische Korrektur vorgenommen werden muss. Dieser Begriff wird subtrahiert Gleichung 4:

- Manchmal ist der Wert nicht sinnvoll. Wenn ein zu hoher Wert erreicht wird, versuchen Sie Folgendes:
- Folgen Sie die gleichen Schritten wie 6.2.1-6.2.3.
- Für schwerere Metalle kann die Aufnahme von orbital Beiträge notwendig sein.
7. Luft-empfindliche Proben
- Luftempfindlichen Proben können ohne weiteres mit dieser Methode analysiert werden. Schritte 1.2-1.4, Schritt 2 und Schritt 3 werden einfach in einem Handschuhfach durchgeführt.
Die Evans-Methode ist ein Verfahren zur Berechnung der Anzahl der ungepaarten Elektronen in Lösung-Staat Metallkomplexe.
Viele Übergang Metall komplexe haben Elektronen, so dass sie gegenüber Magnetfeldern angezogen ungepaarte. Diese komplexe sind paramagnetisch bezeichnet. Komplexe mit allen gepaarten Elektronen sind diamagnetisch bezeichnet.
Die Zahl der ungepaarten Elektronen wissen ist wichtig für die Vorhersage der Reaktivität eines Stoffes. Die Evans-Methode verwendet NMR-Spektroskopie zur Messung der Parameter erforderlich, um die Zahl der ungepaarten Elektronen zu berechnen.
Dieses Video wird veranschaulichen das Verfahren zur Durchführung des Verfahrens Evans, demonstrieren die Analyse der Fe(acac)3und stellen ein paar Anwendungen zählen ungepaarte Elektronen in der Chemie.
Die Zahl der ungepaarten Elektronen in einer Anlage kann aus das magnetische Moment des gegebenen Moleküls bestimmt werden. Die magnetischen Momente der 1St Reihe Übergang Metall komplexe kann aus den Beiträgen der ungepaarten Elektronen, genannt das Spin nur magnetische Moment angenähert werden. Für die 2Nd und 3rd Zeile Übergang Metall komplexe müssen den Spin und die orbitale Beiträge berücksichtigt werden.
Das magnetische Moment bezieht sich auf die magnetische Suszeptibilität stellt den Grad der Magnetisierung eines Komplexes in einem angelegten Magnetfeldes.
Die chemische Verschiebung einer Spezies in einem NMR-Spektrum wird durch die insgesamt magnetische Suszeptibilität der Beispiellösung beeinflusst. So die chemischen Verschiebung der Lösungsmittel ändert sich, wenn der gelöste Stoff paramagnetisch ist.
Ein Evans Methode Beispiel verwendet eine Kapillare einfügen, die eine Mischung aus einem deuterierte Lösungsmittel und das passende Proteated Lösungsmittel enthalten. Die Verbindung von Interesse ist in der gleichen Lösungsmittelgemisches aufgelöst und in ein NMR-Röhrchen mit der Kapillare.
Die erworbenen NMR-Spektrum zeigt zwei Lösungsmittel Gipfel: ein Proteated Lösungsmittel in Lösung mit der Verbindung entspricht, und die andere entsprechend des Proteated Lösungsmittels in der Kapillare.
Die magnetische Suszeptibilität errechnet sich aus der Frequenzdifferenz und die Konzentration der paramagnetische Substanz in der Probe.
Das magnetische Moment errechnet sich aus der magnetischen Suszeptibilität in einer Spezialeinheit namens Bohr Magneton. Das magnetische Moment kann dann mit theoretischen Spin nur Werte zu schätzen, die Zahl der ungepaarten Elektronen in der Probe verglichen werden.
Nun, da Sie die Prinzipien der Evans-Methode zu verstehen, gehen Sie wir durch ein Verfahren für die Suche nach der Anzahl der ungepaarten Elektronen in Fe(acac)3 mit der Methode von Evans.
Um die Kapillare Einsatz vorzubereiten, Schmelzen Sie die Spitze einer langen Pasteurpipette mit einer Flamme bis die Spitze in einem Glaskolben schmilzt. Lassen Sie das Glas abkühlen lassen.
Als nächstes verbinden Sie in eine saubere funkeln Ampulle 2 mL deuterierte Lösungsmittel und 40 μL Proteated Lösungsmittel. Verschließen Sie das Fläschchen und Wirbel sanft.
Fügen Sie ein paar Tropfen des Lösungsmittelgemisches sorgfältig die gekühlten Pipette hinzu. Sanft streichen Sie oder tippen Sie die Pipettenspitze bis das Lösungsmittel an der Unterseite der Spitze gesammelt hat.
Weiter die Lösungsmittelgemisches auf diese Weise hinzufügen, bis die Lösung der versiegelten Pipettenspitze bis zu einer Tiefe von etwa 2 Zoll, mit keine Luftblasen gefüllt.
Verschließen Sie die Pipette mit einem 14/20 Gummiseptum. Statten Sie eine 3-mL-Spritze mit einer Nadel. Stechen Sie die Nadel durch das Septum und zurückziehen Sie 3 mL Luft vorsichtig.
Ziehen Sie die Spritze und Klemmen Sie die Pipette zum Ring stehen horizontal. Verwenden Sie ein Feuerzeug, um das Glas über der Lösung in die Pipettenspitze zu erweichen.
Sobald das Glas Erweichung beginnt, drehen Sie langsam die Lösung gefüllten Pipettenspitze in die Lösung abzudichten. Weiter drehen der neu gebildeten Kapillaren bis es leicht von der Pipette Körper trennt.
Die Kapillare einfügen abkühlen lassen und dann in einem beschrifteten Behälter aufbewahren.
Um eine Probe für die Evans-Methode vorzubereiten, erste Platte die Masse eines funkeln Fläschchen und GAP. Dann legen Sie 5 mg der paramagnetischen Verbindung von Interesse in der Durchstechflasche funkeln und Aufzeichnen der Mass.
Pipette über 600 μL der Mischung von deuterierter und Proteated Lösungsmittel in das Funkeln Fläschchen. Schwenken Sie das Fläschchen, bis die feste Verbindung vollständig auflöst.
Notieren Sie die Masse der angeschnittene Ärmel Ampulle der Probelösung. Dann erhalten Sie eine standard NMR-Röhrchen und GAP.
Schieben Sie vorsichtig die Kapillare Einlage in der NMR-Röhrchen schräg. Die Lösung der paramagnetischen Verbindung auf die NMR-Röhrchen übertragen und die Röhrchen. Stellen Sie sicher, dass der Einsatz am unteren Ende der Röhre sitzt.
Erwerben Sie und speichern Sie eine standard- 1H-NMR-Spektrum.
Berechnen Sie zunächst, die Konzentration der Probenlösung in Mol pro Kubikzentimeter mit den aufgezeichneten Massen und die Dichte des Lösungsmittels. Konvertieren Sie den Unterschied zwischen der Lösungsmittel-Peak chemischen Schichten von ppm bis Hz. berechnen Sie die molare magnetische Suszeptibilität der Probe.
Als Nächstes berechnen Sie das magnetische Moment von der Sonde Temperatur und molare magnetische Suszeptibilität. Vergleichen Sie den berechneten Wert mit einer Tabelle der bekannten Werten die Zahl der ungepaarten Elektronen in der Verbindung zu bestimmen.
Die Zahl der ungepaarten Elektronen ist wichtig für die Modellierung von chemischer und biologischer Anlagen. Schauen wir uns ein paar Anwendungen.
Übergangsmetall-komplexe können mit molekularer orbital Theorie modelliert werden. In diesem Modell werden Elektronen zwischen Atomen geteilt Molekülorbitale zugewiesen. Informationen über die Zahl der ungepaarten Elektronen hilft um zu bestätigen, dass ein geeignetes Modell verwendet wird. Die Anzahl der einzeln besetzten und unbesetzten orbitale prognostiziert weiter, wie der Komplex mit anderen Molekülen reagieren wird.
Moleküle können durch die Symmetrie Operationen eingestuft werden, die sie ausführen können, z. B. über eine Achse gespiegelt werden. Molekulare Symmetrie kann viele Eigenschaften, wie die Schwingungs Modi einer Verbindung Vorhersagen. Da die Zahl der ungepaarten Elektronen über molekulare Geometrie Auskunft geben kann, ist es wichtig, die Zahl der ungepaarten Elektronen genau zu bestimmen, wenn Verbindungen zu charakterisieren.
Sie habe nur Jupiters Einführung in die Evans-Methode beobachtet. Sie sollten jetzt verstehen die grundlegenden Prinzipien der Evans-Methode, das Verfahren zur Berechnung der Anzahl der ungepaarten Elektronen und wie ungepaarten Elektronen sind relevant für das Verständnis der chemischen Reaktivität. Danke fürs Zuschauen!
Subscription Required. Please recommend JoVE to your librarian.
Results
E Xperimental Ergebnisse
| Fe(ACAC)3 | Chloroform | |
| m (g) | 0.0051 | 0.874 |
| MW (g/Mol) | 353.17 | n/a |
| n (Mol) | 1.44⋅10-5 | n/a |
| Dichte (g/mL) | n/a | 1.49* |
| Volumen (mL) | n/a | 0.587 |
| c (Mol/mL) | 2.45⋅10-5 | |
| NMR Verschiebungen | Peak 1 | Peak 2 |
| Δ (ppm) | 7.26 | 5.85 |
| Δppm | 1.41 | |
| NMR-Instrument | ||
| Temperatur (K) | 296,3 | |
| Feld, F (Hz) | 500⋅106 |
* die Dichte des Lösungsmittels kann angenähert werden, um die Dichte des verwendeten Lösungsmittels
Berechnungen:

 = 0,0137 cm3/mol
= 0,0137 cm3/mol
 = 5.70 µ B
= 5.70 µ B
Theoretischen Ergebnisse für S und n Werte:
| S | n | Μ S |
| 1/2 | 1 | 1,73 |
| 1 | 2 | 2,83 |
| 3/2 | 3 | 3,87 |
| 2 | 4 | 4.90 |
| 5/2 | 5 | 5.92 |
Für 4,5 mg Fe(acac)3 in 0,58 mL Lösungsmittel gelöst, mit einem 300 MHz-Instrument eine Peak-Trennung von 1,41 ppm beobachtet wird, wodurch XM= 1,37 x 10-2 und µEff = 5,70. Dieser µ-Eff -Wert steht im Einklang mit S = 5/2, komplex, verfügt über 5 ungepaarten Elektronen.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Die Evans-Methode ist eine einfache und praktische Methode zur Erlangung der magnetischen Suszeptibilität des löslichen Metallkomplexe. Dadurch haben die Zahl der ungepaarten Elektronen in einem Metallkomplex, die relevant für die Spektroskopie, die magnetischen Eigenschaften und die Reaktivität des Komplexes ist.
Messung der magnetischen Suszeptibilität paramagnetischen Arten gibt die Zahl der ungepaarten Elektronen, die eine wesentliche Eigenschaft der Metallkomplexe ist. Da die Reaktivität der Metallkomplexe von seiner elektronischen Struktur - beeinflusst wird, wie die d-orbitale aufgefüllt - es ist wichtig, die Zahl der ungepaarten Elektronen herzustellen. Der magnetischen Suszeptibilität kann verwendet werden, um die Geometrie der Metallkomplex in Lösung zu bestimmen, geben Einblick in die Liganden Feldstärke und kann Nachweis für die korrekte formale Oxidationsstufe Zuordnung des Metalls Komplex. In den Modulen "Gruppentheorie" und "MO Theorie der Übergangsmetall komplexe" präsentieren wir d-Orbital-Aufspaltung Diagramme Vorhersagen sowie die Daten aus der Evans-Methode verwenden, um bestimmen die Geometrie ein Metallkomplex und Nachweis für die Oxidationsstufe des Metall-Centers.
Es gibt mehrere Instrumente, die verwendet werden, um die magnetische Suszeptibilität einer paramagnetischen Spezies, einschließlich einer Gouy, Tintenfisch, Messen oder NMR-Instrument. Die Evans-Methode ist eine einfache und praktische Technik, die NMR verwendet, um die Lösung magnetische Moment ein Paramagnet bestimmen. Während die Evans-Methode ein mächtiges Werkzeug auf dem Gebiet des Magnetismus ist, gibt es einige Nachteile, die Technik. Erstens muss das Molekül in der im Versuch verwendete Lösungsmittel löslich sein. Wenn die paramagnetische Probe nicht vollständig gelöst ist, werden die Konzentration der Lösung, falsche die führen zu Fehlern in der experimentell ermittelten Lösung magnetisches Moment. Andere Fehler in der Konzentration können auftreten, wenn die paramagnetische Probe ist diamagnetisch (Lösungsmittel) oder paramagnetischen Verunreinigungen.
Subscription Required. Please recommend JoVE to your librarian.
References
- Miessler, G. L., Fischer, P. J., Tarr, D. A. Inorganic Chemistry. 5 ed. Pearson. (2014).
- Drago, R. S. Physical Methods for Chemists. 2 ed. Saunders College Publishing. (1992).
- Girolami, G. S., Rauchfuss, T. B., Angelici, R. J. Synthesis and Technique in Inorganic Chemistry: A Laboratory Manual. 3 ed. University Science Books. Sausalito, CA, (1999).





 (5)
(5)