Overview
Fuente: Corey Burns, Tamara M. Powers, Departamento de química, Texas A & M University
Complejos de rueda son una clase de compuestos de dos iones del metal (1st, 2ndo metales de transición de fila de 3rd ) celebrados en proximidad de cuatro ligandos puente (más comúnmente formamidinates o carboxilatos) (figura 1). Variar la identidad de los iones metálicos y el ligando puente proporciona acceso a grandes familias de conjuntos de rueda. La estructura de los complejos de rueda permite vinculación de metal-metal, que desempeña un papel vital en la estructura y la reactividad de estos complejos. Debido a la diversidad de estructuras electrónicas que están disponibles para rueda complejos - y las correspondientes diferencias en el enlace de la M-M de estas estructuras - rueda complejos han encontrado aplicación en diversas áreas, tales como en homogéneo Catálisis y como bloques de construcción para el metal-organic frameworks (MOF). Comprender la estructura electrónica de los bonos M-M en rueda complejos es fundamental para entender sus estructuras y así a la aplicación de estos complejos de coordinación química y catálisis.
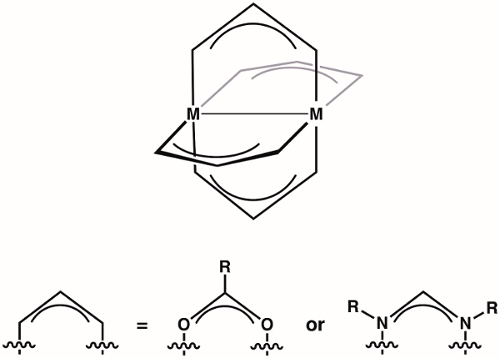
Figura 1. Estructura general de los complejos de la rueda, donde M puede ser 1st, 2ndo 3rd fila de metales de transición.
Cuando dos metales de transición se sitúan en las proximidades d-superposición de orbitales, que puede resultar en la formación de enlaces M-M. Superposición de d -orbitarios puede formar tres tipos de enlaces - σ, π y δ - dependiendo de la simetría de los orbitales involucrados. Si asignamos el eje molecular ser coplanares con el vínculo de M-M, un enlace σ está formado por el traslapo de los orbitarios de dz2 y enlaces π se forman por solapamiento de orbitales dyz los dxz . Δ los bonos son generados por la superposición de d-orbitarios que tienen dos nodos planares (dxy y dx2–y2). Como resultado, todos los cuatro lóbulos de la d-traslapo orbital y el correspondiente enlace δ tiene dos nodos planares (figura 2). En teoría, con la adición de enlaces δ, rueda complejos son capaces de soportar bonos quíntuples o cinco enlaces entre los átomos del metal. 1 en los más complejos, el dx2–y2 forma fuertes enlaces metal-ligando y no contribuye significativamente a M M Unión. Así, lazos cuádruples son del orden de máxima adherencia en muchos complejos.
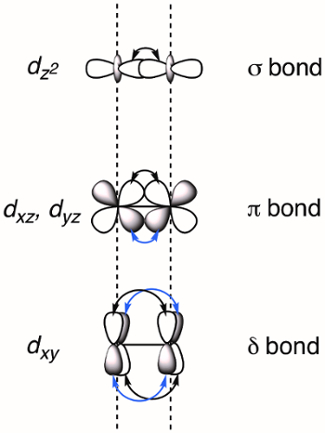
Figura 2. Representación visual de σ, π y δ vinculación MOs resultante de la combinación lineal de metal d-orbitarios. Los orbitales atómicos dz2 tienen el mejor solapamiento espacial, seguido del dxz y orbitales dyz . Los orbitales atómicos dxy tienen la menor cantidad de superposición espacial.
En este video, sintetizamos la dimolybdenum rueda complejo Mo2(ArNC(H)NAr)4, donde Ar = p-(MeO) C6H4, que cuenta con un enlace cuádruple. Vamos a caracterizar el compuesto por espectroscopia de RMN y usar Cristalografía de rayos x para estudiar el enlace M-M.
Principles
Empezamos por construir un diagrama de MO del enlace M-M dentro de la dimolybdenum general complejo Mo2(ArNC(H)NAr)4. En primer lugar, tenemos que definir nuestros ejes. Asume la más alta simetría disponible, Mo2(ArNC(H)NAr)4 está en el punto grupo D4h (figura 3). El eje z es por definición asignada al eje con mayor simetría rotacional (eje principal), que en este caso es un eje de rotación de4 Cque se encuentra en el vínculo de Mo Mo. Por Convención, los ejes x e y - mienten a lo largo de los bonos M-L; en nuestro caso concreto, esto significa que los ejes x e y - son colineales con los vectores de N Mo. Según nuestras asignaciones de eje, el dx2–y2 orbitales de cada átomo de Mo está implicado en el enlace metal-ligando. Que deja el dxydxz, dyzy orbitarios de dz2 para M-M la vinculación.
El diagrama de MO que describe el bono M M Mo2(ArNC(H)NAr)4 se muestra en la figura 4. Combinación lineal de dz2 orbitales de cada átomo M resultados en MOs σ y σ *. Dxz los orbitarios de dyz forman π y π * MOs. Finalmente, la combinación lineal de los orbitales atómicos dxy da lugar a las δ y δ * MOs. El enlace δ exhibe la menor cantidad de solapamiento espacial de los orbitales atómicos y, como resultado, la energía relativa de los orbitarios de la vinculación es σ < π < δ (figura 2). Esto corresponde a las fuerzas de adhesión, donde es más fuerte que un enlace π, que es más fuerte que un enlace δ un enlace σ. Llenamos el MOs correspondiente con el número total d e– para ambos centro de Mo, quees 8 (Mo+ 2, d4). Esto conduce a un orden de enlace de 4, que es consistente con un enlace cuádruple.
En este video, vamos a utilizar Cristalografía de rayos x para observar la longitud de enlace de Mo-Mo en el mes2(ArNC(H)NAr)4 complejo. Con la distancia de enlace Mo-Mo de estructura de estado sólido, podemos encontrar la relación de dificultad formal (FSR), que es el valor normalizado del enlace M-M. El FSR se calcula para un enlace A B utilizando la ecuación 1, que es simplemente el cociente de la distancia de enlace observados en estado sólido (DA-B) a la suma de los radios atómicos ( y
y  ) de los átomos individuales.
) de los átomos individuales.
 (1)
(1)
El valor FSR se normaliza para radio atómico y así proporciona una manera rápida y conveniente de comparar M M enlace distancias, no sólo entre los diferentes tipos de metal, sino también a las distancias de enlace entre átomos de no metal.

Figura 3. Ejes definidos para la molécula del mes2(ArNC(H)NAr)4, suponiendo simetría más alta (D4h).

Figura 4. Diagrama de MO de la vinculación de M-M en el mes2(ArNC(H)NAr)4.
Subscription Required. Please recommend JoVE to your librarian.
Procedure
1. síntesis del ligando ArN (H) C (H) NAr, donde Ar = p-(MeO) C6H4 (figura 5)2
- Combinar (0.050 mol) de 6,0 g de p -anisidina y 4,2 mL (0.025 mol) de triethylorthoformate de 100 mL ronda matraz de fondo con una barra de agitación magnética.
- Coloque una cabeza de destilación al matraz de reacción.
- Sin dejar de agitar, calentar la reacción en un baño de aceite a reflujo (120 ° C). Una vez que se logra el reflujo, el etanol subproducto debe empezar a destilar de la reacción. Recoger el etanol en un vaso de precipitados colocada en el extremo de la cabeza de destilación.
- La reacción de calor hasta que deje de la destilación de etanol (menos de 1,5 h).
- Retirar el matraz del baño de aceite y deje que la mezcla de reacción se enfríe a temperatura ambiente. Debe formar un precipitado. Si el producto no se precipita, colocar el matraz en un baño de hielo y raspar el fondo del matraz con una espátula para favorecer la cristalización.
- Recristalizan el producto de una cantidad mínima de ebullición tolueno (para un procedimiento más detallado, por favor, revise el video de "Compuestos de la purificación por recristalización" en la serie de fundamentos de química orgánica ).
- Recoger el producto por filtración a través de un embudo de sinterizado y lavar con 10 mL de hexanes.
- Aislar el producto blanco y deje que se seque al aire.
- Recoger una 1H NMR de los sólidos usando CDCl3.

Figura 5. Síntesis de ArN (H) C (H) NAr, donde Ar = p- MeOC6H4.
2. configuración de la línea de Schlenk
Nota: Para un procedimiento más detallado, por favor, revise el video "Schlenk líneas transferencia de disolvente" de la serie de fundamentos de química orgánica . Seguridad de línea de Schlenk debe revisarse antes de realizar este experimento. Vidrio debe ser inspeccionado para estrellas grietas antes de su uso. Debe tenerse cuidado para asegurar que el O2 no se condensa en la trampa de la línea de Schlenk si utiliza líquido N2. Temperaturas líquido N2 , O2 se condensa y es explosivo en presencia de solventes orgánicos. Si se sospecha que ha sido condensado O2 o un líquido de color azul se observa en la trampa de frío, deje que la trampa fría bajo vacío dinámico. Retire el líquido N2 purgador o apagar la bomba de vacío. Con el tiempo el líquido O2 se sublime en la bomba; sólo es seguro remover la trampa de2 N líquida una vez de O2 ha sublimado.
- Cierre la válvula de liberación de presión.
- Encienda el gas de N2 y la bomba de vacío.
- Como el Schlenk línea vacío alcanza su presión mínima, preparar la trampa de frío con hielo seco/acetona o líquido N2 .
- Montar la trampa de frío.
3. síntesis de Mo2(ArNC(H)NAr)4 (figura 6)2
PRECAUCIÓN: El molibdeno fuente utilizada en la síntesis de Mo2(es de ArNC(H)NAr)4 Mo(CO)6, que es altamente tóxico y puede ser fatal si inhalado, absorbido por la piel, o ingestión. CO se genera durante la reacción. Por lo tanto, la síntesis debe ser realizada en una campana bien ventilada.
- Utilizar técnicas de línea de Schlenk estándar para la síntesis de Mo2(ArNC(H)NAr)4 (ver el video de "Síntesis de una línea de Schlenk de uso de metaloceno Ti(III) técnica").
- Añadir 0,34 g (1.3 mmol) Mo(CO)6 y 1,0 g (3.9 mmol) de ArN (H) C (H) NAr a un matraz de 100 mL Schlenk y preparar el matraz Schlenk para la transferencia de la cánula de solvente.
- Añadir 20 mL de desgasificada o- diclorobenceno al matraz Schlenk vía transferencia de la cánula.
- Colocar el matraz Schlenk con un condensador conectado a la línea de gas N2 .
- El reflujo la reacción durante 2 h (180 ° C) en baño de aceite de silicona.
Nota: Mo(CO)6 es volátil y se condensará en los lados del frasco Schlenk durante la reacción. Para obtener mayores rendimientos, periódicamente volver a disolver cualquier sublimado Mo(CO)6 tirando el matraz fuera del baño de aceite y suavemente girando el disolvente en el matraz. - Retirar el matraz Schlenk del baño de aceite y deje que la mezcla se enfríe a temperatura ambiente.
- Filtrar la solución marrón a través de un embudo de sinterizado y lavar el precipitado amarillo con 10 mL de hexanes, seguido por 5 mL de acetona de grado reactivo. El mes2(ArNC(H)NAr)4 descompone lentamente en solución cuando existe O2 . Por lo tanto, la filtración debe realizarse rápidamente una vez retirada la reacción N2.
- Recoger el sólido amarillo Mo2(ArNC(H)NAr)4 y aire seco.
- Utilizando CDCl3 medida espectro 1H NMR del producto.

Figura 6. Síntesis de Mo2(ArNC(H)NAr)4, donde Ar = p- MeOC6H4.
4. solo cristal crecimiento
Nota: Mo2(ArNC(H)NAr)4 se oxida lentamente en solución. El disolvente de cristalización se debe desgasificarse antes de uso, pero rigurosas condiciones de aire libre no son necesarias para obtener cristales de calidad de rayos x por difracción de rayos x de monocristal.
- Degas 10 mL de diclorometano (CH2Cl2) por los burbujeantes N2 gas a través de la solución durante 10 minutos (ver el video de "Síntesis de una línea de Schlenk de uso de metaloceno Ti(III) técnica" de un procedimiento más detallado en purga de líquidos).
- Hacer una solución saturada de Mo2(ArNC(H)NAr)4 disolviendo 20 mg del sólido en 2 mL de desgasificada CH2Cl2.
- Hacer una pipeta enchufe Celite insertando un pequeño trozo de Kimwipe en una pipeta. Añadir una pequeña cantidad de Celite a la pipeta.
- Filtrar la solución CH2Cl2 a través del tapón de Celite pipeta en un frasco pequeño de 5 mL. Ayudar a empujar la solución a través de la Celite utilizar un bulbo de la pipeta.
- Con unas pinzas, introduzca el frasco de 5 mL en un vial de centelleo de 10 mL.
- En el vial de centelleo externo, añadir 2 mL de hexanes.
- Firmemente la tapa el vial de centelleo y colocarlo en un estante donde va a ser tranquilo.
- Permite al menos 24 h para el crecimiento del monocristal (ver el video de "Cristalografía de rayos x" en la serie de fundamentos de química orgánica para un procedimiento más detallado crecer solos cristales).
- Recoger datos de rayos x de monocristal en la muestra (ver el video de "solo cristal y polvo difracción de rayos x" para un procedimiento más detallado sobre cómo recoger datos de rayos x).
Complejos de rueda son una clase de compuestos que se compone de dos iones metálicos en la proximidad entre sí por cuatro ligandos puente. Dependiendo de sus propiedades, complejos de rueda se utilizan como catalizadores o bloques de construcción para los armazones metal-orgánicos, también conocido como MOF.
El M-M en un complejo de rueda afecta a la estructura y la reactividad del compuesto y pueden ser modificados aún más por variación de los iones metálicos y ligandos.
Para comprender estas propiedades, es crucial para comprender la estructura electrónica del enlace M-M en un determinado complejo de rueda.
Este video ilustra los principios de Unión M-M, la síntesis y el análisis de un complejo de molibdeno dinucleares y diversas aplicaciones de complejos de rueda.
El enlace de M-M en un complejo de rueda puede explicarse utilizando la teoría de orbital moleculares.
Cuando d-orbitarios de dos metales de transición se superponen, se forma un enlace de M-M. Dependiendo de la simetría orbital, se pueden crear tres tipos de bonos: bonos de σ, π y δ.
Si el eje z se asigna al enlace M-M, tanto dz2 orbitales se solapan frontalmente para formar un enlace σ. Superposición entre dos lóbulos de los orbitales dxz o yz de d crea un enlace π. Traslape entre los cuatro lóbulos de dxy o dx2-y2 orbitales crea un vínculo δ.
Los orbitales dx2-y2 forma fuertes enlaces M-L y generalmente no contribuyen a la vinculación de M-M. Por lo tanto, el orden de enlace máximo alcanzable en muchos complejos es cuatro.
Ahora, echemos un vistazo en el enlace de M-M en un dimolybdenum complejo. En primer lugar, asignar los ejes y simetría disponible más alto.
El eje z describe la simetría rotatoria más alta, que es el eje de4 Cmentira a lo largo de la Unión Mo-Mo. A continuación, asignar el x y el eje y, que mienten a lo largo de los bonos N Mo.
Como se ve, dx2-y2 orbitales de cada átomo de Mo participa en M L vinculación, dejando el dxy, dxz, yzde dy dz2 orbitales para la vinculación de M-M. Esto puede describirse además con un esquema de MO.
Combinación lineal de los orbitales dz2 en los resultados de cada átomo del metal en σ y σ * orbitales moleculares, mientras que los orbitales dxz y yz de d forman π y π * MOs. Finalmente, la combinación lineal de orbitales atómicos dxy crea el δ y δ * MOS llenar el MOs con los electrones d de los resultados de centros de Mo en un enlace cuádruple.
Bonos M M pueden medirse utilizando Cristalografía de rayos x. Para normalizar el radio atómico, la relación de dificultad formal se calcula con esta ecuación. El FSR describe la relación entre la distancia de enlace en el estado sólido a la suma de los radios atómicos de los átomos individuales y se utiliza para analizar y comparar bonos en diversos complejos metálicos.
Ahora que usted entiende lo que son los cuádruples bonos y cómo analizarlos, vamos a usar este conocimiento en un ejemplo real.
Para empezar, combinan 6,0 g de p -anisidina y 4,2 mL de triethylorthoformate de 100 mL ronda matraz de fondo con una barra de agitación magnética. Coloque una cabeza de destilación al matraz de reacción y coloque un vaso de precipitados en el extremo de él.
Encender el agitador y plato caliente. Recoger la destilación etanol del subproducto en el vaso y apagar el fuego cuando deja de destilación de etanol.
Retirar el matraz del baño de aceite y deje que la mezcla de reacción se enfríe a temperatura ambiente. Debe formar un precipitado. Si el producto no se precipita, colocar el matraz en un baño de hielo y raspar el fondo del matraz con una espátula para favorecer la cristalización.
Recristalizan el producto de una cantidad mínima de ebullición tolueno. Recoger el producto por filtración a través de un embudo de sinterizado y lavar con 10 mL de hexanes.
Aislar el producto blanco y deje que se seque en el aire en plato de recristalización. Por último, utilizando CDCl3, obtenga un 1H NMR de los sólidos.
Antes de iniciar la síntesis, establecer la línea de Schlenk, asegurando N2 flujo y una trampa llena de frío.
Familiarizarse con las precauciones de seguridad con Mo(CO)6, que es altamente tóxico y las técnicas de la línea de Schlenk.
En primer lugar, agregar 1,0 g de la recién sintetizada ligando y 0,34 g Mo(CO)6 en un matraz de 100 mL Schlenk y preparar el matraz Schlenk para la transferencia de la cánula de solvente.
Transferencia de siguiente, utilizando cánula Añadir 20 mL de desgasificada o- diclorobenceno al matraz Schlenk. Introducir el matraz Schlenk con un condensador conectado a N2y coloque el matraz en un baño de aceite de silicona. Reflujo la reacción durante 2 h a 180 ° C.
Cuando haya terminado, retire el matraz Schlenk el baño del aceite y deje que la mezcla se enfríe a temperatura ambiente. Una vez enfriado, inmediatamente filtrar la solución marrón a través de un embudo sinterizado, para reducir la velocidad de oxidación del producto en presencia de aire.
Lavar el precipitado amarillo con 10 mL de hexanes, seguido por 5 mL de acetona de grado reactivo. Recoger el producto amarillo, sólido y deje que se seque al aire. Utilizando CDCl3, medir el espectro de 1H NMR del producto.
En primer lugar, desgasificar los 20 mL de CH2Cl2 para reducir al mínimo la velocidad de oxidación del producto por los burbujeantes N2 a través de ella durante 10 minutos. Disolver 20 mg de producto en 2 mL de desgasificada CH2Cl2 para hacer una solución saturada.
A continuación, inserte un pedazo pequeño de una limpia de pelusas en una pipeta para hacer un enchufe de Celite. Añadir una pequeña cantidad de Celite a la pipeta. La solución saturada de producto en el CH2Cl2 a través del tapón del filtro en un frasco de 5 mL. Utilice una pipeta para empuje con cuidado la solución a través del tapón.
Con unas pinzas, introduzca el frasco de 5 mL en un vial de centelleo de 10 mL. Añadir 2 mL de hexanes al frasco centelleo externo. Tape bien y coloque en un estante donde el frasco centelleo no molestarán.
Espere al menos 24 horas para permitir el crecimiento del monocristal y recoger datos de rayos x de monocristal en la muestra. Ahora que se recogen todos los datos, vamos a echar un vistazo a los resultados.
El ligando exhibe un pico característico para el bono de NHC -HN a 8,02 ppm. Los picos aromáticos integran a 8H, y los dos grupos metoxi integran total ppm 3,80 6 h.
En comparación, el singlete de la fianza de NHC -HN en el producto ocurre en 8,37 ppm e integra a 4 H. Los dobletes de los hidrógenos aromáticos se encuentran en el 6,49 y 6.16 ppm con una integración total de 32H. Por último, se encuentran los grupos metoxi en 3,70 ppm con una integración de 24H.
Las dos señales en la región aromática indican la simetría 4 veces del producto. Además, la estructura de estado sólida es consistente con el grupo de punto de4 Dy cuenta con un corto lazo de Mo-Mo de 2.0925(3) Å.
Usando el Radio atomico de Mo, se calcula el valor FSR para el enlace de M-M a 0,72, que es consistente con la presencia de un enlace cuádruple M-M.
Rueda complejos, como el molibdeno dinucleares complejo sintetizado en este video, mostrar una amplia gama de propiedades y así encuentran aplicación en diversas áreas de la química.
Por ejemplo, M-M bonos desempeñan un papel importante en la catálisis. La rueda complejo Rh2(OAc)4 es un conocido catalizador para funcionalización de enlace C-H a través de reacciones de transferencia de carbeno y nitrene.
En una reacción de transferencia típico carbeno, Rh2(OAc)4 reacciona con un compuesto diazo para generar un carbeno Rh2 intermedio. Inserción posterior del carbeno en un enlace C-H genera producto de funcionalización de C-H y regenera el catalizador de Rh2(OAc)4 .
Armazones metal-orgánicos, también conocido como MOF, son porosos compuestos de clusters metálicos Unidos entre sí por ligandos orgánicos. Este tipo de compuesto es una subclase de los polímeros de la coordinación y puede formar una, dos o construcciones tridimensionales.
MOF se utiliza en muchos campos. Debido a su alta porosidad y su gran área superficial por volumen, MOF encontrar aplicaciones que van desde catalizadores a la separación y almacenamiento de gas.
Sólo ha visto introducción de Zeus quadruply M-M consolidado complejos. Ahora debería entender qué son los bonos M M cuádruples, cómo sintetizar complejos con rueda y cómo analizarlas. ¡Gracias por ver!
Subscription Required. Please recommend JoVE to your librarian.
Results
NAr de ligando ArN (H) C (H)
Producción: 3,25 g (53%). 1 H RMN (cloroformo -d, 500 MHz, δ, ppm): 8.06 (s, 1 H, NHC -HN), 6,99 (día, 4 H, aromáticos C -H, J = 8,7 Hz), 6.86 (día, 4 H, aromáticos C -H, J = 9,0 Hz), 3.80 (s, 6 H, - OCH3).
Mo Mo complejo2(ArNC(H)NAr)4
Rendimiento: 450 mg (57%). 1 H RMN (cloroformo -d, 500 MHz, δ, ppm): 8.38 (s, 4 H, NHC -HN), 6.51 (d, 16 H, aromáticos C -H, J = 8,8 Hz), 6.16 (d, 16 H, aromáticos C -H, J = 8,8 Hz), 3.71 (s, 24 H, - OCH3).
Tabla 1. Cristal de datos y parámetros de celda unidad
| Fórmula empírica | C60H70Mo2N8O8 |
| Peso de la fórmula (g/mol) | 1223.12 |
| Temperatura (K) | 296.15 |
| Sistema cristalino | triclínico |
| Grupo del espacio | P-1 |
| un (Å) | 10.1446(4) |
| b (Å) | 10.3351(4) |
| c (Å) | 13.9623(6) |
| Α (°) | 80.151(2) |
| Β (°) | 75.251(2) |
| Γ (°) | 82.226(2) |
| Volumen (Å3) | 1388.3(1) |
Espectro 1H NMR de Mo2(ArNC(H)NAr)4exhibe dos señales en la región aromática, que es constante con 4 foldsymmetry. La estructura de estado sólida (figura 7) es consistente con el punto grupo D4 y dispone de un enlace corto de Mo-Mo (2.0925(3) Å). Los radios atómicos de Mo son 1.45 Å. Por lo tanto, utilizando la ecuación 1, el valor FSR para el bono M M Mo2(ArNC(H)NAr)4es 0,72. Este valor es menor que el observado para el Mo-Mo quadruply consolidado complejo Mo(hpp)4 (hpp = 1,3,4,6,7,8-hexahydro-2H- pyrimido [1, 2 -a] pyrimidinate), que tiene un valor FSR de 0.797 y es consistente con la presencia de un Enlace cuádruple M M3.
Figura 7. Estructura de estado sólido para Mo2(ArNC(H)NAr)4 con el elipsoides térmicos en el nivel de probabilidad del 50%. Átomos de hidrógeno se omiten para mayor claridad (Armada de Mo, N azul, C gris).
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
En este video, nos enteramos de Unión M-M. Hemos sintetizado un dinuclear molibdeno complejo cuenta con un enlace cuádruple. Enlaces cuádruples constan de tres tipos de bonos diferentes, incluyendo enlaces σ, π y δ. Se recogieron datos de difracción de rayos x de monocristal y observó una corta longitud de enlace Mo-Mo consistente con un compuesto quadruply servidumbre.
Rueda complejos, como el Mo2 complejo preparado aquí, mostrar una amplia gama de propiedades y así encuentran aplicación en diversas áreas de la química. Por ejemplo, M-M bonos desempeñan un papel importante en la catálisis: el rodio rueda complejo Rh2(OAc)4 es un conocido catalizador para funcionalización de enlace C-H a través de reacciones de transferencia de carbeno y nitrene (figura 8). En una reacción de transferencia típico carbeno, Rh2(OAc)4 reacciona con un compuesto diazo para generar un carbeno Rh2 intermedio. Inserción posterior del carbeno en un enlace C-H genera producto de funcionalización de C-H y regenera el catalizador de Rh2(OAc)4 . La reactividad excepcional de Rh2 catalizadores en estas reacciones se ha atribuido a la interacción de la Rh-Rh mediante el enlace de M-M. El enlace de Rh-Rh en la resultante intermediario actúa como un reservorio de electrones; mientras que un metal sirve como un sitio de Unión para el sustrato, el segundo centro metal Transfer densidad del electrón desde el centro de metal activo y durante la activación del sustrato. D-orbital partir diagrama del complejo intermedio (núcleo de Rh-Rh a la carbenoid) que muestra la frontera d-orbitarios son no-vinculación con respecto al centro activo del derecho (Figura 9a). La densidad del electrón en el σ y el π no vinculación MOs está centrada en el carbono nucleofílico carbenoid y el centro derecho del "espectador", que no está ligado directamente a la unidad (Figura 9b) carbenoid del4.

Figura 8. Funcionalización de enlace C-H a través de un intermedio de metal carbenoid.

Figura 9. (a) d-orbital MO dividir el diagrama de la base de Rh-Rh en rueda complejos ligada a un substrato carbenoid. Observe que aparecen sólo orbitales involucrados en la Unión del sustrato. (b) la resultante σ y π no vinculación MOs están llenos de electrones. La densidad del electrón en los MOs se centra en el carbón carbenoid y el centro de Rh del "espectador".
Rueda complejos también se han utilizado como bloques de construcción en MOF. MOF es polímeros de coordinación poroso que consisten en complejos metálicos Unidos entre sí por ligandos orgánicos. La resultante una, dos o superestructuras tridimensionales se pueden utilizar en una variedad de aplicaciones que van desde la absorción de gases (incluyendo separación y purificación) a la catálisis.
Subscription Required. Please recommend JoVE to your librarian.
References
- Nguyen, T., Sutton, A. D., Brynda, M., Fettinger, J. C., Long, G. J., Power, P. P. Synthesis of a stable compound with fivefold bonding between two chromium(I) centers. Science. 310(5749), 844-847 (2005).
- Lin, C., Protasiewicz, J. D., Smith, E. T., Ren, T. Linear free energy relationship in dinuclear compounds. 2. Inductive redox tuning via remote substituents in quadruply bonded dimolybdenum compounds. Inorg Chem. 35(22), 6422-6428 (1996).
- Cotton, F. A., Murillo, C. A., Walton, R. A. Eds. Multiple Bonds Between Metal Atoms, 3rd ed. Springer. New York, NY. (2005).
- Nakamura, E., Yoshikai, N., Yamanaka, M. Mechanism of C−H Bond Activation/C−C Bond Formation Reaction between Diazo Compound and Alkane Catalyzed by Dirhodium Tetracarboxylate. J Am Chem Soc. 124 (24), 7181-7192 (2002).




