Overview
Fonte: Perchet Thibaut1,2,3, Meunier Sylvain1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Unità di Linfopoiesi, Dipartimento di Immunologia, Istituto Pasteur, Parigi, Francia
2 INSERM U1223, Parigi, Francia
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, Parigi, Francia
4 Platfrom, Citometria a flusso e biomarcatori UtechS, Center for Translational Science, Pasteur Institute, Parigi, Francia
La funzione generale del sistema immunitario è quella di difendere il corpo da organismi infettivi e altri invasori. I globuli bianchi, o leucociti, sono i giocatori chiave del sistema immunitario. Al momento dell'infezione, vengono attivati e iniziano una risposta immunitaria. I leucociti possono essere suddivisi in varie sotto-popolazioni (ad esempio, cellule mieloidi, linfociti, cellule dendritiche) in base a diversi parametri che possono essere biologici, fisici e / o funzionali (ad esempio, dimensioni, granularità e secrezione). Un modo per caratterizzare i leucociti è attraverso le loro proteine di superficie, che sono principalmente recettori. Ogni popolazione di leucociti esprime una specifica combinazione di recettori (ad esempio, recettori citotossici, attivanti, di migrazione) che possono definire sottoinsiemi tra le popolazioni. Poiché il sistema immunitario comprende una vasta gamma di popolazioni cellulari, è essenziale caratterizzarle per decifrare la loro partecipazione alla risposta immunitaria.
La citometria a flusso (FC o FCM) è un metodo ampiamente utilizzato per analizzare l'espressione della superficie cellulare e delle molecole intracellulari, caratterizzando e definendo diversi tipi di cellule in una miscela cellulare eterogenea. I citometri a flusso sono composti da tre sottosistemi principali: fluidica, ottica ed elettronica. Il sistema fluidico trasporta le cellule in un flusso tale che passano davanti a un laser una per una. Il sistema ottico è costituito da sorgenti luminose (laser) per illuminare le particelle, filtri ottici per dirigere la luce risultante e segnali fluorescenti verso rilevatori appropriati. Infine, il sistema elettronico converte i segnali luminosi rilevati in segnali elettronici che possono essere elaborati dal computer. Quando una singola cellula passa davanti al raggio laser, disperde la luce. Un rilevatore davanti al fascio misura la diffusione in avanti (FS) e diversi rilevatori per misurare lateralmente la diffusione laterale (SC). La FS è correlata alla dimensione delle cellule e sc è proporzionale alla granularità delle cellule. In questo modo, le popolazioni cellulari possono spesso essere distinte in base alle differenze nelle loro dimensioni e granularità da sole.
Oltre ad analizzare le dimensioni, la forma e la complessità di una cellula, la citometria a flusso è ampiamente utilizzata per rilevare l'espressione dei recettori di superficie cellulare (1). Ciò si ottiene utilizzando anticorpi monoclonali marcati con fluorocromo che si legano a recettori cellulari specifici noti. Dopo l'eccitazione, questi fluorocromi legati emettono una luce di lunghezza d'onda specifica, chiamata lunghezza d'onda di emissione, che può essere rilevata e valutata. Le misurazioni di fluorescenza forniscono dati quantitativi e qualitativi sui recettori di superficie cellulare etichettati con fluorocromo. Gli ematologi sono stati i primi a utilizzare FC per il follow-up terapeutico delle popolazioni di cellule immunitarie (2). Ora, viene utilizzato per una vasta gamma di applicazioni come l'immunofenotipizzazione, la vitalità cellulare, l'espressione genica, il conteggio cellulare e l'analisi GFP.
FACS (Fluorescent Activated Cell Sorter) è un tipo specializzato di citometria a flusso, che ordina una popolazione di cellule in sottopopolazione utilizzando l'etichettatura fluorescente. Proprio come la citometria a flusso convenzionale, vengono raccolti i primi dati FS, SC e fluorescenti. Quindi, la macchina applica una carica (negativa o positiva) e un sistema di deflessione elettrostatica (elettromagneti) facilita la raccolta di goccioline cariche contenenti celle in tubi appropriati.
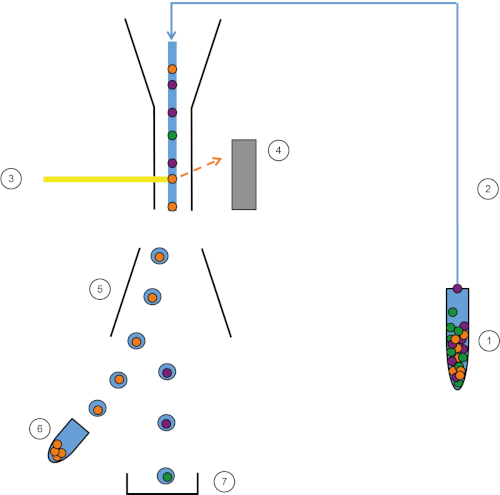
Figura 1: Rappresentazione schematica di FACS. Il campione (1) viene aspirato nel FACS (2) e passato davanti al laser (3). La fluorescenza cellulare viene percepita dai rivelatori a fluorescenza (4). Infine, le cellule sono incorporate in goccioline e le cellule di interesse vengono deviate da piastre di deflessione (5) e raccolte in un tubo di raccolta (6). Le celle rimanenti vanno nel cestino (7). Fare clic qui per visualizzare una versione più grande di questa figura.
L'aspetto dello smistamento del FACS presenta molti vantaggi. Molti test possono aiutare a capire il ruolo di cellule specifiche nel sistema immunitario, come le analisi dell'espressione genica come RT-qPCR, ciclo cellulare o secrezione di citochine. Tuttavia, le cellule dovrebbero essere purificate a monte per ottenere risultati chiari e specifici. Qui, FACS è utile e le cellule desiderate possono essere ordinate con grande purezza, ottenendo risultati altamente affidabili e riproducibili. FACS può anche essere utilizzato per ordinare le cellule in base alla colorazione nucleare o ad altre colorazioni intracellulari e in base alla presenza, all'assenza e alla densità dei recettori di superficie. FACS è ora una tecnica standard per la purificazione di sottopopolazioni di cellule e ha la capacità di ordinare fino a quattro popolazioni contemporaneamente.
Questo esercizio di laboratorio dimostra come isolare i leucociti splenici e quindi come ordinare specificamente le cellule linfoidi B dalla miscela di cellule leucocitarie spleniche usando FACS.
Procedure
1. Preparazione
- Prima di iniziare, indossare guanti da laboratorio e gli indumenti protettivi appropriati.
- Sterilizzare tutti gli strumenti di dissezione, prima con un detergente e poi con etanolo al 70% e poi asciugare accuratamente.
- Preparare 50 ml di soluzione salina bilanciata di Hank (HBSS) contenente il 2% di siero fetale di vitello (FCS).
2. Dissezione
- Utilizzando un sistema di rilascio di anidride carbonica, eutanasizzare il topo per ipossia. Fissare il topo eutanasizzato su una piastra di dissezione in posizione supina ed eseguire una laparotomia longitudinale usando forbici e pinza.
- Usando la pinza, spostare l'intestino e lo stomaco sul lato destro dell'addome per esporre lo stomaco e la milza. La milza è attaccata allo stomaco.
- Usando la pinza, staccare con cura la milza dallo stomaco e metterla nella capsula di Petri contenente 5 ml di HBSS 2% FCS.
3. Isolamento delle cellule immunitarie
- Posizionare la milza in un colino cellulare da 40μm sulla stessa capsula di Petri. Schiacciare la milza con uno stantuffo per dissociarla nello stesso piatto.
- Trasferire la milza dissociata e il fluido in un tubo centrifugo da 15 ml.
- Centrifugare il tubo a 370 x g per 7 min a 10°C ed eliminare il surnatante, evitando il pellet.
- Ripresa del pellet in 2mL di acetato di potassio per lisi degli eritrociti. Attendere 2 minuti e quindi portare il volume fino a 15 ml utilizzando HBSS 2% FCS.
- Centrifugare nuovamente il tubo a 370 x g per 7 min a 10°C. Scartare il surnatante e ricaspenare il pellet in 5mL di HBSS 2% FCS.
- Contare le cellule utilizzando un test di colorazione blu tripano e regolare la concentrazione cellulare finale a 107 cellule / mL utilizzando un volume appropriato di HBSS 2% FCS.
4. Colorazione cellulare
- Trasferire 200μL della sospensione cellulare in sei tubi FACS, etichettati da 1 a 6.
- Centrifugare i tubi a 370 x g per 7 min a 10°C ed eliminare il surnatante evitando il pellet.
- Successivamente, preparare sei nuove miscele di anticorpi aggiungendo una quantità appropriata di anticorpi a 200μL HBSS 2% FCS secondo la Tabella 1.
- Quindi, trasferire queste miscele di anticorpi ai corrispondenti tubi FACS numerate.
- Incubare le sospensioni cellulari mescolate con gli anticorpi per 20 minuti sul ghiaccio al buio.
- Aggiungere 1 ml di HBSS 2% FCS a ciascun tubo e quindi centrifugare di nuovo a 370 x g per 3 minuti a 10 ° C.
- Scartare il surnatante e ricaspenare il pellet in 200μL di HBSS 2% FCS.
- Trasferire i pellet riconsodati in nuovi tubi FACS.

Tabella 1: Composizione della miscela di anticorpi. Sei miscele di 200μL di anticorpi HBSS + sono state preparate per l'esperimento. Il mix 1 è per l'impostazione PMT, i mix da 2 a 5 sono per le impostazioni di compensazione e il mix 6 è per l'ordinamento delle celle.
5. Calibrazione FACS
- Innanzitutto, accendi il sorter ed esegui "Fluidics Startup".
- Accendi il flusso e attendi 15 minuti affinché il flusso si stabilizzi.
- Regolare l'ampiezza del flusso per ottenere la formazione di gocce staccate. Quindi fare clic su "Sweet Spot" per completare la regolazione dell'ampiezza.
- Metti il filtro a densità neutra (N.D.) - 1.0 e apri l'interfaccia "CST" che sta per configurazione e tracciamento del citometro.
- Per eseguire il controllo di qualità giornaliero, prima diluire le perle CST con il supporto FACS seguendo le istruzioni del produttore e quindi eseguire il controllo CST.
- Una volta completato il controllo CST, sostituire il filtro N.D. 1.0 con il filtro N.D. 2.0 sul citometro.
- Successivamente, diluire le perline di ritardo della caduta nel mezzo FACS seguendo le istruzioni del produttore e quindi caricare nel FACS.
- Per garantire un corretto ordinamento eseguire Drop Delay-
- Fare prima clic su "Tensione" e poi su "Filtro ottico". Il quadrante destro dovrebbe essere uguale al 100%. Se necessario, regolare la vite laser rossa sul citometro a sinistra oa destra per ottenere il 100% nel quadrante destro.
- Quindi, eseguire un ordinamento di prova per assicurarsi che il flusso cada nel tubo di raccolta. Per fare ciò, fare clic su "Cassetto rifiuti" e avviare "Test Sort". Verificare che i flussi laterali cadano nei tubi di raccolta. Se non lo fanno, regola la tensione fino a quando non lo fanno.
- Passare al modello sperimentale. Quindi, apri l'esperimento "Accudrop Drop Delay" e fai clic su "Sorting Layout".
- Modificare la portata per ottenere da 1000 a 3000 eventi al secondo.
- Fare clic su "Tensione" e quindi su "Filtro ottico". Il quadrante sinistro deve essere uguale a 0 e il quadrante destro a 100.
- Nella finestra "Ordina layout" fare clic su "Ordina" e quindi fare clic su "Annulla". Il quadrante sinistro deve essere uguale a 100 e il quadrante destro a 0. Se il quadrante sinistro è inferiore a 95, fare clic su "Ritardo automatico" per regolarlo automaticamente.
6. Citometria a flusso e controllo della purezza
- Inizia la citometria a flusso iniziando con il tubo 1 (cellule non macchiate) per definire la morfologia cellulare e i picchi negativi dei fluorocromi. Impostare lo scatter avanti e laterale e definire le tensioni di ciascun parametro fluorescente. Posizionare la popolazione negativa nel primo decennio utilizzando le griglie su ciascun dot plot.
- Quindi, caricare il tubo 2 (controllo del colore singolo) nel citometro. Regolare la sovrapposizione spettrale fino a quando le mediane di popolazione negative e positive non sono allineate o utilizzare il software di calcolo automatico. È importante mantenere il segnale sulla scala. I controlli di compensazione devono corrispondere alle impostazioni sperimentali dei fluorocromi e dei rivelatori. Registra 10.000 eventi.
- Ripetere questi passaggi con i tubi 3, 4 e 5 (altri controlli a colore singolo).
- Successivamente, caricare il tubo 6 (celle multi-macchiate) e definire le popolazioni cellulari di interesse utilizzando una strategia di gating specifica.
- Nella finestra Layout ordinamento selezionare la popolazione di celle di interesse. Selezionare la soglia della cella in "Eventi target" e il livello di precisione in "Precisione". Qui viene ordinata una sola popolazione, tuttavia, quattro diverse popolazioni possono essere ordinate contemporaneamente.
- Una volta pronto, fai clic su "Ordina" e "OK", quindi attendi l'ordinamento delle celle.
- Una volta completata la selezione delle celle, eseguire un controllo di purezza pipettando prima 10μL di celle smisate in un nuovo tubo FACS con 90 microlitri di HBSS 2% FCS.
- Quindi, caricare il tubo il citometro. Registrare e analizzare i fenotipi delle cellule per verificare che la strategia di gating abbia funzionato come previsto.
7. Analisi dei dati
- Apri il software 'FlowJo' e trascina i file per ogni tubo nella finestra "Tutti i campioni".
- Fare doppio clic su un file per aprirlo in una nuova finestra.
- Clicca sul "Poligono" e ricrea la strategia di gating usata in precedenza.
- Ripetere i passaggi con tutti gli altri file.
- Per visualizzare i dot plot, fare clic su "Editor layout" e trascinare le popolazioni di interesse dal tubo 6 e dal controllo della purezza nella scheda editor di layout. Le cellule dovrebbero apparire solo nella popolazione di interesse per il controllo della purezza (vedi Figura 2).
- Per verificare la purezza dei linfociti B nelle cellule ordinate, fare clic su "Editor tabelle". Trascinare la popolazione di linfociti B dal tubo 6 e il controllo della purezza nella tabella.
- Nel menu"Statistiche"selezionare la frequenza delle celle CD45+ per testare la purezza di questa popolazione cellulare, quindi fare clic su "Crea tabella".
- I valori dei parametri vengono visualizzati in una nuova tabella. Nella finestra di controllo della purezza, controllare la frequenza dei linfociti B all'interno delle cellule CD45+, che dovrebbe essere superiore al 98% (vedere figura 2, pannello inferiore).
Il sistema immunitario protegge il corpo dall'invasione di agenti patogeni generando leucociti, chiamati anche globuli bianchi. Quando un agente patogeno infetta con successo un organismo, viene attivata un'ampia varietà di leucociti e questa reazione coordinata è chiamata risposta immunitaria.
Spesso, è utile per i ricercatori essere in grado di identificare il tipo specifico e il numero di cellule immunitarie che sono state attivate in risposta a un agente patogeno. La citometria a flusso è una tecnica che consente ai ricercatori di separare le cellule in base a specifici epitopi espressi sulle loro superfici. Ciò si ottiene utilizzando anticorpi monoclonali marcati con fluorocromo che si legano a epitopi specifici delle cellule immunitarie noti e, dopo l'eccitazione, questi fluorocromi legati emettono una lunghezza d'onda della luce che può essere rilevata e segnata da un citometro a flusso.
I citometri a flusso sono composti da tre sistemi. Il sistema fluidico trasporta le cellule in un flusso tale che passano davanti a un laser una per una. Il sistema ottico è composto da laser e rivelatori che riconoscono la presenza o l'assenza dei fluorofori. Infine, il sistema elettronico converte i dati ottici raccolti in file elettronici per l'analisi.
Un'estensione della citometria a flusso è il Fluorescence-Activated Cell Sorter, o FACS, che consente l'arricchimento di specifiche popolazioni cellulari in modo che possano essere studiate in modo indipendente. Lo smistamento cellulare viene effettuato utilizzando un ugello vibrante all'interno del flusso fluidico che forma micro goccioline, ciascuna contenente una singola cella. Quindi, un rilevatore determina se la luce fluorescente viene emessa o meno da ciascuna goccia e, in base a tali informazioni, un elettromagnete dà a ciascuna cella una carica negativa o positiva. Successivamente, un forte campo elettrico ordina le goccioline diversamente cariche in contenitori separati. In definitiva, uno dei contenitori conterrà una popolazione omogenea di cellule basata sull'espressione di una specifica molecola di superficie cellulare.
In questo video, imparerai come utilizzare la citometria a flusso per isolare i leucociti dal tessuto della milza del topo e FACS per selezionare i linfociti B.
Per iniziare, indossare guanti da laboratorio e gli indumenti protettivi appropriati. Quindi, lavare un paio di forbici e pinza da dissezione prima con detergente e poi con etanolo al 70% e quindi asciugarli con un tovagliolo di carta pulito.
Quindi, aggiungere 49 millilitri di Hank's Balanced Salt Solution, o HBSS, a un tubo da 50 millilitri. Aggiungere un millilitro di siero fetale per vitelli, o FCS, per creare una soluzione HBSS 2% FCS e mescolare delicatamente il pipettaggio su e giù circa 10 volte.
Quindi, posizionare un topo eutanasizzato in posizione supina su una piastra di dissezione. Con le forbici e la pinza, eseguire una laparotomia longitudinale per accedere alla cavità addominale. Utilizzare la pinza per spostare l'intestino sul lato destro dell'addome su un lato per esporre lo stomaco e la milza. La milza è attaccata allo stomaco. Quindi, con una pipetta, posizionare cinque millilitri di HBSS 2% FCS in una capsula di Petri. Usando la pinza, staccare con cura la milza dallo stomaco e posizionare la milza nella capsula di Petri.
Per isolare le cellule immunitarie, prima posizionare la milza su un colino cellulare da 40 micron in una capsula di Petri. Schiacciare la milza con uno stantuffo per dissociarla nel piatto. Quindi, pipettare la milza dissociata e il fluido dalla capsula di Petri in un tubo di centrifuga da 15 millilitri. Centrifugare il tubo a 370 volte g per sette minuti a 10 gradi Celsius e poi recuperare il tubo con attenzione in modo da non disturbare il pellet.
Ora, rimuovere il surnatante, evitando il pellet, e scartare il liquido in un contenitore di rifiuti appropriato. Quindi, aggiungere due millilitri di tampone di lisi ACK nel tubo della centrifuga per ricasospendare e lisi gli eritrociti. Attendere due minuti e quindi aggiungere HBSS 2% FCS per ottenere un volume totale di 15 millilitri. Ripetere la centrifugazione. Recuperare il tubo con attenzione ed scartare il surnatante. Rispendare nuovamente il pellet in cinque millilitri di HBSS 2% FCS.
Per contare le cellule riconsocie, diluire cinque microlitri della sospensione cellulare con cinque microlitri di Trypan Blue. Quindi, depositare delicatamente una goccia di cinque microliti di questa sospensione cellulare diluita tra il vetro di copertura e il vetrino Malassez. Ora, al microscopio con ingrandimento 40X, conta il numero di cellule presenti. Quindi, regolare la concentrazione cellulare a 10 a settima cella per millilitro aggiungendo il volume appropriato di HBSS 2% FCS.
Per macchiare le cellule immunitarie, iniziare etichettando sei tubi FACS da uno a sei. Quindi, trasferire 200 microlitri della soluzione cellulare in ciascuno dei sei tubi. Centrifugare questi tubi a 370 volte g per sette minuti a 10 gradi Celsius e rimuovere il surnatante.
Quindi, etichettare sei nuovi tubi FACS da uno a sei e pipettare 200 microlitri di HBSS 2% FCS in ciascuno. Preparare le sei nuove miscele di anticorpi aggiungendo la quantità appropriata di anticorpi a ciascun tubo secondo la tabella uno. Mix one è per cellule non macchiate senza aggiunta di anticorpi. Le miscele da due a cinque contengono ciascuna un singolo anticorpo diverso per le impostazioni di compensazione. Mix six contiene tutti e quattro gli anticorpi per le cellule multi-colorate da utilizzare per lo smistamento.
Quindi, trasferire queste miscele di anticorpi ai corrispondenti tubi FACS numerate. Incubare queste soluzioni per 20 minuti a quattro gradi Celsius o sul ghiaccio al buio. Quindi, aggiungere un millilitro di HBSS 2% FCS a ciascun tubo e quindi centrifugare di nuovo. Scartare il surnatante e quindi ricaspenare il pellet in 200 microlitri di HBSS 2% FCS. Infine, trasferire i pellet riconsospenati in nuovi tubi FACS etichettati.
Per eseguire FACS, accendere prima il sorter. Quindi, selezionare il menu del citometro e fare clic su avvio fluidico. Seguire le istruzioni visualizzate sullo schermo.
Nella scheda del flusso, fai clic sulla croce rossa per accendere il flusso, quindi attendi 15 minuti affinché il flusso si stabilizzi. Regola l'ampiezza del flusso fino a quando non viene visualizzata una chiara goccia staccata nella scheda del flusso. Quindi, fai clic su sweet spot per completare la regolazione dell'ampiezza. Inserire il filtro Neutral Density, o ND, 1.0 davanti al laser.
Apri il menu del citometro nella parte superiore dello schermo e seleziona CST, che sta per Cytometer Setup and Tracking. Per eseguire il controllo di qualità giornaliero, prima diluire le perle CST con il mezzo FACS in un tubo FACS seguendo le istruzioni del produttore. Quindi, caricare il tubo nella macchina ed eseguire il controllo CST facendo clic su Esegui nella scheda CST.
Al termine del controllo CST, sostituire il filtro ND 1.0 con il filtro ND 2.0 sul citometro. Quindi, diluire le perline di ritardo della caduta nel mezzo FACS seguendo le istruzioni del produttore e quindi caricare il tubo nel FACS. Per garantire un corretto smistamento, eseguire il ritardo di caduta facendo prima clic sulla tensione e quindi sul filtro ottico. Il quadrante destro del filtro ottico deve essere uguale al 100%, indicando che il 100% delle gocce sono registrate dalla macchina. Se necessario, regolare la vite laser rossa sul citometro a sinistra oa destra per ottenere il 100% nel quadrante destro. È importante assicurarsi che il flusso cada nel tubo di raccolta. Per fare ciò, eseguire un test sort facendo clic su waste drawer e quindi test sort. Controllare che i flussi laterali cadano nei tubi di raccolta. In caso contrario, regolare la tensione sotto la scheda di ordinamento fino a quando non lo fanno.
Passare al modello sperimentale selezionando la scheda del browser e facendo clic su visualizzazione condivisa. Quindi, apri l'esperimento delay Accudrop_DROP e fai clic sul pulsante di ordinamento del layout. Ora, modifica la velocità di soglia sul dashboard di acquisizione manipolando la portata fino a raggiungere 3.000 eventi al secondo. Fare clic su tensione e quindi su filtro ottico. Il quadrante sinistro deve essere uguale a zero e il quadrante destro uguale a 100.
Infine, nella finestra di ordinamento del layout, fare clic su Ordina e quindi su Annulla. Il quadrante sinistro deve essere uguale a 100 e il quadrante destro uguale a zero. Se il quadrante sinistro è inferiore a 95, fare clic su Ritardo automatico per indicare al software di aumentare automaticamente la tensione per ottenere il 100% delle cadute nel quadrante sinistro.
Per iniziare la citometria a flusso, utilizzeremo prima le cellule non macchiate per definire la morfologia cellulare e i picchi negativi dei fluorocromi. Per fare ciò, posizionare il tubo uno contenente celle non macchiate nella macchina e sotto la scheda del cruscotto di acquisizione fare clic su Load. Nella scheda citometro, regolare le tensioni di dispersione avanti e laterale fino a quando non si vede la popolazione cellulare come una densa concentrazione di punti sullo schermo. I linfociti sono piccole cellule, quindi avranno una bassa dispersione in avanti e una bassa dispersione laterale.
Quindi, rimuovere la fluorescenza di fondo regolando la tensione per i fluorocromi nella scheda del citometro fino a quando le popolazioni cellulari a un livello negativo sono nel primo decennio nella scheda del foglio di lavoro globale. Nel menu del citometro, fare clic su Visualizza configurazione e verificare che tutti i fluorocromi siano presenti. Quindi, posizionare il tubo due nel citometro e fare clic sul carico. Regolare la sovrapposizione spettrale nella scheda del citometro fino a quando le mediane di popolazione negative e positive non sono allineate nella scheda del foglio di lavoro globale. Nella scheda acquisizione impostare il parametro di registrazione degli eventi su 10.000 e fare clic su Record. Ripeti questi passaggi con i tubi tre, quattro e cinque.
Successivamente, caricare il tubo sei che contiene le celle multi-macchiate. Per isolare i linfociti B, impostare prima i parametri per ordinare le cellule in base alla loro morfologia. Nella prima finestra, tracciate l'area di dispersione in avanti FSC-A sull'asse y e l'area di dispersione laterale SSC-A sull'asse x. Nel grafico a dispersione, ogni punto rappresenta una cella. Fare clic su polygon gate nel foglio di lavoro globale e quindi selezionare la popolazione con una dispersione in avanti bassa e una dispersione laterale intermedia. In una nuova finestra di dot plot, fare clic con il pulsante destro del mouse sulla finestra e selezionare Mostra popolazioni dal menu e fare clic su P1.
Quindi, nella nuova finestra, gate le celle CD45 positive vitali tracciando la vitalità sull'asse y e CD45 sull'asse x. Utilizzare il gate poligonale per circondare le celle con una bassa vitalità e un segnale CD45 elevato e selezionare P2 per visualizzare le celle selezionate in una nuova finestra. Nella finestra successiva, cancello per i leucociti CD45 positivi, esclusi i linfociti T. Con CD45 sull'asse x e CD3 sull'asse y, circondare la popolazione con un segnale CD45 elevato e un segnale CD3 negativo basso e selezionare P3. Infine, gate per le cellule CD19 positive che identificano i linfociti B. Con CD19 sull'asse y e CD3 sull'asse x, circondare la popolazione con un segnale CD19 alto e un segnale CD3 basso negativo e selezionare P4.
Tutti i parametri di ordinamento sono ora impostati. Successivamente, nella finestra del layout di ordinamento, selezionare la popolazione cellulare di interesse- P4, che è la quarta popolazione che è stata chiusa, e dice alla macchina di ordinare solo i linfociti B. Imposta gli eventi target su 10.000 celle e imposta la precisione sulla purezza. Stiamo smistando solo una popolazione. Tuttavia, è possibile ordinare fino a quattro diverse popolazioni contemporaneamente. Una volta pronto, fare clic su Ordina e OK. Quindi, attendere l'ordinamento delle celle.
Una volta completata la selezione delle celle, eseguire un controllo di purezza pipettando 10 microlitri delle celle smisate in un nuovo tubo FACS con 90 microlitri di HBSS 2% FCS. Posizionare il tubo nel citometro, fare clic su carica e quindi fare clic su Registra per analizzare i fenotipi delle cellule per verificare che la strategia di gating abbia funzionato come previsto.
Ora, analizzeremo le cellule ordinate per determinare la percentuale di linfociti B tra i leucociti che sono stati isolati dalla milza del topo. Per iniziare, fai doppio clic sull'icona FlowJo e trascina i file per ogni tubo nella finestra di tutti i campioni.
Fare clic su poligono e ricreare le strategie di gating utilizzate nella sezione precedente. Quindi, fare clic su Editor layout e trascinare le popolazioni di linfociti B di interesse dal tubo sei e il controllo di purezza nella scheda editor di layout. Appariranno dot plot che rappresentano i linfociti B. In questo esempio, il grafico in alto a destra rappresenta i linfociti B ordinati dalla sospensione totale delle cellule della milza e il grafico in basso a destra è il controllo della purezza. Le cellule dovrebbero apparire solo nella popolazione di interesse nel controllo della purezza.
Per verificare la purezza dei linfociti B nelle cellule ordinate, fare clic sull'editor della tabella. Trascinare la popolazione di linfociti B dal tubo sei e il controllo della purezza nella tabella. Nel menu statistico, selezionare la frequenza delle cellule CD45 positive per testare la purezza di questa popolazione cellulare. Quindi, fai clic su Crea tabella. I valori dei parametri vengono visualizzati in una nuova tabella. Nella finestra di controllo della purezza, controllare la frequenza dei linfociti B all'interno delle cellule CD45 positive, che dovrebbe essere superiore al 98%.
Subscription Required. Please recommend JoVE to your librarian.
Results
In questo protocollo, abbiamo purificato i linfociti B splenici utilizzando la tecnologia FACS. Per prima cosa abbiamo isolato i leucociti dalla milza e li abbiamo macchiati. Utilizzando una combinazione di marcatori di superficie delle celle B, abbiamo creato una strategia di gating per ordinarli (Figura 2, pannello superiore). Alla fine dell'esperimento abbiamo verificato se le cellule nella provetta di raccolta erano cellule B tramite un "test di purezza". Abbiamo mantenuto la stessa strategia di gating e abbiamo osservato che oltre il 98% delle cellule erano effettivamente cellule B (Figura 2, pannello inferiore). Pertanto, FACS è un protocollo efficace per isolare le popolazioni di cellule immunitarie con un alto grado di purezza. Le cellule raccolte possono quindi essere utilizzate per esperimenti a valle come colture cellulari, RT-qPCR e saggi di citotossicità.

Figura 2: Strategia di Gating e test di purezza post-ordinamento. (A) Le cellule sono state prima recintate in base alla loro morfologia (a sinistra: FSC-A, SSC-A), poi solo vive (al centro a sinistra: vitalità, CD45), le cellule CD45+ (CD45, CD3) sono state tracciate contro CD19 e CD3. Solo le celle CD19+ sono state ordinate. (B) Risultati della prova di purezza di una frazione di cellule ottenuta dopo la cernita cellulare. Fare clic qui per visualizzare una versione più grande di questa figura.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
La citometria a flusso è una tecnica di prima mano per caratterizzare e ordinare le popolazioni di cellule immunitarie con un alto grado di purezza. È uno strumento primordiale in campo di ricerca in quanto consente l'arricchimento di specifiche popolazioni cellulari e di decifrare la risposta immunitaria ai patogeni. Con l'aumento del numero di fluorocromi e citometri disponibili, il numero di parametri rilevabili è notevolmente aumentato. Di conseguenza, l'analisi bioinformatica dei dati FACS ha iniziato ad emergere e ha aperto nuovi orizzonti alla citometria a flusso (3). La citometria a flusso offre altre applicazioni in ematologia e oncologia (4) dove viene utilizzata per lo sviluppo di strumenti diagnostici.
Subscription Required. Please recommend JoVE to your librarian.
References
- Lanier, L. L. Just the FACS. The Journal of Immunology, 193 (5), 2043-2044 (2014).
- Walker, J. M. Epiblast Stem Cells IN Series Editor.
- Tung, J. W., Heydari, K., Tirouvanziam, R., Sahaf, B., Parks. D. R., Herzenberg, L. A., and Herzenberg. L. A. Modern Flow Cytometry: A Practical Approach. Clinics in Laboratory Medicine. 27 (3), 453-468 (2007).
- Walker, J. M. Tumor Angiogenesis Assays IN Series Editor.




