Overview
Source: Meunier Sylvain1,2,3, Perchet Thibaut1,2,3, Sophie Novault4, Rachel Golub1,2,3
1 Unité de lymphopoiesis, Département d'immunologie, Institut Pasteur, Paris, France
2 INSERM U1223, Paris, France
3 Université Paris Diderot, Sorbonne Paris Cité, Cellule Pasteur, Paris, France
4 Flow Cytometry Platfrom, Cytometry and Biomarkers UtechS, Center for Translational Science, Institut Pasteur, Paris, France
Le transfert de cellules adoptives est une méthode pour introduire des cellules dans un patient ou un organisme d'étude afin de traiter une maladie ou d'étudier un processus biologique, tel que l'hématopoiesis. Les objectifs du transfert adoptif sont divers; il peut être utilisé en biologie fondamentale ainsi qu'en sciences médicales (1, 2). Dans les modèles murins, la migration et la distribution des cellules transférées peuvent être étudiées et suivies d'un système de suivi (marqueur de surface cellulaire, coloration par CFSE, etc.). Dans les études sur le cancer sur les modèles de souris, le transfert de populations cellulaires spécifiques peut être utilisé comme traitement expérimental contre les tumeurs. Un autre exemple pour cette technique est la création de souris chimériques par transfert de cellules de moelle osseuse à des souris irradiées ou des souris avec un phénotype d'immunodéficience grave. Ce modèle de souris peut être utilisé pour évaluer l'impact de la suppression des gènes sur une population cellulaire spécifique, par exemple. Le transfert des cellules d'emprunt d'os est également employé dans le traitement médical humain. Lorsque les patients sont irradiés en cas de traitement du cancer, le transfert adoptif de la moelle osseuse permet la reconstitution du système immunitaire.
La première étape de cette technique est d'obtenir la population cellulaire d'intérêt. La technique choisie pour isoler cette population dépend du niveau de spécificité de la population ciblée. Le plus grand niveau de sélection est l'organe entier, dans lequel toutes les populations cellulaires présentes dans l'organe sont prises. Une méthode plus précise est la sélection d'une population de cellules cibles, souvent sélectionnée par un marqueur de surface cellulaire. La méthode idéale pour trier les cellules dans ce cas est par tri magnétique. Enfin, le niveau le plus strict est le choix des cellules par plusieurs marqueurs de surface cellulaire pour trier des populations cellulaires très spécifiques. Le tri cytométrie de flux est la méthode la plus populaire pour ce niveau de sélection. Une fois que la population d'intérêt est obtenue, elle peut être transférée à l'hôte. Avant le transfert d'adoption, il est essentiel d'assurer la compatibilité entre l'hôte et le donateur. En effet, quel que soit l'objectif de transfert, la compatibilité est cruciale pour assurer l'adoption des cellules par l'hôte sans rejet de cellules.
Dans cet exercice de laboratoire, nous démontrons la technique de transfert de cellules adoptives en transférant des splenocytes d'une souris CD45.2 dans une souris CD45.1 Ragc (manquant de lymphocytes) et quatre jours plus tard confirment le transfert de splenocytes utilisant la cytométrie de flux (voir la figure 1 ).
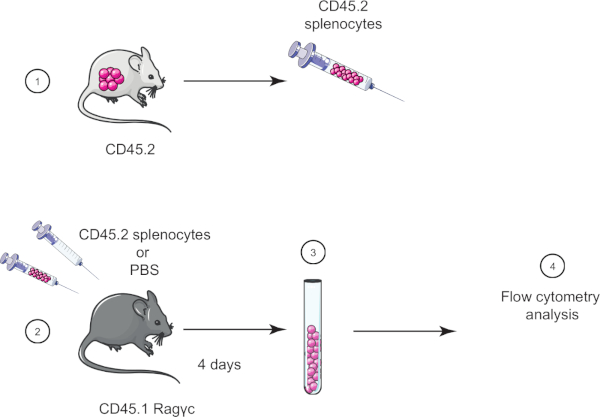
Figure 1 : Représentation schématique du transfert adoptif. (1) Les splenocytes sont isolés des souris CD45.2 et (2) transférés dans la souris CD45.1 Ragôc, la souris de contrôle est injectée avec PBS seulement. (3) 4 jours après le transfert adoptif, les splenocytes sont récupérés des souris et (4) analysés par cytométrie de flux. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Procedure
1. Préparation
- Avant de commencer, enfilez des gants de laboratoire et les vêtements de protection appropriés.
- Stériliser tous les outils de dissection, d'abord avec un détergent, puis avec 70% d'éthanol, puis sécher à fond.
- Préparer 50 ml de la solution de sel équilibrée de Hank (HBSS) contenant 2 % de sérum fœtal de veau (FCS).
2. Dissection
- À l'aide d'un système de distribution de dioxyde de carbone, euthanasiez la souris par hypoxie. Fixez la souris euthanasiée sur une plaque de dissection en position de supine et effectuez une laparotomie longitudinale à l'aide de ciseaux et de forceps.
- L'utilisation de forceps déplacer les intestins et l'estomac sur le côté droit de l'abdomen pour exposer l'estomac et la rate. La rate est attachée à l'estomac.
- À l'aide de forceps, détachez soigneusement la rate de l'estomac et placez-la sur le plat Petri contenant 5 ml de HBSS 2% FCS.
3. Isolement des cellules immunitaires
- Déposer la rate sur une passoire cellulaire de 40 m au-dessus du plat Petri. Écraser la rate avec un piston pour la dissocier.
- Récupérer les cellules adhérentes en rinçant le piston et la passoire avec 1 ml de HBSS 2% FCS.
- Transférer la rate dissociée et le liquide dans un tube centrifugeuse de 15 ml.
- Laver le plat Petri avec 5 millilitres de HBSS 2% FCS et transférer le liquide dans le tube de 15 ml.
- Centrifuger le tube à 370 x g pendant 7 min à 10oC et jeter le supernatant en évitant la pastille.
- Resuspendre la pastille dans 2 ml de pipide de chlorure d'ammonium de potassium de haut en bas pour resuspendre la pastille et lyser les érythrocytes.
- Attendez 2 min et ajoutez HBSS 2% FCS à la pastille remise en suspension pour obtenir le volume jusqu'à 14 ml.
- Centrifuger le tube à nouveau à 370 x g pendant 7 min à 10oC. Jeter le supernatant et resuspendre la pastille dans 5 ml de HBSS 2% FCS par pipetting de haut en bas.
- Comptez les cellules à l'aide de l'essai de coloration bleu trypan et ajuster la concentration cellulaire finale à 107 cellules/mL en utilisant le volume approprié de HBSS 2% FCS.
4. Transfert d'adoption
- Transférer 2 ml de suspension cellulaire obtenue dans un tube de collecte de 5 ml.
- Centrifuger le tube à 370 x g pendant 7 min à 10oC, puis jeter le supernatant.
- Resuspendre la pastille dans 2 ml de PBS et centrifuger le tube à 370 x g pendant 7 min à 10oC.
- Jeter le supernatant et resuspendre les granulés dans 200 L de PBS.
- À l'aide d'une seringue de 0,5 ml avec une aiguille de 29 G injecte 200 l de suspension cellulaire dans la souris expérimentale par voie intraveineuse dans le sinus sanguin rétro-orbital.
- En tant que contrôle, injectez une deuxième souris dans le même sinus sanguin avec 200 l de phosphate tamponné salin.
5. Récolte et coloration des cellules
- Quatre jours après le transfert d'adoption, euthanasiez les souris et enlevez la rate.
- Récoltez les splenocytes tels que décrits à la section 3.
- Transférer 100 l de suspensions cellulaires de chaque souris dans deux tubes FACS, étiquetés « contrôle » et « transféré ».
- Centrifuger le tube à 370 x g pendant 7 min à 10oC, puis jeter les supernatants.
- Préparer un mélange contenant les quatre anticorps aux dilutions énumérées dans le tableau 1.
| Anticorps | Fluorochrome | dilution |
| CD45.1 | BV711 (en anglais seulement) | 1/200 |
| CD45.2 | APCCy7 (en anglais) | 1/400 |
| CD4 (en) | BV786 (en anglais seulement) | 1/1600 |
| CD3 (en) | BV421 BV421 (bv421) | 1/200 |
Tableau 1 : Composition du mélange d'anticorps. Préparation de quatre cocktails d'anticorps utilisant des conjugates concentrés anticorps-fluorescents et HBSS.
- Ajouter 100 l de mélange à chaque tube, puis couver pendant 20 min sur glace dans l'obscurité.
- Ajouter 1 ml de HBSS 2%FCS, puis centrifuger les tubes à 370 x g pendant 3 min à 10oC.
- Jetez les supernatants et suspendez les granulés dans 200 L de HBSS 2% FCS.
- Transférer les cellules suspendues dans de nouveaux tubes FACS étiquetés.
- L'utilisation de la cytométrie de flux, comme indiqué dans le protocole FACS, évaluer la présence de lymphocytes positifs CD45.2.
6. Analyse des données
- Ouvrez le logiciel "FlowJo" et faites glisser les fichiers pour chaque tube dans la fenêtre "All sample".
- Double clic sur le fichier "transféré" pour afficher les cellules enregistrées à partir de cet échantillon sur une parcelle de point qui affiche la diffusion vers l'avant "SSC-A" sur l'axe Y et la diffusion latérale "FSC-A" sur l'axe X.
- Cliquez sur «polygone» et créez une stratégie de gating pour sélectionner les lymphocytes, puis distinguez les cellules du donneur et de l'hôte à l'aide de marqueurs de surface cellulaire (CD45.1, CD45.2), puis caractérisent la populationde cellules CD45.2 (CD3, CD4).
- Répétez les étapes d'analyse avec le fichier «souris de contrôle».
- Pour visualiser une population cellulaire, cliquez sur "Layout editor".
- Faites glisser les "cellules transférées" et les "cellules CD4 transférées" population de "transféré" et "contrôle" fichiers dans le " LayoutEditor tab".
- Une parcelle de point représentant les cellules CD45.2et les lymphocytes CD4 apparaîtra.
- Les cellules transférées CD45.2 ne doivent apparaître que dans la parcelle de point «souris transférée».
Le transfert de cellules adoptives est une méthode pour introduire des cellules d'intérêt dans un organisme. C'est une technique puissante pour étudier divers mécanismes biologiques, y compris l'action de classes spécifiques de cellules immunitaires. En outre, le transfert adoptif est un nouveau traitement prometteur pour de nombreuses affections, telles que celles nécessitant des greffes de moelle osseuse ou des traitements contre le cancer où les propres lymphocytes T d'un patient peuvent être extraits, modifiés pour reconnaître et détruire les cellules cancéreuses, et puis retourné au corps pour combattre des tumeurs.
En laboratoire, les modèles animaux sont souvent utilisés pour étudier le transfert adoptif. Par exemple, les souris Koilloutées CD45.1 Rag gamma-c n'ont pas de récepteurs fondamentaux pour de nombreuses cytokines, qui sont essentielles à la différenciation normale des cellules souches hématopoïétiques en lymphocytes. En conséquence, les souris knock-out ont un développement de lymphocytes compromis et n'ont pas de tueur naturel, ou NK, cellules, lymphocytes T, ou B-cellules.
Le transfert d'adoption peut être employé pour introduire les cellules immunitaires manquantes dans ces souris compromises, en récoltant d'abord le tissu de souris de distributeur contenant des concentrations élevées des cellules immunitaires, telles que la rate. Le tissu est ensuite dissocié et une variété de cellules de la rate, y compris les cellules immunitaires, sont isolées. Ensuite, les érythrocytes indésirables, ou globules rouges, peuvent être lysed par l'ajout de l'ammonium chlorure de potassium lysing tampon et les globules blancs restants, ou splenocytes, sont ensuite séparés des débris cellulaires en utilisant centrifugation.
Enfin, les splenocytes purifiés sont injectés dans les souris immunodéprimées, facilitant les études détaillées des fonctions de ces cellules. Plusieurs jours plus tard, le succès du transfert de cellules immunitaires adoptives peut être confirmé par l'isoler et la préparation des splenoncytes de l'hôte de la même manière que le tissu du donneur. Ensuite, ces cellules sont tachées à l'aide d'anticorps étiquetés contre les marqueurs des cellules immunitaires du donneur afin qu'ils puissent être vérifiés et triés à l'aide de FACS.
Pour commencer, mettez des gants de laboratoire et l'équipement de protection approprié. Ensuite, lavez une paire de forceps et disséquez les ciseaux d'abord avec un détergent, puis avec 70% d'éthanol, puis séchez-les avec un essuie-tout propre. Préparer 50 millilitres de Hank's Balanced Salt Solution, ou HBSS, avec 2% de sérum de veau fœtal, ou FCS, en combinant un millilitre de FCS avec 49 millilitres de HBSS dans un tube de 50 millilitres. Mélanger en pipeting doucement la solution vers le haut et vers le bas environ 10 fois.
Disséquez la souris euthanasiée et retirez sa rate comme démontré dans la technologie FACS de protocole vidéo de JoVE pour la séparation splénique de lymphocytes DeB. Pour isoler les cellules immunitaires, placez d'abord la rate sur une passoire à cellules de 40 micromètres dans un plat de pétri. Écraser la rate avec un piston pour la dissocier dans le plat. Récupérer les cellules adhérentes en rinçant le piston et la passoire avec 1 millilitre de HBSS 2% FCS. Ensuite, pipette la rate dissociée et le liquide de la boîte de Pétri dans un tube de centrifugeuse de 50 millilitres. Laver le plat de Petri avec 5 millilitres de HBSS 2% FCS et transférer le liquide dans le tube de 15 millilitres.
Centrifuger le tube à 370 fois g pendant sept minutes à 10 degrés Celsius, puis récupérer le tube avec soin afin de ne pas déranger la pastille. Maintenant, retirez le supernatant sans déranger la pastille et jetez le liquide dans un contenant de déchets approprié. Ensuite, ajoutez deux millilitres de chlorure d'ammonium de potassium tampon de lysation au tube de centrifugeuse et pipette de haut en bas pour resuspendre la pastille et lyser les érythrocytes. Attendez deux minutes, puis ajoutez HBSS 2% FCS à la pastille remise en suspension pour obtenir une valeur totale de 14 millilitres. Répétez la centrifugation. Récupérer le tube soigneusement et jeter le supernatant. Ensuite, resuspendre la pastille en 5 millilitres HBSS 2% FCS par pipetting de haut en bas. Ensuite, comptez les cellules en suspension. Ajouter cinq microlitres de trypan bleu à cinq microlitres de suspension cellulaire et bien mélanger par pipetting. Ensuite, déposez délicatement une goutte de cinq microlitres de suspension cellulaire diluée entre le verre de couverture et la glissière Malassez. Avec le microscope réglé à 40X grossissement, compter le nombre de cellules. Ajuster la concentration cellulaire à 10 aux sept cellules par millilitre en ajoutant le volume approprié de HBSS 2% FCS.
Pour commencer le transfert adoptif, transférer deux millilitres de la suspension cellulaire à un tube de collecte de cinq millilitres. Centrifuger le tube à 370 fois g pendant sept minutes à 10 degrés Celsius, puis jeter le supernatant. Ensuite, resuspendre la pastille en deux millilitres de phosphate tamponné saline et centrifuger le tube à 370 fois g pendant sept minutes à 10 degrés Celsius. Jetez le supernatant. Ensuite, resuspendre la pastille dans 200 microlitres de phosphate tamponné saline. À l'aide d'une seringue de 0,5 millilitre avec une aiguille de calibre 29, injectez 200 microlitres de suspension cellulaire dans la souris expérimentale par voie intraveineuse dans le sinus sanguin rétro-orbital.
Quatre jours après le transfert d'adoption, euthanasiez les souris et enlevez les rates. Ensuite, récoltez les cellules immunitaires telles que décrites dans la section trois. Ensuite, transférer 100 microlitres de suspension cellulaire de chaque souris dans deux tubes FACS étiquetés contrôle et transféré. Centrifuger les tubes à 370 fois g pendant sept minutes à 10 degrés Celsius, puis jeter les supernatants. Maintenant, préparez un mélange contenant les quatre anticorps à la dilution indiquée dans le tableau un. Ajouter 100 microlitres du mélange à chaque tube, puis couver pendant 20 minutes sur la glace dans l'obscurité. Ensuite, ajoutez un millilitre de HBSS 2% FCS à chaque tube, puis centrifugez les tubes à 370 fois g pendant trois minutes à 10 degrés Celsius. Jetez les supernatants, puis resuspendre les granulés dans 200 microlitres de HBSS 2% FCS. Transférer les cellules suspendues dans de nouveaux tubes FACS étiquetés. Maintenant, utilisez la cytométrie de flux comme indiqué dans le protocole FACS pour évaluer la présence de CD45. 2 lymphocytes positifs.
Maintenant, nous allons déterminer la présence de lymphocytes CD45.2 qui ont été isolés du CD45. 1 rate hôte. Pour commencer, cliquez deux fois sur l'icône FlowJo et faites glisser les fichiers pour chaque tube dans la fenêtre de l'échantillon. Ensuite, double clic sur le fichier transféré pour afficher les cellules enregistrées à partir de cet échantillon sur une parcelle de point qui affiche la diffusion vers l'avant FSCA sur l'axe X et la diffusion latérale SSCA sur l'axe y. Cliquez sur le polygone pour faire le tour des populations de lymphocytes. Une nouvelle fenêtre d'identification du sous-population apparaît. Cliquez sur OK. Maintenant, fixez l'axe y à FSC-W et l'axe x à FSC-A. Sélectionnez la population de cellules individuelles avec l'outil de polygone comme précédemment démontré.
Ensuite, double clic sur la population encerclée pour créer une nouvelle fenêtre pour les cellules sélectionnées. Dans la nouvelle fenêtre, sélectionnez CD45.2 sur le Y et le CD45.1 sur l'icône X. Cliquez sur l'icône T et personnalisez l'axe pour agrandir l'intrigue. Ensuite, cliquez sur le polygone pour encercler les cellules positives CD45.2. Dans la fenêtre d'identification de la sous-population, nommez vos cellules transférées par la population cellulaire et cliquez sur OK. Dans la même fenêtre, cliquez sur rectangle pour sélectionner les cellules négatives CD45.2. Dans la fenêtre d'identification de la sous-population, nommez les cellules hôtes de votre population cellulaire et cliquez sur OK. Ensuite, double clic sur la population encerclée CD45.2, population transférée, pour créer une nouvelle fenêtre pour les cellules sélectionnées. Dans la nouvelle fenêtre, sélectionnez CD3 sur le Y et le CD4 sur le X.
Ensuite, cliquez sur le polygone pour encercler les cellules positives CD4 CD3. Dans cette fenêtre d'identification de sous-population, nommez votre population cellulaire transférée cellules CD4. Ensuite, répétez les étapes d'analyse précédentes avec le fichier de souris de contrôle. Enfin, pour visualiser vos populations cellulaires, cliquez sur Layout Editor. Faites glisser les cellules transférées et la population de cellules CD4 transférées des fichiers transférés et de contrôle dans l'onglet Rédacteur de mise en page. Une parcelle de point représentant les cellules positives CD45.2 et les lymphocytes CD4 apparaîtra. CD45. 2 cellules transférées ne doivent apparaître que dans la parcelle de point de souris transférée.
Subscription Required. Please recommend JoVE to your librarian.
Results
Les souris de Ragc ont une composition altérée de système immunitaire, manquant principalement des lymphocytes. Le transfert adoptif des splenocytes permet l'introduction d'une population manquante comme les cellules T et B. Notre coloration comprenait des marqueurs de surface cellulaire CD45.1 et CD45.2 pour distinguer respectivement les cellules hôtes et donneurs (figure 2A). Il comprenait également d'autres marqueurs de surface cellulaire pour mettre en évidence les populations cellulaires absentes chez les souris de Ragc, telles que les lymphocytes T CD4(figure 2B). Comme prévu, la souris de contrôle n'avait pas de cellules CD45.2-positives(figure 2B, panneaux supérieurs) et la souris transférée a fait (Figure 2B, panneaux inférieurs, 71,2% du total des cellules). Nous pourrions également détecter spécifiquement les lymphocytes T CD4 dans les cellules transférées (22,1% des cellules CD45.2).

Figure 2 : Résultats représentatifs du transfert d'adoption. (A) Histogrammes de cellules CD45.2 provenant de souris injectées avec PBS (groupe témoin) (en pointillé) et de souris injectées avec des splenocytes CD45.2 (groupe d'essai) (ligne solide). (B) Stratégie de gating des cellules CD45.2-positives chez les souris témoins injectées avec PBS (panneaux supérieurs) et les souris injectées avec des splenocytes CD45.2 (panneaux inférieurs). Les cellules de donneur et d'hôte sont distinguées utilisant des marqueurs de surface cellulaire (CD45.1, CD45.2), puis la population de cellules CD45.2-positive sont caractérisées (CD3, CD4). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Subscription Required. Please recommend JoVE to your librarian.
Applications and Summary
Le transfert d'adoption est une technique translationnelle dans différents domaines de la science, avec des applications en médecine. Cette technique peut être utilisée pour étudier la migration cellulaire et le tropisme ou l'incidence de carence en protéines dans des populations cellulaires spécifiques. Dans le dernier cas, différentes technologies peuvent être utilisées, en particulier les souris OGM où des populations cellulaires spécifiques sont intrinsèquement déficientes. Cependant, la construction génétique pour obtenir des souris OGM peut être un processus très complexe et long. Dans ce cas, le transfert adoptif de la population cellulaire déficiente est plus facile et plus rapide.
Les transferts d'adoption ont des applications directes en médecine. Par exemple, les greffes de moelle osseuse chez les patients irradiés pendant le traitement du cancer sont utilisées pour reconstituer le système immunitaire. Récemment, d'autres applications de transfert adoptif ont été utilisées dans le domaine médical. Les lymphocytes T artificiels (appelés cellules T CAR) sont conçus pour reconnaître et éliminer certains cancers. En outre, ces cellules d'ingénierie sont construites pour amortir le risque de rejet par l'hôte. Le transfert des lymphocytes T CAR est actuellement testé dans le cas d'essais cliniques.
Subscription Required. Please recommend JoVE to your librarian.
References
- Restifo, N. P., Dudley, M. E. and Rosenberg., S. A. Adoptive immunotherapy for cancer: harnessing the T cell response. Nature reviews. Immunology, 12 (4): 269-281, (2012).
- Bonini, C., and Mondino, A. Adoptive T-cell therapy for cancer: The era of engineered T cells. European journal of immunology, 45 (9): 2457-69, (2015).




