ERRATUM NOTICE
Important: There has been an erratum issued for this article. Read more …
Summary
פרוטוקול זה מדגים אולטרסאונד רובוטי (ארה"ב) כחלופה מעשית, חסכונית ומהירה לשיטות תמונה מסורתיות לא פולשניות.
Abstract
שיטות נפוצות להדמיית ויוו של מכרסמים כוללות טומוגרפיה של פליטת פוזיטרונים (PET), טומוגרפיה ממוחשבת (CT), הדמיית תהודה מגנטית (MRI) ואולטרסאונד (ארה"ב). לכל שיטה מגבלות ויתרונות, לרבות זמינות, קלות שימוש, עלות, גודל ושימוש בקרינה מייננת או בשדות מגנטיים. פרוטוקול זה מתאר את השימוש בארה"ב רובוטית תלת-ממדית להדמיית ויוו של כליות מכרסמים ולב, ניתוח נתונים עוקב ויישומי מחקר אפשריים. יישומים מעשיים של ארה"ב רובוטית הם כימות נפח הכליות הכולל (TKV), כמו גם מדידת ציסטות, גידולים וכלי דם. למרות שהרזולוציה אינה גבוהה כמו שיטות אחרות, ארה"ב הרובוטית מאפשרת איסוף נתונים מעשי יותר של תפוקה גבוהה. יתר על כן, באמצעות הדמיה במצב M בארה"ב, תפקוד הלב עשוי להיות מכמת. מאז הכליות לקבל 20%-25% של תפוקת הלב, הערכת תפקוד הלב הוא קריטי להבנת פיזיולוגיה של הכליות ופתולוגיה.
Introduction
השיטות הנפוצות ביותר להדמיית מכרסמים ב- vivo כוללות טומוגרפיה של פליטת פוזיטרונים (PET), הדמיה אופטית (OI), טומוגרפיה ממוחשבת (CT), הדמיית תהודה מגנטית (MRI) ואולטרסאונד (ארה"ב). טכניקות אלה מספקות רזולוציה גבוהה בתמונות vivo, ומאפשרות לחוקרים להעריך כמותית ולעקוב לאורך מודלים של מחלות באופן לא פולשני1. בעוד שלכל שיטת הדמיה יש מגבלות, הן מספקות גם כלים יקרי ערך למחקר פרה-קליני.
כאן, המחקר מפרט מערכת אמריקאית ומציג את הפרוטוקול להדמיית מכרסמים רובוטיים ותלת-ממדיים. גלי ארה"ב מיוצרים על ידי גשושית הנקראת מתמר, אשר בדרך כלל מוחזק ביד. גלי קול משתקפים בחזרה כשהם מתקשרים עם רקמות, וההדים משוחזרים לתמונות2. הפרוטוקול המתואר כאן יתמקד בהדמיית כליות ולב באמצעות מתמר בשליטה רובוטית ושימוש בתוכנה המאפשרת שחזור תלת-ממדי מהיר להערכה כמותית.
ארה"ב הרובוטית היא שיטת הדמיה מהירה, אמינה ולא פולשנית המאפשרת לחוקרים לבצע מחקרים בעלי תפוקה גבוהה ואורך. בהשוואה לשיטות אמריקאיות ידניות, השיטה הרובוטית של ארה"ב יעילה בזמן, שכן ניתן לסרוק עד שלושה בעלי חיים תוך דקות ספורות. תפוקה גבוהה עבור מדידות כליות עולה כי עד 20 עכברים לשעה ניתן לדמיין. המתמרים הרובוטיים ממוקמים מתחת לממברנות האקוסטיות ונעים באופן עצמאי מבעל החיים עם שתי דרגות חופש (איור 1A). הדבר מאפשר למשתמשים מתחילים להשיג תמונות באיכות גבוהה, בעוד ששיטות אמריקאיות ידניות רגישות יותר לשגיאות משתמש. התוכנה המשולבת מאפשרת שחזור כליות תלת-ממדי יעיל בזמן אמת. בעבר, הדמיית תהודה מגנטית (MRI) הייתה שיטה נפוצה להדמיה לא פולשנית בשל ניגודיות מעולה של רקמות רכות, חוסר רדיואקטיביות ועומק חדירה. עם זאת, MRI דורש לעתים קרובות זמני רכישה ארוכים והוא יקר לביצוע. ארה"ב הוערכה כחלופה אמינה ומהירה יותר ל- MRI בהערכת נפח הכליות הכולל (TKV)3.
Protocol
כל השלבים בפרוטוקול זה תואמים את מאיו קליניק (רוצ'סטר, MN) בעלי חיים להשתמש בהנחיות ואושרו על ידי מאיו קליניק מוסדי טיפול בבעלי חיים ושימוש הוועדה.
1. מודל בעלי חיים
- להשיג עכברים ממקורות מסחריים.
הערה: C57BL/6J (גיל = 18 חודשים; n = 22 (7 זכרים, 15 נקבות)) (טבלת חומרים) ו- Pkd1 (גיל = RC/ RC) (גיל = 18 חודשים; n = 9 (3 זכרים, 6 נקבות))4 שימשו למחקר.
2. הסרת שיער
- להרדים את החיה באמצעות איזופלוריין מתאדה (2%-3%) בתא הרדמה. ודא שהחיה מורדמת מספיק על ידי ביצוע צביטת בוהן. ודא כי העכבר נושם בקצב של כ 60-90 נשימות / דקה ללא בולע אוויר ברור.
הערה: איזופלוריין מתאדה נבחר בשל היכולת לשלוט ולהתאים את רמת ההרדמה של החיה. איזופלוריין מעורבב עם 100% חמצן נוצל. - השתמש בתער חשמלי כדי לגלח את אזור העור הרצוי למדידות בארה"ב.
הערה: במחקר זה, ההתמקדות היא במדידות כליות ולב, כך שהחזה והגב של החיה גולחו. - יש למרוח את הקרם המגולח על העור המגולח של בעל החיים בעזרת אפליקטור עם קצה כותנה. מנגבים את השמנת לאחר 30-60 שניות באמצעות מגבת נייר יבשה. לאחר מכן, להמשיך לנגב את שאריות קרם depilatory באמצעות רפידות גזה רטובה. ודא שהסרת השיער הושלמה לפני תחילת הסריקות.
הערה: כל שיער שנותר יפריע לאיכות התמונה; הסרת שיער מלאה היא קריטית. עם זאת, יש צורך לנגב את קרם depilatory את בתוך דקה כדי למנוע פגיעה בעור של החיה. שאריות קרם depilatory על החיה יכול להכתים את קרום ההדמיה של המכונה האמריקאית. להבטיח ניקוי נאות של החיה באמצעות רפידות גזה רטובה.
3. מיצוב בעלי חיים
- הפעל את המכונה האמריקאית ואת המתג עבור גוף החימום הפנימי עבור המפרצים בארה"ב. הפעל את שסתומי ההרדמה המתאימים עבור מפרצי ארה"ב המתאימים שישמשו.
הערה: יש להפעיל את המכונה האמריקאית לפני הפעלת תוכנת ההדמיה האמריקאית. - מלא את המפרצים עם מספיק מים כדי לכסות את הממברנה. מניחים את החיה מרדימה בקונוס האף.
- עבור מדידות לב, למקם את החיה בתנוחה נוטה זווית זה כ 30° ימינה.
- עבור מדידות כליות, למקם את החיה במצב ישר עליז. שיטחו בעדינות את גוף החיה כדי למזער את כיסי האוויר בין החיה לממברנה (איור 1B).
הערה: הפעלת אצבע לצד גוף החיה יכולה להסיר כל בועות אוויר הנצמדות לעור, מה שיפריע להדמיה. השתמש במים או ג'ל מלוחים בארה"ב כמדיום ארה"ב; אבל מים מקלים על ההדמיה המהירה שנידונה כאן.
4. מדידות אולטרסאונד
- בתוכנת הדמיה בארה"ב, בחר רכישה בארה"ב ואפשר למכשיר לאתחל.
- הדמיית כליות במצב B.
- הזן שם עבור המחקר בתיבת הדו-שיח המתאימה.
- הזן את מזהה החיה בתיבת הדו-שיח המתאימה.
הערה: ניתן לדמיין עד שלוש בעלי חיים ברצף. - לחץ על הכרטיסייה שכותרתה 3D כדי לאתחל סריקה 3D.
- באמצעות הזנת המצלמה החיה, הזז את תיבת אזור העניין (ROI) כדי להכיל את הכליות.
הערה: ניתן להתאים את גודל ההחזר על ההשקעה בהתאם לגודל יעד התמונה. הגדלת ההחזר על ההשקעה תגדיל במעט את זמן הסריקה (איור 1C). בהתאם לגודל ההחזר על ההשקעה, הסורק יתאים באופן אוטומטי את מספר המעברים הדרושים למתמר כדי לסרוק את ההחזר על ההשקעה כולו. - בהתאם לסוג התמונה הרצוי, בחרו 'מערך ליניארי' או 'קשקשן', כדי לבחור את המתמר. בחר מתוך סריקה מהירה או ממוטב עבור מתמר אחד מהם.
הערה: המערך הליניארי מהיר יותר ובדרך כלל מספק הדמיה נאותה. מתמר מתנדנד ניתן להשתמש אם אין אפשרות לרכוש את איכות התמונה הרצויה עם המערך הליניארי. מתמר הנדנדה משתמש באורך גל בתדר גבוה יותר ולכן מספק הגדרה נוספת בתמונות. האפשרות 'סריקה מהירה' רוכשת תמונות באיכות בינונית ללא תיקון נשימה במהירות גבוהה יותר. בעוד שהאפשרות 'ממוטב' דורשת מעט יותר זמן, היא מספקת איכות תמונה טובה יותר ומאפשרת תיקון נשימה. כתב יד זה יתמקד בשימוש בקביעה המוגדרת מראש של המערך הליניארי הממוטב. - לחץ על התצוגה החיה כדי לראות תמונה חיה של אזור הצפייה הרצוי.
- כדי להזיז את המתמר, לחץ על לחצן מעבר אל המעגלי ולאחר מכן לחץ על אזור העכבר לצילום. השתמש בחצים הכיווניים עם גדלי צעדים קבועים מראש כדי להתאים היטב את מיקום המתמר.
- לחץ על החץ בצד החלון של לוח הבקרה כדי לפתוח את מגש ההגדרות. לחץ על פרוטוקול סריקה כדי לפתוח את הגדרות הסריקה.
- קבעו את עומק המוקד האידיאלי והתאמו את המחוונים עבור TGC (פיצוי רווח זמן) כדי לשנות את ניגודיות התמונה כדי להציג בצורה הטובה ביותר את הכליות. לאחר השגת ההגדרות הרצויות, לחץ שוב על החץ כדי לסגור את מגש ההגדרות.
- לחצו על הלחצן 'השג סטטי ' כדי להתחיל בסריקה תלת-ממדית.
הערה: התקדמות הסריקה מסומנת באמצעות מד התקדמות בפינה הימנית התחתונה של התוכנה. - לאחר השלמת הסריקה, בדוק את איכות התמונה על-ידי לחיצה על חץ ההורדה הכחול כדי לפתוח את הסריקה במצב תצוגה מקדימה. עברו בין המסגרות התלת-ממדיות של הסריקה על-ידי גרירת החץ האדום בחלק העליון של החלון. כדי להגדיל או להקטין את התצוגה, החזק את מקש Ctrl לחוץ והשתמש בלחצן הגלילה בעכבר.
- כדי לסרוק בעלי חיים נוספים, רענן את תיבות הדו-שיח של מזהה בעלי חיים, הזן את המזהים החדשים ולאחר מכן חזור על השלבים לעיל.
הערה: לאחר השלמת הסריקות, ייבשו את החיות והחזירו אותן לכלובי הבית שלהן.
- הדמיית לב באמצעות מצב M.
הערה: מצב M הוא התצוגה של גל אולטרסאונד לאורך קו אולטרסאונד ספציפי, נבחר.- לחץ על הכרטיסייה מצב M כדי להפעיל הדמיה לבבית.
הערה: ניתן לצלם רק חיה אחת בכל פעם. - ודא כי החיה נמצאת במצב המתאים לסריקות לב (שלב 2.2). העבר את ההחזר על ההשקעה למיקום המשוער של הלב.
- לחץ על כפתור מאתר הלב כדי לאתר את הלב. השתמש במפת החום כדי למטב את מיקום המתמר. השתמשו בלחצן ' עבור אל ' המעגלי כדי להזיז את המתמר לחדר השמאלי (איור 2A).
- עבור אל Live View והשתמש בלחצני החצים כדי למקם את המתמר בין שרירי הפפילרי (איור 2B). כדי לאמת את המיקום המתאים של המתמר, הצג את המעקב החי אחר מצב M (איור 2D).
- לאחר המתמר נמצא במצב המתאים, לחץ על רצף רכישה. לחץ על חץ ההורדה הכחול כדי להציג את הסריקה שהושלמה.
- לחץ על הכרטיסייה מצב M כדי להפעיל הדמיה לבבית.
5. ניתוח כליות (מכניקה של ניתוח)
- פתח את הכרטיסיה ניתוח תמונות ובחר בלחצן טען אמצעי אחסון כדי להזין את הקבצים/התיקיות של התמונה.
- פילוח
- הזז את הקווים הצבעוניים המייצגים מישורים שונים כדי למצוא את הכליה בכל המטוסים.
- לחץ על הוסף כדי להוסיף פילוח חדש. ספק שם סימון עבור הקובץ.
- השתמש בלחצן Surface Cut כדי להוסיף נקודות סביב הקצה החיצוני של הכליה במישורים מרובים. לחצו על 'החל' כדי ליצור פילוח דרך הכליה כולה (איור 3A).
- גלול בין המסגרות השונות בכל מישור וערוך אזורים לא מדויקים על-ידי לחיצה על ערוך וגרירת הנקודות למיקום הנכון.
- לחלופין, אם הכליה אינה סדירה בצורתה, השתמש בפונקציה Draw כדי ליצור עקבות בצורה לא סדירה סביב הכליה. לחץ על נקודות מסביב לקצה או החזק את הלחיצה השמאלית כדי לצייר את המעקב ביד חופשית.
- כדי להשלים את המעקב באמצעות לחצן צייר , לחץ באמצעות לחצן העכבר הימני. גלול קדימה מסגרות מרובות וחזור על תהליך המעקב.
- חזור על הפעולה עד לאיתור המסגרות בכל אזור העניין.
- אם נעשה שימוש בפונקציה Draw , בחרו 'מלא בין פרוסות' כדי לבדוק ולהתאים את המעקב. לחץ על Initialize כדי לראות תצוגה מקדימה. אם התצוגה המקדימה מקובלת, לחץ על החל. אם לא, לחץ על ביטול ושנה את המעקבים.
הערה: לחצן מחק יאפשר מחיקה של אזור בתוך מעקב. לחצן החלקה מחליק את הקצוות המשוננים של עקבות. - כאשר ניתוח תמונה משביע רצון, בחר שמור כדי לשמור את הניתוח בקובץ התמונה המקורי.
- מדידה
- השתמש בפונקציה Calipers כדי למדוד תכונות בתוך התמונה. לחצו על כפתור Calipers ולחצו לחיצה שמאלית על שתי נקודות המרחק שיש למדוד (איור 3B).
- שמור את המדידה על-ידי לחיצה על לחצן הדיסק בחלק העליון של המסך.
- פילוח
6. ניתוח לב
- בחר טען אמצעי אחסון כדי להזין את הקבצים לניתוח.
- בחר באפשרות הוסף .
- השתמשו בכלי מיקום נקודות כדי לעקוב אחר הסיסטולית והדיאסטולה עבור כל שכבה של רקמת הלב. המשך עם השכבות האחרות של רקמת הלב. השתמש בפונקציה Edit כדי לשנות את המעקבים (איור 2C,D).
הערה: אם המעקב במצב M ברור מאוד, השתמש בלחצן הוסף (אוטומטי) כדי ליצור מעקבים באופן אוטומטי של כל שכבה. - בחר החל כדי לחשב את פרמטרי הלב. הצג את הכרטיסיה כימות ובחר יצא סטטיסטיקה כדי לייצא את כל הנתונים כקובץ *.csv (איור 2E).
Representative Results
תוצאות ניתוח כליות
שטח הפנים ונתוני נפח נרכשים מהפילוח של הכליות. מידע זה יכול לשמש כדי להשוות מודלים ניסיוניים ושליטה או לעקוב אחר שינויים לאורך זמן. הכלי Calipers שימושי למדידת חריגות במהירות (כלומר, ציסטות, גידולים) וכיצד הן משתנות באורך לאורך לאורך זמן. איור 3 מצביע על כך שניתן להשתמש הן בשיטות הפילוח והן בשיטות הקליפר כדי למדוד במדויק את נפחי הציסטה. איור 4 מדגים הבדל ברור בנפח הכליות הכולל (TKV) בין שליטה מותאמת גיל לעכברים ניסיוניים (Pkd1RC/RC). תצוגה חזותית תלת-ממדית של עיבודי אמצעי אחסון אלה עשויה להתבצע בתוך המערכת, כולל סיבובים בתוך שטח תלת-ממדי (איור 5). שחזורים תלת-ממדיים אלה משמשים לאחר מכן לחישוב TKV (mm3; איור 4) כמו גם נפח ציסטה גדול בודדים.
תוצאות של ניתוח לב
פרמטרים שימושיים רבים נרכשים מהניתוח של תמונות מצב M. נתונים אלה מספקים תמונה טובה של תפקוד הלב בחדר השמאלי (LV) באותה נקודת זמן. תפוקת הנתונים כוללת קוטר פנימי של LV, קיר אחורי LV, קוטר קיר קדמי LV, שבר פליטה, קיצור שברים, נפח שבץ, קצב לב, תפוקת לב, נפח LV ומסת LV. ההצלחה של ניתוח לב תלויה בפילוח מדויק של השכבות בתמונת מצב M. רוב תוצאות הלב וכלי הדם מחושבות על ידי השלבים הסיסטוליים והדיאסטוליים שיא של השכבות האנדוקרדיות האחוריות והחזית. השכבה האפיקדיאלית האחורית נראית לבנה בהירה ועוקבת אחר תבנית דומה לשכבה האנדוקרדית האחורית. המעקב אחר השכבה האנדוקרדית האחורית צריך להיות ממוקם על קווי המתאר הנמוכים ביותר. יש לעקוב אחר השכבה האנדוקרדית הקדמית לאורך קווי המתאר הגבוהים ביותר של שכבה זו. השכבה האפיקארדית הקדמית מופיעה ליניארית בתחתית התמונה בשל המיקום הנוטה של החיה (איור 2D). איור 6 מראה דוגמה למחקר אחד ללא הבדל משמעותי בתפוקת הלב בין עכברים ניסיוניים לעכברים בעלי בקרה. כמו עם הדמיה כליות, הדמיה לב 3D אפשרי. עם זאת, הדמיה 4D של מחזור הלב (איור משלים 1) מאפשרת לחוקר לדמיין ולהצביע על חריגות מורפולוגיות ודינמיות מחזוריות בחיה המוערכת.
הערכת מורפולוגיה
להערכה מהירה וזולה, ארה"ב יכולה לפקח ביעילות על פרמטרים פיזיולוגיים לאורך. עם זאת, מחקרים רבים רוצים גם לקבוע מאפיינים מורפולולוגיים עדינים יותר, למשל, מספר וגדלים של ציסטות, הסתיידויות (אבנים בכליות), כלי דם, או מידת פיברוזיס. איור 7 משווה כליה רגילה של עכבר לכליית עכבר ציסטי לכליית עכבר מסוידת בינונית. על ידי הגדלת התדירות המרכזית של ארה"ב (10 מגה-הרץ עם המערך הליניארי) ל-35 מגה-הרץ (מגבר מתנדנד), ניתן לקבל תמונות של פרטים הולכים וגדלים.

איור 1: מערכת אולטרסאונד ומיקום עכבר. (א) דיאגרמה של מערכת אולטרסאונד ומיקום של מתמרים. (ב) מבט על עכברים בתנוחה סופית על פלטפורמת אולטרסאונד. (ג) דוגמה לאזור העניין (ROI) במקום לאזור העניין (כליות) עם תעודות זהות של בעלי חיים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 2: הדמיית אולטרסאונד לב כדי להשיג פרמטרים פיזיולוגיים. (א) שימוש בתמונת מפת החום של מאתר הלב כדי למקם את המתמר בחדר השמאלי להדמיית M-Mode. מיקום המתמר בחדר השמאלי מצוין על ידי הנקודה הירוקה הגדולה. (B) מבט על המתמר כאשר הוא ממוקם כראוי מעל שרירי הפפילרי (קופסה מנוקדת). (ג) תצוגה לדוגמה של שכבות הדרושות למדידת פרמטרי לב. (D) תצוגה של תמונת M-Mode חיה עם שכבות המיועדות כמו בחלונית C. (שכבות מלמעלה למטה: אפיקארדיאל אחורי, אנדוקרדיאלי אחורי, אנדוקרדיאלי קדמי ואפיקדיאלי קדמי.) (ה) פלט לדוגמה של סטטיסטיקה הנוצרת ממדידות לב. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: שימוש בכלי פילוח וכיול למדידת כליות וציסטות. (A) פילוחים לדוגמה (תצוגה צירית) של שתי הכליות (הצללה כחולה וכתומה) וציסטה גדולה (צהובה) עם כרכים המפורטים להלן. תצוגות שאינן מפולחות מוצגות מתחת, כך שניתן יהיה להציג את ארה"ב ללא הפרעה. (ב) שימוש לדוגמה בקליפרים כדי למדוד את אותה ציסטה (תצוגה קשתית) מאיור 3A עם מדידות להלן. אמצעי האחסון חושב באמצעות הנוסחה עבור אליפסה (אמצעי אחסון = (4/3)π x x x b x c, כאשר a, b, c הם יחסיים x, y, z, בהתאמה). לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 4: התפלגות TKV של כליות WT ועכבר ציסטי. ייצוג טלוויזיות עבור עכברים מסוג בר (WT) (C57BL/6J) ועכברים חולים (Pkd1RC/RC). n = 22 (WT) n = 9 (Pkd1RC/RC); תוצאות של בדיקת t דו-זנבית: p < 0.0001. הקופסה מציגה ערכי אחוזון 25-75 ושפם להראות 1.5 פעמים טווח interquartile. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 5: שחזור תלת-ממדי מונפש של כליות וציסטה מפולחות. באמצעות התוכנה, התחזיות התלת-ממדיות של הכליות והציסטה עשויות להסתובב או להתנדנד בחלל התלת-ממדי (כחול = כליה שמאלית; צהוב = ציסטה גדולה; כתום = כליה ימנית). אנא לחץ כאן כדי להוריד נתון זה.

איור 6: פרמטרים פיזיולוגיים של הלב מהמדידות בארה"ב. ייצוג של תפוקת לב (mL / min) עבור WT ומחלות (Pkd1RC / RC) עכברים. n = 22 (WT) n = 9 (Pkd1RC/RC). הנתונים המסומנים בטבלציות הנמוכות יותר מראים כי אין הבדל משמעותי עבור שתי קבוצות אלה בשבר פליטה, נפח שבץ, קצב לב (HR) או תפוקת לב (CO). תוצאות של בדיקת t דו-זנבית: p > 0.05. התיבה מציגה ערכי אחוזון 25-75. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 7: השוואה בין מקטעי קשתות בארה"ב של פתולוגיות רגילות ושתי פתולוגיות. (A) זן כליות מסוג בר (C57BL/6J) (TKV = 143.202 מ"מ3). (B) כליה ציסטית עם TKV מוגבר (עכבר Pkd1RC/RC ) (TKV = 333.158 mm3). ציסטות מסומנות על ידי חצים צהובים. (C) כליות עם הסתיידויות וסקולריות (דגם = לקוי קולטן ליפופרוטאין בצפיפות נמוכה, עכבר Apolipoprotein B100 בלבד האכיל דיאטה מערבית במשך 12 חודשים5) (TKV = 127.376 mm3). אבני כליות מסומנות על ידי חצים ירוקים. לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור משלים 1: סרט מחזור לב 4D ממדידות בארה"ב. באמצעות התוכנה, ייצוג של הלב הפועם נלכד בארה"ב 3D ומוקרן דרך מחזור הלב. החץ הירוק מציין את שסתום אבי העורקים. (דגם = לקוי קולטן ליפופרוטאין בצפיפות נמוכה, עכבר Apolipoprotein B100 בלבד, האכיל דיאטה מערבית במשך 12 חודשים5). מודל זה מייצר הסתיידויות וסקולריות המאפשרות הדמיה קלה יותר של הלב והשסתומים בשל רפלקטיביות אקוסטית גדולה יותר של הסתיידויות בארה"ב. שחזורים 4D דומים אפשריים עם עכברי WT; עם זאת, הניגוד האקוסטי שנתפס לא יהיה גבוה כל כך. נא לחץ כאן כדי להוריד קובץ זה.
Discussion
אולטראסאונד משתמש בגלי קול, וכל מחסומים להתפשטות גלי קול יפריעו לאיכות התמונה. לכן, הסרת שיער מלאה של האזור להיות בתמונה היא קריטית. חשוב גם להבטיח הסרה מלאה של קרם depilatory כפי שהוא יכול לגרום כוויות / גירוי של העור של החיה ושינוי צבע הקרום השקוף של הסורק. רמות מים נאותות במפרצים נחוצות להפצת גלי קול אופטימלית, ולכן נדרשים לקבלת רזולוציית התמונה הגבוהה ביותר. עם זאת, כאשר החיה נמצאת במצב נוטה, ודא שהחוטם של החיה נמצא מעל מפלס המים או שבעל החיים נמצא בסיכון לשאיפת מים. אופטימיזציה של פרמטרי הדמיה, במיוחד עומק מוקד, היא קריטית להשגת תמונות באיכות גבוהה. שינויים בפרמטרים עשויים להיות נחוצים עבור בעלי חיים בודדים.
ארה"ב הרובוטית מספקת יתרונות רבים על פני שיטות מסורתיות של ארה"ב המוחזקות ביד. ראשית, המערכת משתמשת בממשק פשוט המבוסס על מצלמה של הצבעה ולחיצה. תכונה זו מטפלת במורכבות של ארה"ב הקונבנציונלית ומייצרת נתונים עקביים גם כאשר היא מופעלת על ידי משתמש טירון6. שנית, המערכת מאפשרת שימוש במים ולא בג'ל אמריקאי מסורתי כאמצעי אקוסטי. בעבר, השימוש בג'ל אמריקאי אפשר היווצרות של בועות שהפריעו לרכישת תמונה איכותית. כמו כן, הג'ל האמריקאי מבולגן ומספק אתגרים לניקוי. יתר על כן, המים מחוממים על ידי מנורת החום ומסייעים בשמירה על טמפרטורת הגוף של החיה. שלישית, ארה"ב הרובוטית מהירה יותר, כך שממצאים מתנועה נשימתית אינם בעייתיים. מהירות ההדמיה המוגברת מאפשרת השלמה מעשית של איסוף נתוני תפוקה גבוהה. רביעית, ארה"ב הרובוטית משיגה תמונות תלת-ממדיות, ולכן הופכת את השחזור התלת-ממדי של עצמים לפשוט (איור 4). MRI ושיטות אחרות הן יקרות, גוזלות זמן רב, ולא תמיד זמינות. חשוב לציין, המערכת הרובוטית בארה"ב מתאימה לשולחן או לספסל והיא חסכונית יותר. לבסוף, עבודה קודמת הראתה כי רובוטית ארה"ב יכולה לספק נתוני מדידה דומים לאמצעים יקרים יותר, כגון MRI3.
בעוד שאיכות התמונה והרזולוציה של המערכת הרובוטית בארה"ב המתוארת בעבודה זו היו מתאימות ליישום המוצע (איור 7), ישנן מספר דרכים שבהן ניתן לשפר את איכות התמונה בעתיד. לדוגמה, שימוש במתמרים בתדר גבוה יותר (לדוגמה, 50-70 מגה-הרץ) יביא לתמונות ברזולוציה גבוהה יותר עם הגדרת תכונה טובה יותר. בעוד ניצול תדרים גבוהים יותר יגרום עומק נמוך יותר של חדירה, התמונות צריכות להיות מספיק עבור הדמיה in vivo של איברים שטחיים, כגון כליות העכבר. בדומה לאמצעי הדמיה אחרים, ניתן להשתמש בחומרי ניגודיות כדי לשפר תכונות ספציפיות. עבור ארה"ב, זה בדרך כלל אומר באמצעות משהו מאוד רפלקטיבי של גלי קול. מיקרו-בועות תוך-וסקולריות שבהן שומנים מקיפים בועות גז קטנות מאוד הם סוכן אחד כזה. בועות הגז בגודל מיקרון הן רפלקטיביות מאוד ובכך מספקות אות ברור שני המתרגם לרזולוציה גבוהה של כלי דם7. בעוד טכניקת ניגודיות אקוסטית זו עשויה להיות שימושית למדי, זה יכול להיות כמה חסרונות. ראשית, microbubbles חייב להיות עשה טרי רק להתמיד vivo במשך 5-10 דקות. שנית, בהזרקה תוך וסקולרית vivo בדרך כלל דורש צנתור רעלת זנב להזרקה, וזה יכול להיות מאתגר מבחינה טכנית. בנסיבות מסוימות ומשטרים פועמים, הדמיית מיקרו-בועות יכולה בעצמה להוביל לנזק לכלי דם בכליות8.
יש גם כמה מגבלות כלליות יותר של המערכת האמריקאית המסוימת המשמשת. ראשית, רק מערך ליניארי אחד (ממורכז ב- 18 מגה-הרץ) נכלל במארז הרובוטי, כך שהמעבר לבדיקות בתדר גבוה או נמוך יותר אינו אפשרי כעת. הדבר עשוי להשפיע על רוחב המודלים (גדולים או קטנים יותר) שניתן להעריך עם המערכת. איטרציות עתידיות של המכשיר צריכות לכלול מערכים ליניאריים מרובים כדי לכסות את המגוון המלא של דגמים פרה-קליניים של בעלי חיים. שנית, לא ניתן לשלוט בזווית המתמר ביחס לנושא החי. לכן, ביצוע טכניקות הדמיה תלויות זווית, כגון דופלר, או השגת תצוגות חלופיות במישור של איברים מסוימים (למשל, ראיית ציר ארוכה של הכליות) דורש מיקום מחדש של החיה ויכול להיות קשה להשגה. ניתן להוסיף דרגות חופש נוספות לתנועה הרובוטית כדי לשפר את האתגר הזה. שלישית, מדי פעם, צפינו בממצאי הדהוד הנובעים מהקרום האקוסטי המפריד בין החיה למתמר שיכול לטשטש הדמיה של תכונות וגבולות שטחיים. במקרים אלה, באמצעות תיקו ג'ל כדי לרומם את החיה מן הממברנה יכול לתקן את המצב. לבסוף, בקרת טמפרטורה באמצעות מנורת חום אינה מדויקת, ולכן יש להקדיש תשומת לב רבה לטמפרטורת הגוף המרכזית של החיה בזמן ההדמיה. מנגנוני חימום מבוקרים יותר, כגון כרית חימום משולבת, ישפרו ככל הנראה את ניהול ההומוסטזיס ואת תפוקת ההדמיה.
השימוש ברובוטיקה ארה"ב עשוי לחול על תחומי מחקר שונים. טכנולוגיה זו מאפשרת הדמיה של מבני רקמות ברוטו, ובכך ניתן להשתמש כדי לעקוב אחר התקדמות הגידול וטיפולים פוטנציאליים6,9, כמו גם מורפולוגיה כליות כפי שמוצג כאן. היכולת לפלח את התכונות הספציפיות של התמונות הופכת אותו לכלי אטרקטיבי לחקר מודלים של מחלת כליות פוליציסטית (PKD)3. תמונות במצב M מאפשרות כימות פשוט של פרמטרים לבביים חשובים רבים המאפשרים הערכת vivo של פיזיולוגיה לבבית. כמו הכליות לקבל 20%-25% של תפוקת הלב10, הבנת תפקוד הלב במהלך ההערכה האורך של פתולוגיה כליות חשוב. באמצעות פרוטוקולים אלה בארה"ב, ניסינו להמחיש כי הדמיה בארה"ב היא לא רק מעשית עבור מחקרי כליות vivo ואורך, אלא גם כי יותר ויותר כלים בארה"ב לאפשר הן הערכה מורפולוגית, כמו גם פיזיולוגית של עכברים במחקרים פרה-קליניים.
Disclosures
מספר מחברים מועסקים על ידי, יש להם עניין כספי משמעותי, או שהם ממציאים שותפים על פטנטים המורשים על ידי SonoVol, Inc. (CJM, RCG, TJC).
Acknowledgments
עבודה זו נתמכה על ידי NIH (R43-DK126607, TJC, TLK, MFR) וקרן מאיו.
Materials
| Name | Company | Catalog Number | Comments |
| Electric Razor | Braintree Scientific, Inc | CLP-9868 14 | |
| C57bk6j | The Jackson laboratory | https://www.jax.org/ | |
| Cotton gauze pads | Fisher Scientific | ||
| Cotton tipped applicators | Fisher Scientific | ||
| Depilatory cream | N/a | N/a | This study used Nair |
| Heat lamp | Included with SonoVol Vega system | ||
| Robotic Ultrasound System | SonoVol Inc | SonoVol Vega system includes anesthesia system | |
| SonoEQ Software | SonoVol | Included with SonoVol Vega system | |
| TERRELL Isoflurane | Piramal Critical Care, Inc | NDC 66794-019-10 |
References
- Cunha, L., et al. Preclinical imaging: an essential ally in modern biosciences. Molecular Diagnostics & Therapy. 18 (2), 153-173 (2014).
- Ultrasound. NIBIB. , Available from: https://www.nibib.nih.gov/science-education/science-topics/ultrasound#pid-936 (2016).
- Beaumont, N. J., et al. Assessing polycystic kidney disease in rodents: Comparison of robotic 3d ultrasound and magnetic resonance imaging. Kidney360. 1 (10), 1128-1136 (2020).
- Hopp, K., et al. Functional polycystin-1 dosage governs autosomal dominant polycystic kidney disease severity. The Journal of Clinical Investigation. 122 (11), 4257-4273 (2012).
- Weiss, R. M., Ohashi, M., Miller, J. D., Young, S. G., Heistad, D. D. Calcific aortic valve stenosis in old hypercholesterolemic mice. Circulation. 114 (19), 2065-2069 (2006).
- Czernuszewicz, T. J., et al. A new preclinical ultrasound platform for widefield 3D imaging of rodents. Review of Scientific Instruments. 89 (7), 075107 (2018).
- Chong, W. K., Papadopoulou, V., Dayton, P. A. Imaging with ultrasound contrast agents: current status and future. Abdominal Radiology (NY). 43 (4), 762-772 (2018).
- Nyankima, A. G., Kasoji, S., Cianciolo, R., Dayton, P. A., Chang, E. H. Histological and blood chemistry examination of the rodent kidney after exposure to flash-replenishment ultrasound contrast imaging. Ultrasonics. 98, 1-6 (2019).
- Rojas, J. D., et al. Ultrasound measurement of vascular density to evaluate response to anti-angiogenic therapy in renal cell carcinoma. IEEE Transactions on Biomedical Engineering. 66 (3), 873-880 (2019).
- Boron, W. F., Boulpaep, E. L. Medical Physiology. 3rd edn. , Elsevier. (2017).
Tags
רפואה גיליון 174Erratum
Formal Correction: Erratum: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys
Posted by JoVE Editors on 10/06/2021.
Citeable Link.
An erratum was issued for: Use of 3D Robotic Ultrasound for In Vivo Analysis of Mouse Kidneys. An author name was updated, along with the Protocol and Representative Results sections.
The name of an author was updated from:
Ryan C. Gesser
to:
Ryan C. Gessner
Step 3.1 of the Protocol was updated from:
Turn on the US machine and the heat lamp above the US platforms. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
to:
Turn on the US machine and the switch for the internal heating element for the US bays. Turn on the appropriate anesthesia valves for the corresponding US bays that will be used.
Figue 1 in the Representative Results was updated from:
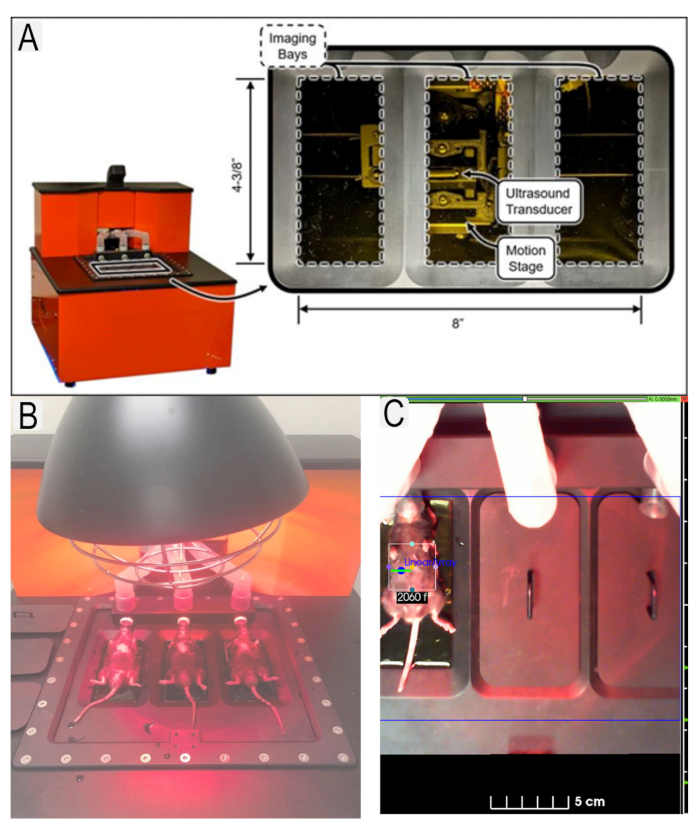
Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform with heat lamp. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.
to:

Figure 1: Ultrasound system and mouse placement. (A) Diagram of ultrasound system and location of transducers. (B) View of mice in supine position on ultrasound platform. (C) Example of region of interest (ROI)s in place for area of interest (kidneys) with animal IDs. Please click here to view a larger version of this figure.



