4.9:
Reações de Precipitação
4.9:
Reações de Precipitação
Em uma reação de precipitação, soluções aquosas de sais solúveis reagem para originar um composto iónico insolúvel – o precipitado. A reação ocorre quando iões opostamente carregados em solução superam a sua atração pela água e ligam-se entre si, formando um precipitado que se separa da solução. Como tais reações envolvem a troca de iões entre compostos iónicos em solução aquosa, são também referidas como reações de dupla deslocação, dupla substituição, de permuta, ou reações de metatese (Grego para “transpor”). Uma reação de precipitação é usada como técnica de análise para identificar iões metálicos em um composto e métodos gravimétricos para determinar a composição da matéria.
A medida em que uma substância pode ser dissolvida em água, ou em qualquer solvente, é expressa quantitativamente como a sua solubilidade, definida como a concentração máxima de uma substância que pode ser obtida em condições específicas. Diz-se que as substâncias com solubilidades relativamente grandes são solúveis. Uma substância precipita quando as condições da solução forem tais que a sua concentração excede a sua solubilidade. Diz-se que as substâncias com solubilidades relativamente baixas são insolúveis, e são estas as substâncias que rapidamente precipitam da solução.
Por exemplo, observa-se precipitação quando se misturam soluções de iodeto de potássio e nitrato de chumbo, resultando na formação de iodeto de chumbo sólido:

Esta observação é consistente com as diretrizes de solubilidade: O único composto insolúvel entre todos os envolvidos é o iodeto de chumbo, uma das excepções à solubilidade geral dos sais de iodeto.
A equação iónica líquida que representa esta reação é:
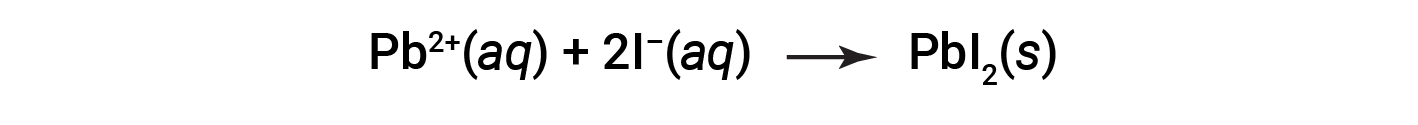
As diretrizes de solubilidade podem ser utilizadas para prever se irá ocorrer uma reação de precipitação quando se misturam soluções de compostos iónicos solúveis. Basta identificar todos os iões presentes na solução e, em seguida, considerar se o possível emparelhamento catião-anião pode resultar em um composto insolúvel.
Por exemplo, misturar soluções de nitrato de prata e fluoreto de sódio irá originar uma solução que contém iões Ag+, NO3−, Na+, e F−. Para além dos dois compostos iónicos originalmente presentes nas soluções, AgNO3 e NaF, dois compostos iónicos adicionais podem derivar deste conjunto de iões: NaNO3 e AgF. As diretrizes de solubilidade ditam que todos os sais de nitrato são solúveis, mas que AgF é uma das excepções à solubilidade geral dos sais de fluoreto. Prevê-se, portanto, a ocorrência de uma reação de precipitação, conforme descrito pelas seguintes equações:


Este texto é adaptado de OpenStax Chemistry 2e, Section 4.2: Classifying Chemical Reactions.
