4.9:
沉淀反应
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Precipitation Reactions
离子固体可能是可溶 也可能是不可溶的。水溶性离子固体会被分解或是叫做解 离的方式溶解成离子。接着水分子会包围分离的离子去形成 水溶液。而非水溶性离子固体 则会在水溶液中维持未溶解或是未分 离的状态。如果把两种不同离子化合物的水溶液混合后 有不可溶离子的化学反应发生,叫沉淀-也就是所谓的沉淀反应。这种沉淀必须要保持不可溶解的状态,而且可以被过滤后跟溶液所分离。举个例子看看,像氯化钠和硝酸银 都是水溶性离子化合物。而氯化钠水溶液 就包含了解离的钠离 子和氯离子。相同的,硝酸银水溶液 同样包含了解离的银离子和硝酸根离子。当两种溶液混和时,最后的溶液就包含了四种离子:钠和银离子以及 氯和硝酸根离子。当不同电荷的离子相互吸引时,反应物中的阳离子就会跟另 一边反应物中的阴离子相配对 来形成新的离子生成物。因此,钠阳离子与硝酸根阴离子配对 后便形成了硝酸钠,而银阳离子与氯离子则结合形成氯化银。根据溶解度法则 让我们可以决定离子生成物到底是 可溶的还是不可溶的。因次,没有任何例外地透过这个规范来看,所有的硝酸盐都是水溶的。而大部分的氯化物盐类都是可溶的,但就这么刚好,银是个例外。因此,硝酸钠 是可以在溶液中溶解成钠离子 和硝酸根离子的可溶性盐类;而氯化银 则是会沉淀在溶液中的不可溶性盐类。在这个沉淀反应当中的分子方程式 意味着氯化钠水溶液 和硝酸银水溶液互相反应后 形成硝酸钠水溶液和氯化银固体。这就是一个盐类复分解的反应,也就是所谓的置换反应。盐复分解是一种 当离子反应物中的正负离子 互相交换参与反应后 形成两个新离子生成物的过程。在这个反应当中,钠和银阳离子互相交换 与硝酸根和氯离子配对 来形成硝酸钠和氯化银。
4.9:
沉淀反应
在沉淀反应中,可溶性盐的水溶液反应以产生不溶性离子化合物— 沉淀物。当溶液中带相反电荷的离子克服其对水的吸引力并相互结合,形成从溶液中分离出来的沉淀时,就会发生反应。由于这样的反应涉及水溶液中离子化合物之间的离子交换,因此它们也被称为双重置换,双重置换,交换反应或复分解反应(希腊语为“转置”)。沉淀反应用作分析技术,以鉴定化合物中的金属离子,并采用重量分析法确定物质的组成。  
 
物质在水中或任何溶剂中的溶解程度定量表示为其溶解度,定义为在特定条件下可以达到的最大物质浓度。溶解度相对较大的物质据说是可溶的。当溶液的浓度超过其溶解度时,该物质将沉淀出来。溶解度相对较低的物质据说是不溶的,这些物质很容易从溶液中沉淀出来。
 
物质在水中或任何溶剂中的溶解程度定量表示为其溶解度,定义为在特定条件下可以达到的最大物质浓度。溶解度相对较大的物质据说是可溶的。当溶液的浓度超过其溶解度时,该物质将沉淀出来。溶解度相对较低的物质据说是不溶的,这些物质很容易从溶液中沉淀出来。
例如,当碘化钾和硝酸铅的溶液混合时会观察到沉淀,导致形成固体碘化铅:

此观察结果与溶解度指南一致:在所有相关化合物中,唯一不溶的化合物是碘化铅,这是碘盐一般溶解度的例外之一。
代表该反应的净离子方程为:
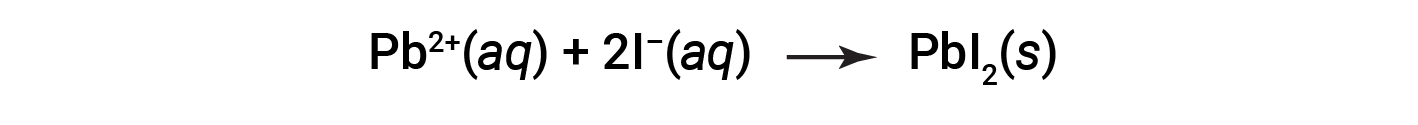
例如,硝酸银和氟化钠的混合溶液将产生包含Ag + ,NO 3 − ,Na + 和F − 离子。除了最初存在于溶液中的两种离子化合物AgNO 3 和NaF外,还可以从该离子集合中衍生出另外两种离子化合物:NaNO 3 和AgF。溶解度准则表明所有硝酸盐都是可溶的,但AgF是氟化物盐一般溶解度的例外之一。因此,预计会发生沉淀反应,如以下等式所述:


