6.6:
Entalpia
6.6:
Entalpia
I chimici usano normalmente una proprietà nota come entalpia (H) per descrivere la termodinamica dei processi chimici e fisici. L’entalpia è definita come la somma dell’energia interna di un sistema (E) e del prodotto matematico della sua pressione (P) e del volume (V):
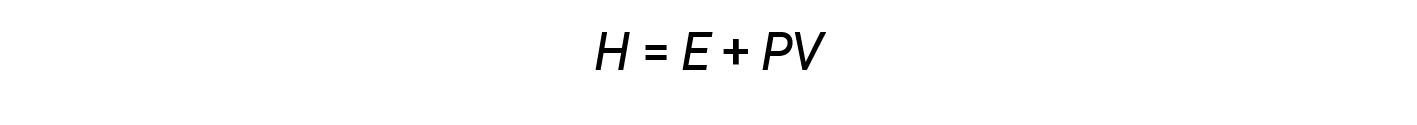
L’entalpia è una funzione di stato. I valori di entalpia per sostanze specifiche non possono essere misurati direttamente; possono essere determinati solo i cambiamenti di entalpia per processi chimici o fisici. Per i processi che si svolgono a pressione costante (una condizione comune per molti cambiamenti chimici e fisici), il cambiamento di entalpia (ΔH) è:
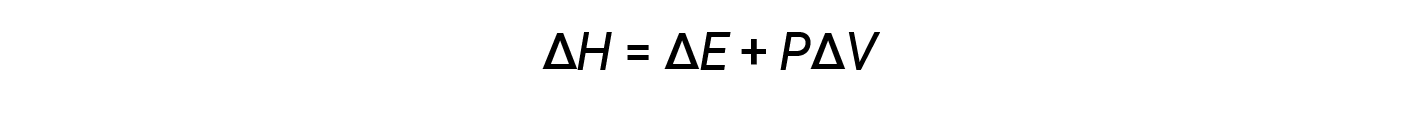
Il prodotto matematico PΔV rappresenta il lavoro ( w ),vale adire l’espansione o il lavoro pressione-volume. Con le loro definizioni, i segni aritmetici di ΔV e w saranno sempre opposti:
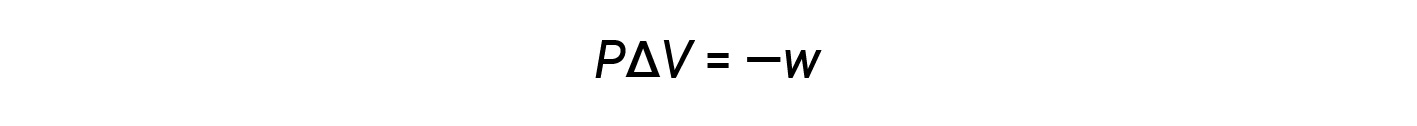
Sostituendo questa equazione e la definizione di energia interna a pressione costante (ΔE = qp + w) nell’equazione dell’entalpia-cambiamento si ottiene:
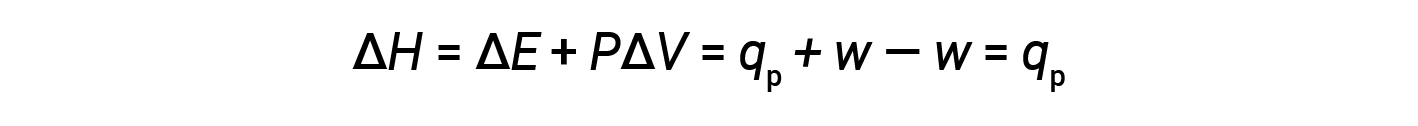
dove qp è il calore di reazione in condizioni di pressione costante.
E così, se un processo chimico o fisico viene eseguito a pressione costante con l’unico lavoro fatto causato dall’espansione o dalla contrazione(lavoro P-V), allora il flusso di calore (qp) e il cambiamento di entalpia (ΔH) per il processo sono uguali.
Il calore spento durante il funzionamento di un bruciatore Bunsen è uguale al cambiamento di entalpia della reazione di combustione del metano che avviene poiché si verifica alla pressione essenzialmente costante dell’atmosfera. I chimici di solito eseguono esperimenti in condizioni atmosferiche normali, a pressione esterna costante con qp = ΔH, il che rende l’entalpia la scelta più conveniente per determinare i cambiamenti di calore per le reazioni chimiche.
Un valore negativo di un cambiamento di entalpia, ΔH < 0, indica una reazione esotermica (calore esologo all'ambiente circostante); un valore positivo, ΔH > 0, indica una reazione endotermica (calore assorbito dall’ambiente circostante). Se la direzione di un’equazione chimica è invertita, il segno aritmetico della sua ΔH viene cambiato (un processo che è endotermico in una direzione è esotermico nella direzione opposta).
Concettualmente, ΔE (una misura del calore e del lavoro) e ΔH (una misura del calore a pressione costante) rappresentano entrambi cambiamenti in una funzione di stato per il sistema. Nei processi in cui il cambiamento di volume, ΔV, è piccolo (fusione del ghiaccio), e ΔE e ΔH sono identici. Tuttavia, se la variazione di volume è significativa (evaporazione dell’acqua), la quantità di energia trasferita come lavoro sarà significativa; quindi, ΔE e ΔH hanno valori significativamente diversi.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 5.3: Entalpia.
Suggested Reading
- Canagaratna, Sebastian G. "A visual aid in enthalpy calculations." Journal of Chemical Education 77, no. 9 (2000): 1178.
- Howard, Irmgard K. "H is for enthalpy, thanks to Heike Kamerlingh Onnes and Alfred W. Porter." Journal of chemical education 79, no. 6 (2002): 697.
- Van Ness, Hendrick C. Classical thermodynamics of non-electrolyte solutions. Elsevier, 2015.
