6.6:
엔탈피
6.6:
엔탈피
화학자는 일반적으로 화학 적 및 물리적 과정의 열역학을 설명하기 위해 엔탈피(H)로알려진 특성을 사용합니다. 엔탈피는 시스템의 내부 에너지(E)와압력(P)및 부피(V)의수학적 생성물의 합으로 정의됩니다 .
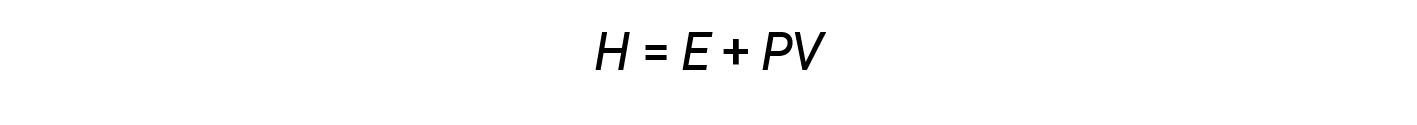
엔탈피는 상태 함수입니다. 특정 물질에 대한 엔탈피 값은 직접 측정할 수 없습니다. 화학적 또는 물리적 공정에 대한 엔탈피 변경만 결정할 수 있습니다. 일정한 압력(많은 화학적 및 물리적 변화에 대한 일반적인 조건)에서 발생하는 프로세스의 경우 엔탈피 변경(ΔH)은다음과 입니다.
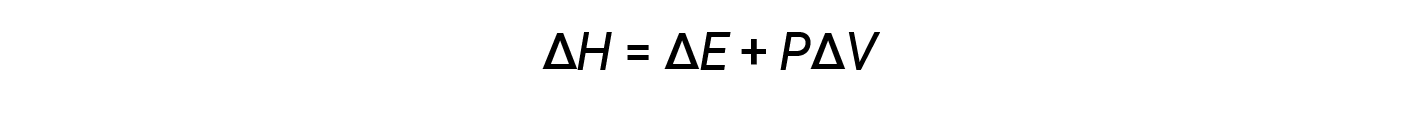
수학 제품 PΔV는 작업(w), 즉 확장 또는 압력 볼륨 작업을 나타냅니다. 그들의 정의에 의해, ΔV와 w의 산술 징후는 항상 반대될 것입니다 :
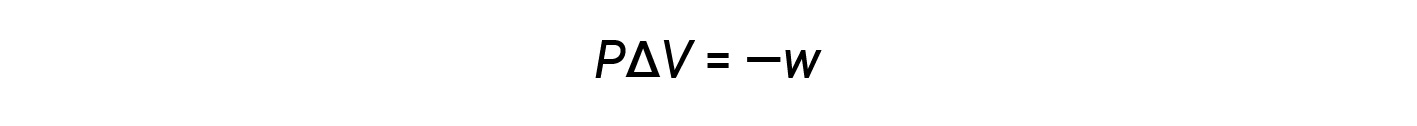
이 방정식과 일정한 압력(ΔE = qp + w)에서내부 에너지의 정의를 엔탈피 변경 방정식 수율로 대체합니다.
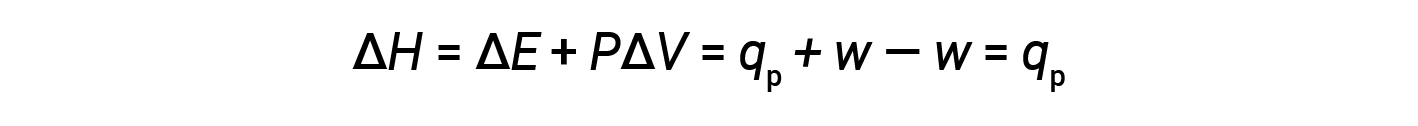
여기서 qp는 일정한 압력의 조건에서 반응의 열입니다.
따라서, 화학적 또는 물리적 과정이 확장 또는수축(P-V 작업)으로 인한 유일한 작업으로 일정한 압력으로 수행되는 경우, 공정에 대한 열흐름(qp)및 엔탈피 변경(ΔH)은동일하다.
분젠 버너를 작동하면서 발생하는 열은 대기의 본질적으로 일정한 압력에서 발생하기 때문에 발생하는 메탄 연소 반응의 엔탈피 변화와 같습니다. 화학자는 일반적으로 정상적인 대기 조건하에서 qp = ΔH를가진 일정한 외부 압력에서 실험을 수행하므로 화학 반응의 열 변화를 결정하는 데 가장 편리한 선택이 됩니다.
엔탈피 변화의 음수 값인 ΔH & 0은 외동적인 반응(주변 환경에 주어지는 열)을 나타냅니다. 양수 값인 ΔH > 0은, 외열성 반응(주변에서 흡수된 열)을 나타낸다. 화학 방정식의 방향이 반전되면 ΔH의 산술 표시가 변경됩니다(한 방향으로 풍등되는 공정은 반대 방향으로 퇴역됩니다).
개념적으로, ΔE(열 및 작동 의 척도) 및 ΔH(일정한 압력에서 열의 측정)는 모두 시스템에 대한 상태 함수의 변화를 나타냅니다. 부피가 변경되는 공정에서 ΔV는작고(얼음의 용융) 및 ΔE 및 ΔH가 동일합니다. 그러나, 부피 변화가 중요한 경우 (물의 증발), 작업으로 전송되는 에너지의 양은 중요할 것이다; 따라서 ΔE와 ΔH는 현저하게 다른 값을 갖습니다.
Suggested Reading
- Canagaratna, Sebastian G. "A visual aid in enthalpy calculations." Journal of Chemical Education 77, no. 9 (2000): 1178.
- Howard, Irmgard K. "H is for enthalpy, thanks to Heike Kamerlingh Onnes and Alfred W. Porter." Journal of chemical education 79, no. 6 (2002): 697.
- Van Ness, Hendrick C. Classical thermodynamics of non-electrolyte solutions. Elsevier, 2015.
