9.5:
晶格能量的趋势:离子大小和电荷
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Trends in Lattice Energy: Ion Size and Charge
晶格能与离子晶格的 形成或分离有关。然而,当氯化钠或氧化镁形成时,它们的晶格能差别很大。为什么每种离子化合物都有不同的 晶格能,它又取决于哪些因素?离子化合物是由大量的带电离子 有序排列而成,这些离子通过静电相互作用 相互吸引。根据库仑定律,两个离子的势能 与离子之间的距离成反比,而这个距离又取决于离子半径。在周期表中,碱金属和碱土金属 的离子半径 沿列向下增加。随着金属离子尺寸的增大,离子之间的距离,或键长,也会变大。例如,溴化锂和溴化钾的键长 分别在 217 pm 和 282 pm 之间不同。由于核间距离的增加,离子间的吸引力降低,因此分离离子变得容易很多。因此,分离固体溴化锂的晶格能 大于分离溴化钾的晶格能,分别为 807 kJ/mol 对 682 kJ/mol。除了离子半径外,晶格能的大小 还取决于离子电荷。根据库仑定律,离子的势能 与它们电荷的乘积成正比。考虑两种离子化合物氟化钠 和氧化钙。两种化合物的离子距离相似,但氧化钙的晶格能 几乎是氟化钠的四倍。钠和氟都是一价离子;它们电荷的乘积是 1。然而,钙离子和氧化物离子是二价的,它们电荷的乘积是 4,是氟化钠的四倍。这就是为什么将氧化钙 分离成气态离子所需的能量 会是氟化钠的四倍。因此,晶格能的大小 与离子电荷的乘积成正比,与离子间的距离成反比。
9.5:
晶格能量的趋势:离子大小和电荷
离子化合物由于其正离子和负离子之间的静电吸引而稳定。化合物的晶格能量是该吸引力强度的量度。离子化合物的晶格能量(Δ H lattice )定义为将一摩尔固体分离成其气态离子所需的能量。对于离子型固体氯化钠,晶格能是过程的焓变:
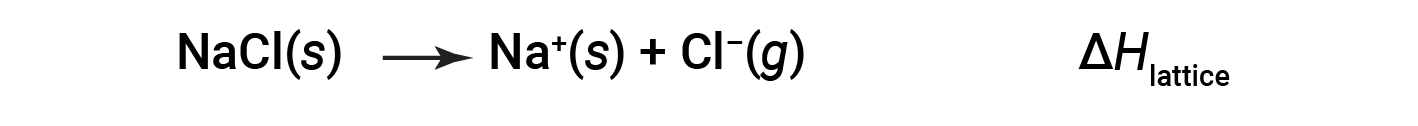
公约
在这里,使用约定将离子固体分离为离子,这意味着晶格能量将是吸热的(正值)。另一种方法是使用等效但相反的约定,其中晶格能量是放热的(负值),并且被描述为当离子结合形成晶格时释放的能量。因此,请确保在另一个参考文献中查找晶格能量时确认使用哪个定义。在这两种情况下,较大的晶格能量表明离子化合物更稳定。对于氯化钠,Δ H 晶格 = 769 kJ。因此,将一摩尔固体NaCl分离成气态Na + 和Cl n 离子需要769 kJ。当气态Na + 和Cl n 离子每摩尔形成固体NaCl时,会释放769 kJ热量。
库仑定律和晶格能量
离子晶体的晶格能量< H 晶格可以用以下公式表示(从库仑定律推导,决定电荷之间的力) :
ΔHlattice = C(Z +)(Z−)/Ro
,其中 C 是一个常数,取决于晶体结构的类型; Z + 和 Z – 是离子上的电荷,而 R o 是离子间距(正离子和负离子的半径之和)。因此,离子晶体的晶格能量随着离子电荷的增加和离子尺寸的减小而迅速增加。当所有其他参数保持恒定时,将阳离子和阴离子的电荷加倍会使晶格能翻两番。
示例
- LiF( Z + 和 Z &s = 1)的晶格能为1023 kJ / mol,而MgO( Z + 和 Z &sdash> = 2)的MgO为3900 kJ / mol(两种化合物的 R o 几乎相同-大约200 pm。
- 不同的原子间距离产生不同的晶格能量。例如,比较MgF 2 (2957 kJ / mol)和MgI 2 (2327 kJ / mol)的晶格能,观察其对MgF 2 的晶格能的影响。与I 相比,F 的离子尺寸更小。
- 宝石红宝石是氧化铝Al 2 O 3 ,其中含有痕量Cr 3 + 。化合物Al 2 Se 3 用于某些半导体器件的制造。在这两种离子化合物中, Z + 和 Z – 的电荷相同,因此在晶格能量取决于 R o 。由于O 2 离子小于Se 2 离子,因此Al 2 O 3 的离子间距比Al 2 Se 3 短,因此具有更大的晶格能。 另一个例子是与NaCl相比的氧化锌ZnO。 ZnO中的阳离子和阴离子的 Z 值都较大,并且ZnO的离子间距离小于NaCl的离子间距离,因此ZnO具有更大的晶格能。
