9.5:
격자에너지 경향: 이온 크기와 전하
9.5:
격자에너지 경향: 이온 크기와 전하
이온 화합물은 양극과 음이온 사이의 정전기 적 매력 때문에 안정적입니다. 화합물의 격자 에너지는이 매력의 강도의 척도입니다. 이온 화합물의 격자 에너지(ΔH격자)는고체의 두더지 1개를 구성 요소기이온으로 분리하는 데 필요한 에너지로 정의된다. 이온 고체 염화 나트륨의 경우, 격자 에너지는 공정의 엔탈피 변화입니다:
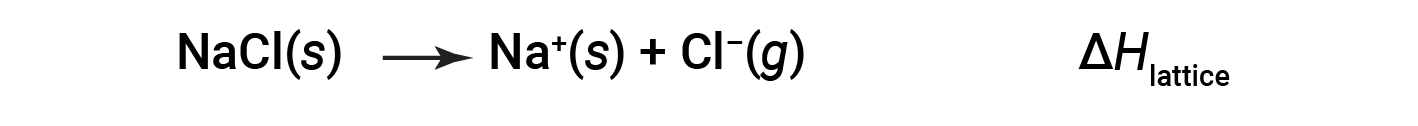
규칙
여기서, 이온 고체가 이온으로 분리되는 곳에서 이관이 사용되는 경우, 격자 에너지가 풍등(양성 값)이 된다는 것을 의미합니다. 또 다른 방법은 격자 에너지가 특이적(음수 값)이고 이온이 결합될 때 방출되는 에너지로 설명되어 격자를 형성하기 위해 동등한 하지만 반대되는 규칙을 사용하는 것이다. 따라서 다른 참조에서 격자 에너지를 조회할 때 어떤 정의가 사용되는지 확인하십시오. 두 경우 모두, 격자 에너지에 대한 더 큰 크기는 더 안정적인 이온 화합물을 나타냅니다. 염화 나트륨의 경우, ΔH격자 = 769 kJ. 따라서, 고체 NaCl의 두더지 1개를 기체 Na+ 및 Cl– 이온으로 분리하기 위해 769 kJ가 필요합니다. 가스 Na+ 및 Cl– 이온이 솔리드 NaCl을 형성하면 769 kJ의 열이 방출됩니다.
쿨롬의 법칙과 격자 에너지
이온 결정의 격자 에너지 ΔH격자는 다음과 같은 방정식에 의해 표현 될 수있다 (쿨롬의 법칙에서 파생, 전기 요금 사이의 힘을 지배) :
ΔH격자 = C(Z +)(Z–)/Ro
C는 결정 구조의 유형에 따라 일정한; Z+ 및 Z– 이온에 전하및 Ro는 상호 거리 (양성 및 음이온의 반개의 합)입니다. 따라서 이온 결정의 전하가 증가하고 이온의 크기가 감소함에 따라 이온 결정의 격자 에너지가 급격히 증가합니다. 다른 모든 매개 변수가 일정하게 유지되면 양이온과 애니메이션 의 전하가 격자 에너지를 네 배로 늘립니다.
예제
- LiF(Z+ 및 Z – = 1)의 격자 에너지는 1023 kJ / mol이며 MgO(Z+ 및 Z– = 2)는 3900 kJ / mol(Ro는 거의 동일합니다 – 두 화합물모두 약 200 pm)입니다.
- 다른 원자 간 거리는 다른 격자 에너지를 생성합니다. 예를 들어, MgF 2(2957 kJ/mol)의 격자 에너지를 MgI2(2327 kJ/mol)와 비교하여 F의 이온 크기의 격자 에너지에 미치는 영향을관찰합니다– I에비해 – .
- 귀중한 보석 루비는 알루미늄 산화물, Al2O3이며Cr3 +흔적을 포함합니다. 화합물 Al2Se3는 일부 반도체 장치의 제조에 사용됩니다. 이 두 이온 화합물에서, 충전 Z+ 및 Z– 동일, 그래서 격자 에너지의 차이는 Ro에따라 달라집니다. O2– 이온은 Se2보다작기 때문에 Al2O3은 Al2Se3보다 짧은 상호 계거리를 가지며, 따라서 더 큰 격자 에너지를 가지고 있습니다.
- 또 다른 예는 NaCl에 비해 산화 아연, ZnO입니다. ZnO는 ZnO의 양이온과 음이온의 Z 값이 더 크고 ZnO의 상호 간거리가 NaCl보다 작기 때문에 더 큰 격자 에너지를 가지고 있습니다.
