12.6:
影响溶解度的物理性质
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Physical Properties Affecting Solubility
溶质的溶解度是指 在特定温度下可溶解在给定量溶剂中 溶质的最大量。根据定义,这意味着温度 会影响大多数物质的溶解度。对于大多数固体溶质,它们在水中的溶解度 会随着溶液温度的升高而增加,尽管也有例外,如硫酸铯。随着温度的变化,不同物质的溶解度 以不同的速率增加。例如,硝酸钾的溶解度 随温度急剧上升,而氯化钾的溶解度 变化很小。当加热包含硝酸钾和氯化钾的混合物的溶液,然后 缓慢冷却至十度时,结晶沉淀将含有更多的硝酸钾 因为硝酸钾 在低温下溶解性较小。这种分离技术 被称为分离结晶。与固体溶质相反,气体在水中的溶解度随温度升高而降低。如果把一个装有冷苏打水的烧杯加热到室温,苏打水中的二氧化碳会很快逸出。这是因为二氧化碳的溶解度会 随着温度的升高而降低。气体的溶解度也取决于压力。液体上方气体的压力越高,该气体在液体中的溶解度就越高。压力与气体溶解度之间 的这种关系可 通过亨利定律定量化,亨利定律指出气体的溶解度 等于亨利定律常数乘以压力。制作苏打水时,二氧化碳 会在高压下溶解在糖溶液中。上述压力可使溶液中 二氧化碳饱和。因此,当打开苏打水罐时,随着压力的释放,我们可以听到熟悉的爆裂声,并且当二氧化碳气体从溶液中逸出时,会看到许多气泡的形成。
12.6:
影响溶解度的物理性质
液体中气体的溶液
对于任何溶液,液体中气体的溶解度都会受到溶质和溶剂物种之间的吸引分子间作用力的影响。 但是,与固体和液体溶质不同,当气体溶质溶解在液体溶剂中时,没有需要克服的 溶质-溶质 分子间吸引力,因为气体的原子或分子是分离得太远,相互作用微不足道。 因此, 溶质-溶剂 相互作用是影响溶解度的唯一能动因素。 例如,氧气的水溶性大约是氦的三倍 (水和较大氧分子之间的色散力越大) ,但比氯甲烷的溶解度高 100 倍,即 CHCl3 (极高氯甲烷分子经历 取向力(即:偶极-偶极作用力) 到极高水分子)。 同样,请注意,六烷 (C6H14) 中的氧气溶解度大约是水中氧气溶解度的 20 倍,因为氧气和较大的六烷分子之间存在更大的色散力。
温度是影响溶解度的另一个因素,气体溶解度通常随着温度的升高而下降。 温度和溶解气体浓度之间的这种反比关系是导致自然水热污染的主要影响之一。
气体溶质的溶解度也受到溶质在溶液所接触的气体中的部分压力的影响。 气体溶解度随着气体压力的增加而增加。
对于许多气体溶质,溶解度,气体和部分压力 PGA 之间的关系是成比例的:
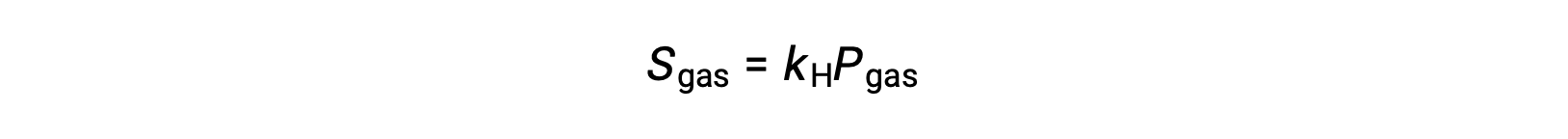
其中 KH 是一种比例常数,取决于气体溶质和溶剂的特性和溶液温度。 这是 亨利定律(Henry’s law) 的数学陈述:在一定的体积液体中溶解的理想气体的数量与气体的压力直接成比例。
Suggested Reading
- Kolev, Nikolay Ivanov. "Solubility of O 2, N 2, H 2 and CO 2 in water." In Multiphase Flow Dynamics 4, pp. 209-239. Springer, Berlin, Heidelberg, 2011.
- Mitchell, Alan J., ed. Formulation and production carbonated soft drinks. Springer Science & Business Media, 1990.
