12.6:
용해도에 영항을 미치는 물리적 성질
12.6:
용해도에 영항을 미치는 물리적 성질
액체의 가스 솔루션
어떤 용액에 관해서는, 액체에 있는 가스의 용해도는 솔트종과 용매 종 사이 매력적인 분자 간 힘에 의해 영향을 받습니다. 그러나 고체 및 액체 솔루트와 는 달리, 가스를 포함하는 원자 또는 분자가 훨씬 분리되고 무시할 수 있는 상호 작용을 경험하기 때문에 기체 솔루스가 액체 용매에서 용해될 때 극복할 수 있는 단분자 간 매력은 없습니다. 따라서, 솔루트 용매 상호 작용은 용해도에 영향을 미치는 유일한 에너지 요인입니다. 예를 들어, 산소의 용해도는 헬륨보다 약 3배 더 크지만(물과 더 큰 산소 분자 사이에 분산력이 더 큽니다)이지만 클로로메탄의 용해도보다 100배 적지만, CHCl 3(극극 엽록메탄 분자는 극수 분자에 대한 이폴-이폴어를 경험한다). 마찬가지로, 헥산, C6H14에서산소의 용해도가 산소와 더 큰 헥산 분자 사이에 더 큰 분산력이 존재하기 때문에 물에서보다 약 20배 더 크다는 점에 유의하십시오.
온도는 용해도에 영향을 미치는 또 다른 요인이며, 일반적으로 온도가 증가함에 따라 가스 용해도가 감소합니다. 온도와 용해 가스 농도 사이의 이러한 역관계는 천연 수역에서 열 오염의 주요 영향 중 하나에 대한 책임이 있습니다.
기체 솔루트의 용해도는 용액이 노출된 가스에서 솔ute의 부분압력에 의해도 영향을 받습니다. 가스의 압력이 증가함에 따라 가스 용해도가 증가합니다.
많은 기체 용액의 경우 용해도, S가스및 부분 압력, P가스사이의 관계는 비례입니다.
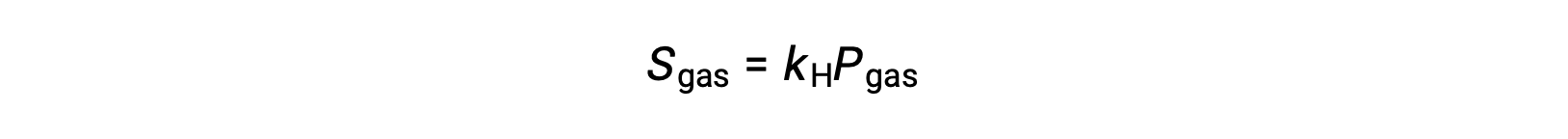
여기서 kH는 기체 솔루트 및 용매의 ID와 용액 온도에 의존하는 비례 상수입니다. 이것은 헨리의 법칙의 수학적 진술입니다 : 액체의 명확한 볼륨에 용해 이상적인 가스의 양은 가스의 압력에 직접 비례합니다.
Suggested Reading
- Kolev, Nikolay Ivanov. "Solubility of O 2, N 2, H 2 and CO 2 in water." In Multiphase Flow Dynamics 4, pp. 209-239. Springer, Berlin, Heidelberg, 2011.
- Mitchell, Alan J., ed. Formulation and production carbonated soft drinks. Springer Science & Business Media, 1990.
