12.6:
Propiedades Físicas que Afectan la Solubilidad
12.6:
Propiedades Físicas que Afectan la Solubilidad
Soluciones de gases en líquidos
En cuanto a cualquier solución, la solubilidad de un gas en un líquido se ve afectada por las fuerzas de atracción intermolecular entre especies solutos y solventes. A diferencia de los solutos sólidos y líquidos, sin embargo, no hay atracción intermolecular soluto-soluto a superar cuando un soluto gaseoso se disuelve en un solvente líquido, ya que los átomos o moléculas que componen un gas están muy separados y experimentan interacciones insignificantes. Por consiguiente, las interacciones soluto-solvente son el único factor energético que afecta a la solubilidad. Por ejemplo, la solubilidad del oxígeno en el agua es aproximadamente tres veces mayor que la del helio (hay mayores fuerzas de dispersión entre el agua y las moléculas de oxígeno más grandes) pero 100 veces menor que la solubilidad del clorometano, CHCl3 (las moléculas de clorometano polar experimentan atracción dipolo-dipolo a las moléculas de agua polares). Asimismo, observe que la solubilidad del oxígeno en el hexano, C6H14, es aproximadamente 20 veces mayor que en el agua porque existen mayores fuerzas de dispersión entre el oxígeno y las moléculas de hexano más grandes.
La temperatura es otro factor que afecta a la solubilidad, disminuyendo la solubilidad de los gases a medida que aumenta la temperatura. Esta relación inversa entre temperatura y concentración de gas disuelto es responsable de uno de los mayores impactos de la contaminación térmica en aguas naturales.
La solubilidad de un soluto gaseoso también se ve afectada por la presión parcial del soluto en el gas al que está expuesta la solución. La solubilidad del gas aumenta a medida que aumenta la presión del gas.
Para muchos solutos gaseosos, la relación entre solubilidad, Sgas y presión parcial, Pgas, es proporcional:
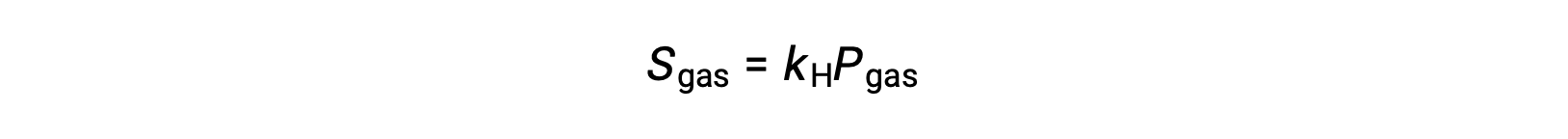
Donde kH es una constante de proporcionalidad que depende de las identidades del soluto gaseoso y del disolvente y de la temperatura de la solución. Este es un enunciado matemático de la ley de Henry: La cantidad de un gas ideal que se disuelve en un volumen definido de líquido es directamente proporcional a la presión del gas.
Este texto es adaptado de Openstax, Química 2e, Sección 11,3: Solubilidad.
Suggested Reading
- Kolev, Nikolay Ivanov. "Solubility of O 2, N 2, H 2 and CO 2 in water." In Multiphase Flow Dynamics 4, pp. 209-239. Springer, Berlin, Heidelberg, 2011.
- Mitchell, Alan J., ed. Formulation and production carbonated soft drinks. Springer Science & Business Media, 1990.
