14.7:
مبدأ لوشاتيليير: تغيير التركيز
14.7:
مبدأ لوشاتيليير: تغيير التركيز
يكون النظام في حالة توازن في حالة توازن ديناميكي ، مع حدوث تفاعلات أمامية وعكسية بمعدلات متساوية. إذا تعرض نظام التوازن لتغيير في الظروف التي تؤثر على معدلات التفاعل هذه بشكل مختلف (إجهاد ) ، فإن المعدلات لم تعد متساوية والنظام ليس في حالة توازن. سيشهد النظام لاحقًا رد فعل صافًا في اتجاه معدل أكبر ( تحول ) سيعود – إنشاء التوازن. تم تلخيص هذه الظاهرة من خلال مبدأ âلو شاتيلير’ إذا تم التأكيد على نظام التوازن ، فإن النظام سيشهد تحولًا في الاستجابة للإجهاد الذي يعيد إنشاء التوازن .
تتأثر معدلات التفاعل بشكل أساسي بالتركيزات ، كما هو موضح في قانون معدل التفاعل’ ودرجة الحرارة ، كما هو موضح في معادلة أرهينيوس. وبالتالي ، فإن التغيرات في التركيز ودرجة الحرارة هما عاملان من الضغوط التي يمكن أن تغير التوازن.
تأثير التغيير في التركيز
إذا تعرض نظام التوازن لتغير في تركيز مادة متفاعلة أو نوع منتج ، فإن معدل التفاعل الأمامي أو العكسي سيتغير. كمثال ، ضع في اعتبارك تفاعل التوازن:

عندما يكون هذا النظام في حالة توازن ، فإن معدلات التفاعل الأمامية والعكسية متساوية.
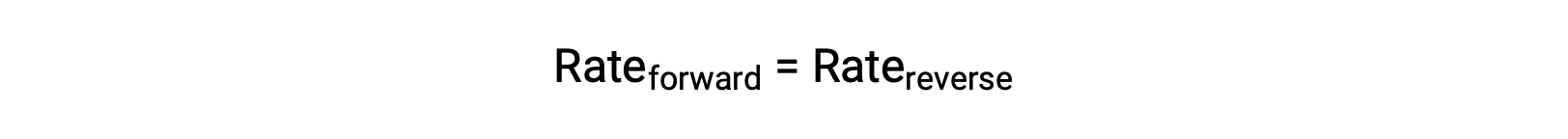
إذا تم الضغط على النظام بإضافة مادة متفاعلة ، إما N 2 أو O 2 ، فإن الزيادة الناتجة في التركيز تؤدي إلى زيادة معدل التفاعل الأمامي ، وتجاوز ذلك من رد الفعل العكسي:

سيختبر النظام صافي رد فعل مؤقت في الاتجاه الأمامي لإعادة التوازن ( سيتحول التوازن إلى اليمين ). سينتج هذا التحول نفسه في حالة إزالة بعض المنتجات NO من النظام ، مما يقلل من معدل رد الفعل العكسي ، مما يؤدي مرة أخرى إلى نفس عدم التوازن في المعدلات.
يمكن استخدام نفس المنطق لشرح التحول إلى اليسار الناتج عن إزالة المادة المتفاعلة أو إضافة منتج إلى نظام التوازن. كل من هذه الضغوط تؤدي إلى زيادة معدل رد الفعل العكسي

وتفاعل صاف مؤقت في الاتجاه العكسي لإعادة التوازن.
كبديل لهذا التفسير الحركي ، يمكن تبرير تأثير التغيرات في التركيز على التوازن من حيث حاصل التفاعل. عندما يكون النظام في حالة توازن ،
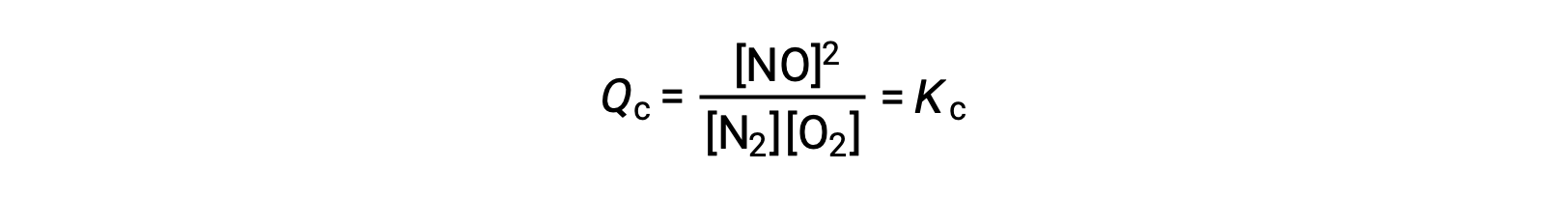
إذا تمت إضافة مادة متفاعلة (زيادة مقام حاصل التفاعل) أو تمت إزالة المنتج (إنقاص البسط) ، فعندئذٍ Qc & # 60 ؛ Kc وسوف يتحول التوازن إلى اليمين. لاحظ أن الطرق الثلاث المختلفة للحث على هذا الضغط تؤدي إلى ثلاثة تغييرات مختلفة في تكوين خليط التوازن. إذا تمت إضافة N 2 ، فإن التحول الصحيح سوف يستهلك O 2 وينتج NO عند إعادة التوازن ، مما ينتج عنه خليط بتركيز أكبر من N 2 و NO وتركيز أقل من O 2 مما كان موجودًا من قبل. إذا تمت إضافة O 2 ، فإن خليط التوازن الجديد سيكون له تركيزات أكبر من O 2 و NO وتركيز أقل من N 2 . أخيرًا ، إذا تمت إزالة NO ، فإن خليط التوازن الجديد سيكون له تركيزات أكبر من N 2 و O 2 وتركيز أقل من NO. على الرغم من هذه الاختلافات في التركيب ، ستكون قيمة ثابت التوازن هي نفسها بعد الضغط كما كانت من قبل (وفقًا لقانون الحركة الجماعية). يمكن تطبيق نفس المنطق على الضغوط التي تتضمن إزالة المواد المتفاعلة أو إضافة منتج ، وفي هذه الحالة Qc > Kc وسوف يتحول التوازن إلى اليسار.
تم اقتباس هذا النص من Openstax, Chemistry 2e, Section 13.3 Shifting Equilibria: LeChatelier’s Principle.
