14.7:
Принцип Ле Шателье: изменение концентрации
14.7:
Принцип Ле Шателье: изменение концентрации
Система, которая находится в равновесии, находится в состоянии динамического баланса, при этом реакции переднего и заднего хода происходят с одинаковой скоростью. Если система равновесия подвержена изменению условий, которые влияют на эти скорости реакции по-разному (напряжение), то скорости больше не равны, и система не находится в равновесии. В дальнейшем система испытает чистую реакцию в направлении большей скорости (сдвига), которая восстановит равновесие. Это явление обобщается принципом Ле Шательера: Если система равновесия будет напряженной, система испытает сдвиг в ответ на стресс, который восстанавливает равновесие.
На скорости реакции влияют в первую очередь концентрации, как описано в законе о скорости реакции, и температура, как описано в уравнении Аррениуса. Следовательно, изменения концентрации и температуры являются двумя напряжениями, которые могут сместить равновесие.
Влияние изменения концентрации
Если система равновесия подвержена изменению концентрации реагент или видов продукции, скорость реакции движения вперед или назад изменится. В качестве примера рассмотрим реакцию равновесия:

Когда эта система находится в равновесии, скорость реакции переднего и заднего хода равна.
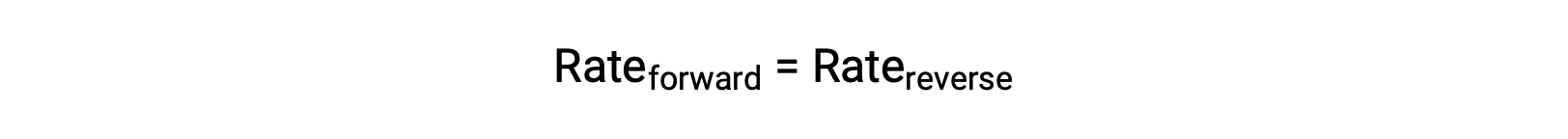
Если система напряруется добавлением реагент, N2 или O2, то результирующее увеличение концентрации вызывает увеличение скорости реакции переднего хода, превышающее скорость обратной реакции:

Система испытает временную чистую реакцию в прямом направлении для восстановления равновесия (равновесие сдвинется вправо). Такое же изменение произойдет, если какой-либо продукт НЕ будет удален из системы, что приведет к снижению скорости обратной реакции, что снова приведет к такому же дисбалансу в ставках.
Эта же логика может использоваться для объяснения смещения влево, которое происходит либо от удаления реагент, либо от добавления продукта в систему равновесия. Оба этих напряжения приводят к увеличению скорости обратной реакции

и временная чистая реакция в обратном направлении для восстановления равновесия.
В качестве альтернативы этой кинетической интерпретации эффект изменений концентрации на равновесии можно рационализировать с точки зрения реактивных соотношений. Когда система находится в равновесии,
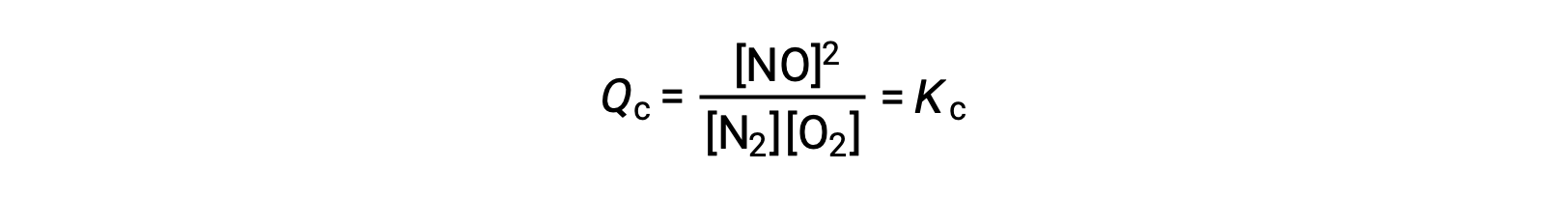
Если добавляется реагент (увеличивающий знаменатель коэффициента реакции) или удаляется продукт (уменьшающий числитель), то QC < Kc и равновесие смещается вправо. Обратите внимание, что три различных способа индуцирования этого напряжения приводят к трем различным изменениям состава равновесной смеси. При добавлении N2 правый сдвиг будет потреблять O2 и не производить его, так как равновесие будет восстановлено, давая смесь с большей концентрацией N2 и NO и меньшей концентрацией O2, чем было ранее. При добавлении O2 новая равновесная смесь будет иметь большую концентрацию O2, а ТАКЖЕ МЕНЬШУЮ концентрацию N2. И, наконец, если НЕТ, новая равновесная смесь будет иметь более высокие концентрации N2 и O2 и меньшую концентрацию NO несмотря на эти различия в составе, значение константы равновесия будет таким же после напряжения, как и раньше (в соответствии с законом о массовых действиях). Такая же логика может применяться для напряжений, связанных с удалением реагенты или добавлением продукта, в этом случае QC > Kc и равновесие будет смещаться влево.
Этот текст был адаптирован к Openstax, Химия 2е изд., Раздел 13.3 Сдвиг равновесия: Принцип Ле-Шателье.
