14.7:
르샤틀리에의 원리: 농도 변화
14.7:
르샤틀리에의 원리: 농도 변화
평형의 시스템은 동적 균형 상태에 있으며, 전방 및 역반응은 동일한 속도로 진행됩니다. 평형 시스템이 이러한 반응 속도에 다르게 영향을 미치는 조건의 변화를 겪는 경우 (스트레스),다음 속도는 더 이상 동일하지 않고 시스템이 평형에 있지 않습니다. 이 시스템은 이후에 평형을 다시 확립할 더 큰 속도(shift)의방향으로 순 반응을 경험하게 됩니다. 이 현상은 Le Châtelier의 원칙에 의해 요약됩니다: 평형 시스템이 강조되는 경우에, 시스템은 평형을 다시 설정하는 응응에 응하여 교대를 경험하게 될 것입니다.
반응 비율은 Arrhenius 방정식에 의해 기술된 바와 같이 반응의 비율 법 및 온도에 의해 기술된 바와 같이, 집중에 의해 주로 영향을 받습니다. 따라서 농도와 온도의 변화는 평형을 이동할 수 있는 두 가지 응력입니다.
농도 변화의 효과
평형 시스템이 반응제 또는 제품 종의 농도의 변화를 겪는 경우, 전방 또는 역반응의 속도가 변화하게 된다. 예를 들어 평형 반응을 고려하십시오.

이 시스템이 평형상태일 때, 전방 및 역반응속도는 동일합니다.
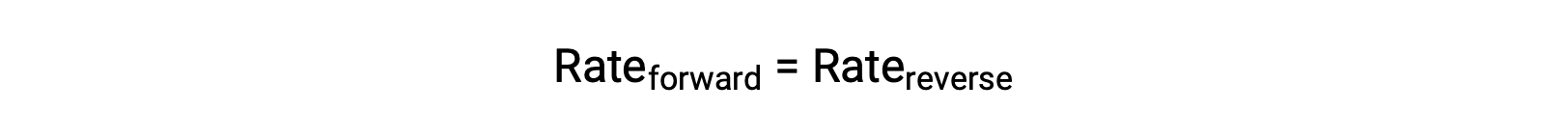
시스템이 반응제를 첨가하여 스트레스를 받으면,N2 또는O2의농도 증가로 인해 전방 반응의 속도가 증가하여 역반응의 속도를 초과합니다.

시스템은 평형을 재확립하기 위해 전방 방향으로 일시적인 순 반응을 경험하게될 것이다(평형은 오른쪽으로 이동합니다). 이 같은 변화는 일부 제품 NO가 시스템에서 제거되어 역반응 속도가 감소하여 다시 동일한 비율의 불균형을 초래합니다.
동일한 논리를 사용하여 반응제를 제거하거나 평형 시스템에 제품을 추가하여 발생하는 왼쪽 교대를 설명할 수 있습니다. 이 두 응력 모두 역반응에 대한 증가된 속도의 결과를 낳습니다.

및 역방향의 일시적인 순반응은 평형을 재확립한다.
이러한 운동 해석의 대안으로 평형에 대한 농도 변화의 효과는 반응 지수 측면에서 합리화될 수 있다. 시스템이 평형상태일 때,
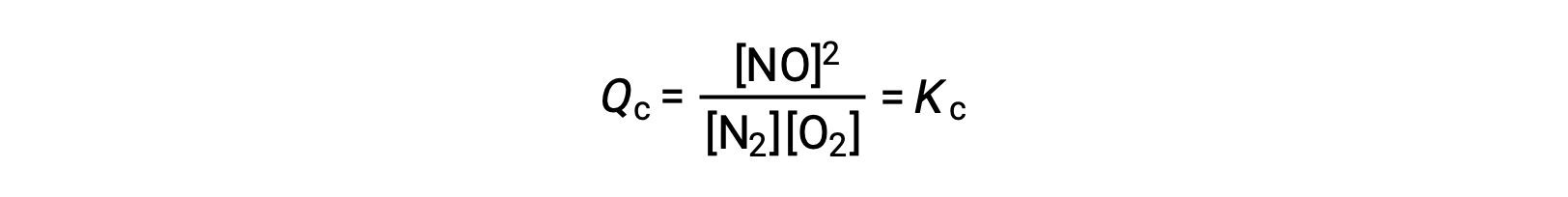
반응제가 추가되면(반응 지수의 분모 증가) 또는 제품이 제거(분자 감소), Q c&K c 및 평형이 오른쪽으로 이동합니다. 이 응력 유도의 세 가지 다른 방법은 평형 혼합물의 조성에 세 가지 다른 변화를 초래한다. N2가 첨가되면, 올바른 시프트가O2를 소비하고 평형이 재확립됨에 따라 NO를 생성하여 N2 및 NO의 농도가 크고O2의 농도가 이전보다 낮아집니다. O2를 첨가하면, 새로운 평형 혼합물은 O 2 및 NO의 더 큰 농도와 N2의 낮은 농도를 가질 것이다. 마지막으로, NO를 제거하면, 새로운 평형 혼합물은N2와 O 2의 더 큰 농도와 NO의 낮은 농도를 가질 것이다. 조성물의 이러한 차이에도 불구하고 평형 상수의 가치는 (대량 행동의 법칙에 따라) 이전과 같은 응력 후에 동일할 것이다. 동일한 논리는 반응제를 제거하거나 제품을 추가하는 것과 관련된 응력에 적용될 수 있으며, 이 경우 Qc> Kc와 평형이 왼쪽으로 이동합니다.
이 텍스트는 오픈 탁스, 화학 2e, 섹션 13.3 변속 평형에서 적응되었습니다 : LeChatelier의 원리.
