14.7:
Principe de Le Châtelier : modification de la concentration
14.7:
Principe de Le Châtelier : modification de la concentration
Un système à l’équilibre est dans un état d’équilibre dynamique, avec des réactions directe et inverse se déroulant à des vitesses égales. Si un système en équilibre est soumis à des modifications des conditions qui influencent ces vitesses de réaction différemment (une contrainte), alors les vitesses ne sont plus égales et le système n’est pas à l’équilibre. Le système connaîtra ensuite une réaction nette dans le sens d’une vitesse plus grande (un déplacement) qui permettra de rétablir l’équilibre. Ce phénomène est résumé par le principe de Le Châtelier : si un système en équilibre subit une contrainte, le système sera soumis à un changement en réponse à la contrainte qui rétablit l’équilibre.
Les vitesses de réaction sont principalement influencées par les concentrations, décrites par la loi de vitesse de la réaction, et par la température, telle que décrite par l’équation d’Arrhénius. Par conséquent, les modifications de la concentration et de la température sont les deux contraintes qui peuvent déplacer un équilibre.
Effet d’une modification de la concentration
Si un système en équilibre est soumis à une modification de la concentration d’une espèce de réactif ou de produit, la vitesse de la réaction directe ou inverse change. Prenons l’exemple de la réaction en équilibre :

Lorsque ce système est à l’équilibre, les vitesses des réactions directe et inverse sont égales.
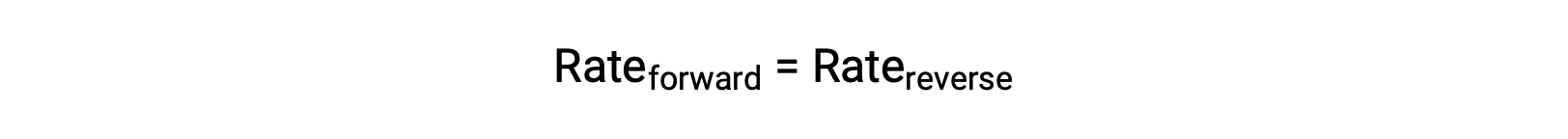
Si le système est contraint par l’ajout de réactif, N2 ou O2, l’augmentation de la concentration qui en résulte entraîne une augmentation de la vitesse da la réaction directe, dépassant celle de la réaction inverse :

Le système va subir une réaction nette temporaire dans le sens direct pour rétablir l’équilibre (l’équilibre se déplace vers la droite). Ce même déplacement se produit si un peu du produit NO est retiré du système, ce qui diminue la vitesse de la réaction inverse, entraînant à nouveau le même déséquilibre dans les vitesses.
La même logique peut être utilisée pour expliquer le déplacement à gauche qui résulte lorsqu’on enlève du réactif ou qu’on ajoute du produit à un système en équilibre. Ces deux contraintes entraînent une augmentation de la vitesse pour la réaction inverse

et une réaction nette temporaire dans le sens inverse pour rétablir l’équilibre.
Comme alternative à cette interprétation cinétique, l’effet des modifications de la concentration sur les équilibres peut être rationalisé en termes de quotients réactionnels. Lorsque le système est à l’équilibre,
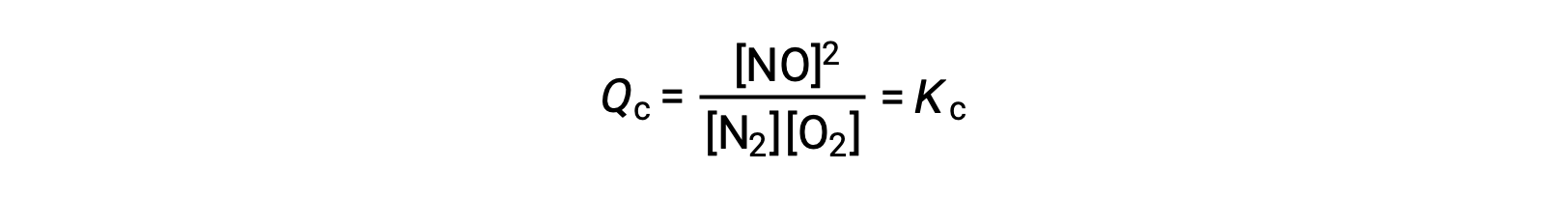
Si un réactif est ajouté (augmentant le dénominateur du quotient réactionnel) ou si du produit est enlevé (diminuant le numérateur), alors Qc < Kc et l’équilibre se déplacera vers la droite. Notez que les trois façons différentes d’induire cette contrainte entraînent trois changements différents dans la composition du mélange de l’équilibre. Si N2 est ajouté, le déplacement à droite consommera de l’O2 et produira du NO au fur et à mesure que l’équilibre se rétablit, donnant un mélange avec une plus grande concentration de N2 et de NO et une plus faible concentration d’O2 que celle qui était présente auparavant. Si O2 est ajouté, le nouveau mélange de l’équilibre aura des concentrations plus élevées d’O2 et de NO et une concentration moindre de N2. Enfin, si on enlève du NO, le nouveau mélange d’équilibre aura des concentrations plus élevées de N2 et d’O2 et une concentration moindre de NO. Malgré ces différences de composition, la valeur de la constante d’équilibre sera la même après et avant la contrainte (selon la loi d’action de masse). La même logique peut être appliquée pour les contraintes impliquant la suppression de réactifs ou l’ajout de produit, auquel cas Qc > Kc et l’équilibre se déplacera vers la gauche.
Ce texte a été adapté d’Openstax, Chimie 2e, Section 13.3 Déplacements d’équilibres : le principe de Le Chatelier.
