16.2:
Solutions tampons
16.2:
Solutions tampons
Une solution contenant des quantités suffisantes d’un couple acide-base conjugué faible est appelée une solution tampon. Les solutions tampons résistent à un changement de pH lorsque de petites quantités d’un acide fort ou d’une base forte sont ajoutées. Une solution d’acide acétique et d’acétate de sodium est un exemple de tampon qui se compose d’un acide faible et de son sel : CH3COOH (aq) + CH3COONa (aq). Un exemple de tampon qui consiste en une base faible et son sel est une solution d’ammoniac et de chlorure d’ammonium : NH3 (aq) + NH4Cl (aq).
Fonctionnement des tampons
Pour illustrer la fonction d’une solution tampon, considérons un mélange d’acide acétique et d’acétate de sodium en quantités à peu près égales. La présence d’un couple acide-base conjugué faible dans la solution confère la capacité à neutraliser des quantités modestes d’acide fort ou de base forte ajoutés. Par exemple, l’ajout d’une base forte à cette solution neutralise l’ion hydronium et déplace l’équilibre d’ionisation de l’acide acétique vers la droite, rétablissant partiellement la concentration de H3O+ diminuée :
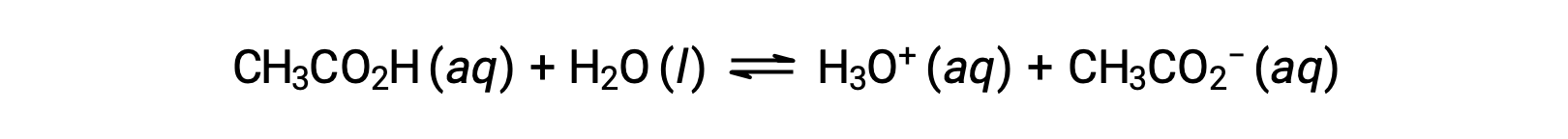
De même, l’ajout d’un acide fort à cette solution tampon neutralisera l’ion acétate, déplaçant l’équilibre d’ionisation ci-dessus vers la droite et ramenant [H3O+] à sa valeur d’origine. La figure 1 présente une illustration graphique des modifications apportées à la solution tampon lorsque de l’acide fort et de la base forte sont ajoutés. L’action tampon de la solution est essentiellement le résultat de la conversion de l’acide fort et de la base forte ajoutés en acide et en base faibles qui constituent le couple conjugué du tampon. L’acide et la base les plus faibles subissent seulement une légère ionisation, par rapport à l’ionisation complète de l’acide fort et de la base forte. Le pH de la solution change donc beaucoup moins que dans une solution sans tampon.
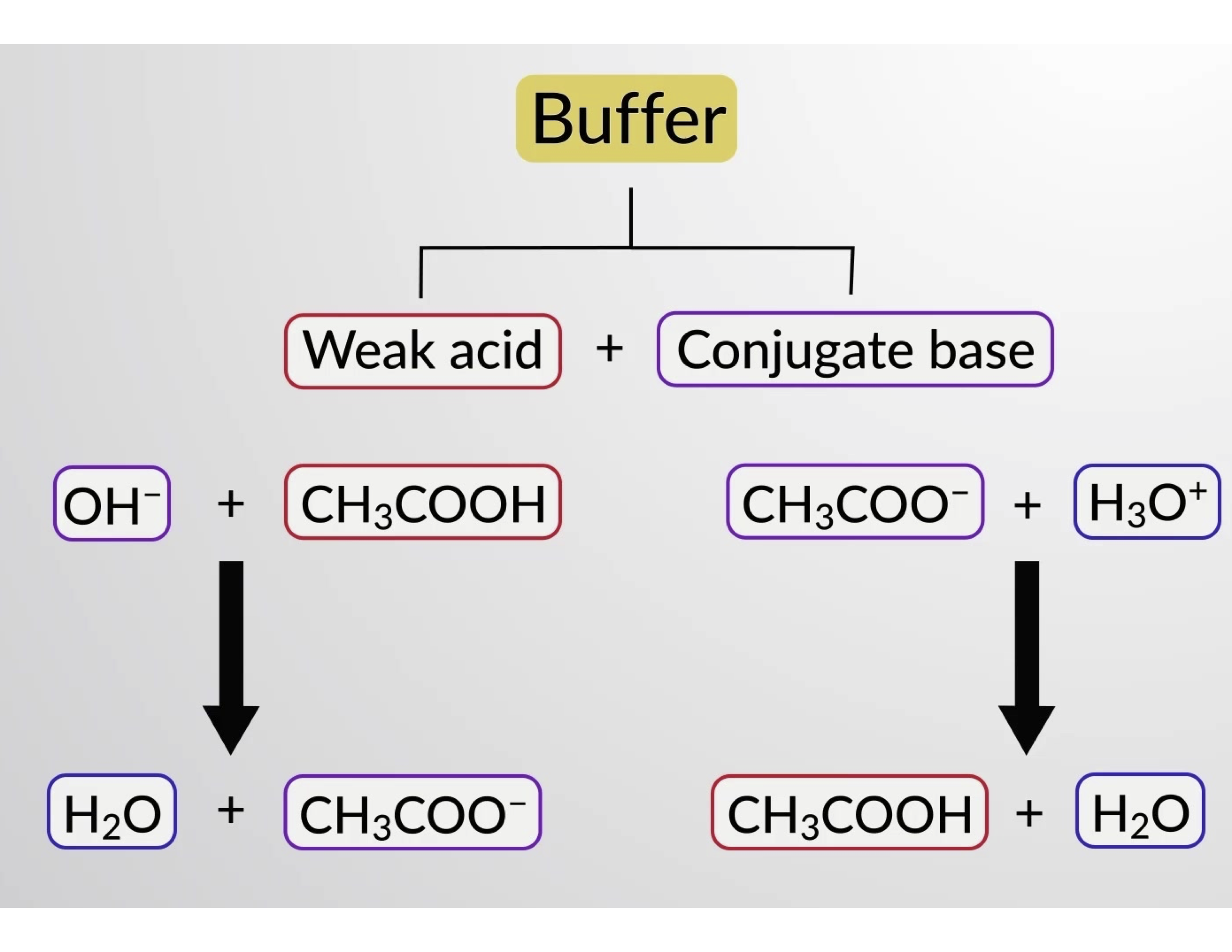
Figure 1. Action tampon dans un mélange d’acide acétique et de sel d’acétate.
Ce texte est adapté de Openstax, Chimie 2e, Section 14.6 : Tampons.
