16.2:
Буферы
16.2:
Буферы
раствор, содержащий значительное количество слабой сопряженной пары кислотно-основная, называется буферным раствор, или буфером. Буферные растворы устойчивы к изменению pH при добавлении небольшого количества сильной кислоты или сильного основание. раствор уксусной кислоты и ацетата натрия является примером буфера, который состоит из слабой кислоты и её соли: CH3COOH (aq) + CH3COONa (aq). Примером буфера, который состоит из слабого основание и его соли, является раствор аммиака и хлорида аммония: NH3 (aq) + NH4Cl (aq).
Как работают буферы
Чтобы проиллюстрировать функцию буферного раствор, рассмотрите смесь примерно равного количества уксусной кислоты и ацетата натрия. Наличие слабой пары сопряженных кислотно-основная в раствор ограничивает способность нейтрализовать умеренное количество добавленной сильной кислоты или основание. Например, добавление сильного основание к этому раствор нейтрализует ион-гидроний и смеет равновесие ионизации уксусной кислоты вправо, частично восстанавливая пониженную концентрацию H3O+:
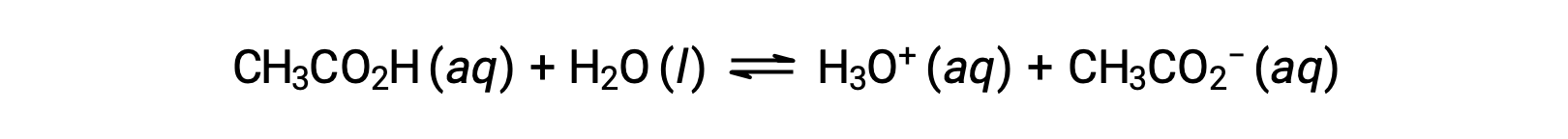
Кроме того, добавление сильной кислоты в этот буфер раствор нейтрализует ацетатный ион, смещая вышеуказанное равновесие ионизации вправо и возвращая [H3O+] к исходному значению. На рис. 1 представлена графическая иллюстрация изменений буферного раствор при добавлении сильной кислоты и основание. Буферизация раствор по существу является результатом того, что добавленная сильная кислота и основание были преобразованы в слабую кислоту и основание, которые составляют сопряженную пару буфера. Более слабая кислота и основание подвергаются лишь незначительной ионизации по сравнению с полной ионизацией сильной кислоты и основание. Таким образом, показатель pH раствор изменяется гораздо менее резко, чем в небуферизованном раствор.
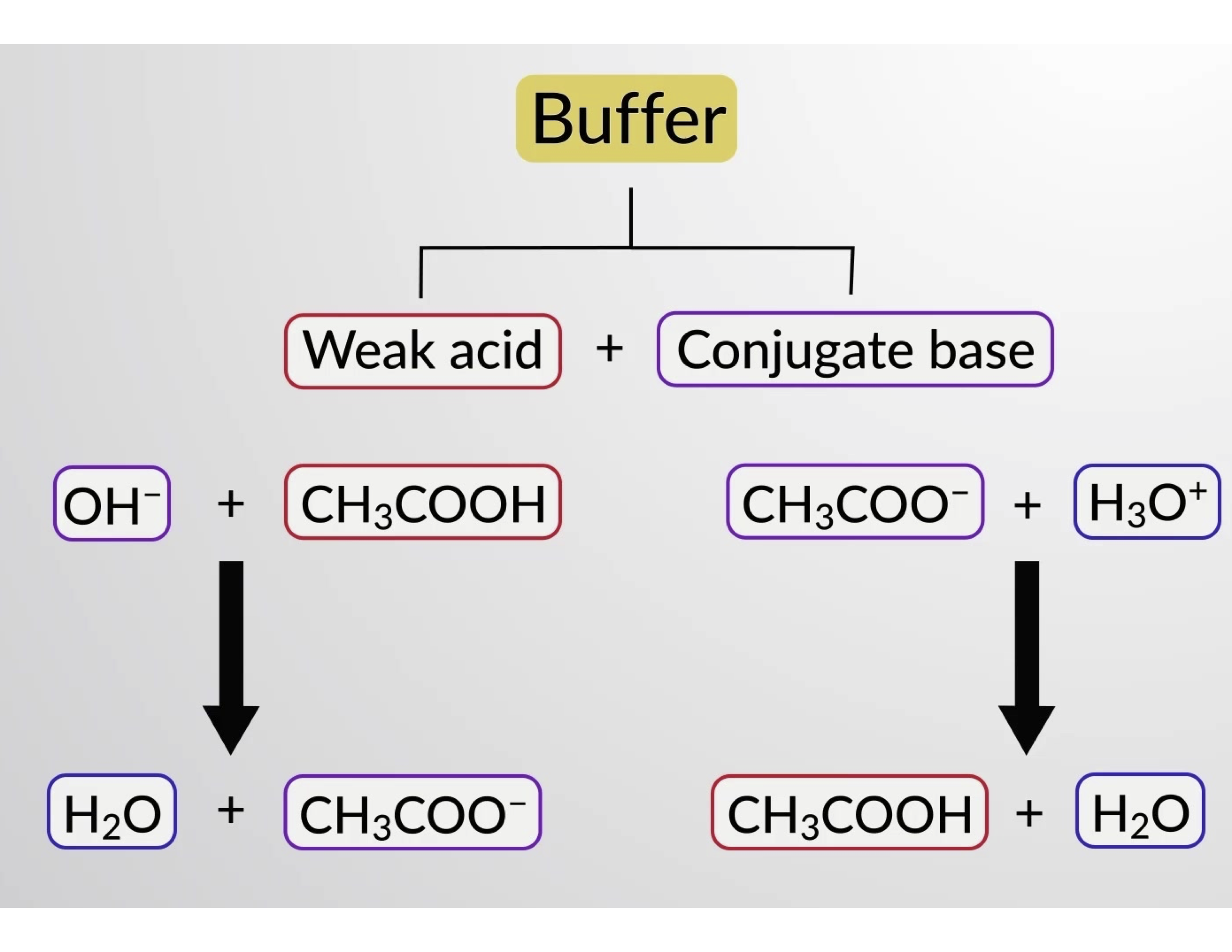
Рисунок 1. Буферизация в смеси уксусной кислоты и ацетатной соли.
Этот текст адаптирован из Openstax, Химия 2е изд., раздел 14.6: Буферы.
