16.2:
Amortiguadores
16.2:
Amortiguadores
Una solución que contiene cantidades apreciables de un par ácido-base conjugado débil se denomina solución tampón o amortiguador. Las soluciones tampón resisten un cambio en el pH cuando se añaden pequeñas cantidades de un ácido fuerte o una base fuerte. Una solución de ácido acético y acetato de sodio es un ejemplo de un amortiguador que consiste en un ácido débil y su sal: CH3COOH (ac) + CH3COONa (ac). Un ejemplo de un tampón que consiste en una base débil y su sal es una solución de amoníaco y cloruro de amonio: NH3 (ac) + NH4Cl (ac).
Cómo funcionan los amortiguadores
Para ilustrar la función de una solución tampón o amortiguador, considere una mezcla de cantidades aproximadamente iguales de ácido acético y acetato de sodio. La presencia de un par ácido-base conjugado débil en la solución imparte la capacidad de neutralizar cantidades modestas de ácido fuerte o base añadidos. Por ejemplo, al añadir una base fuerte a esta solución se neutralizará el ion hidronio y se desplazará el equilibrio de ionización del ácido acético hacia la derecha, restaurando parcialmente la concentración reducida de H3O+:
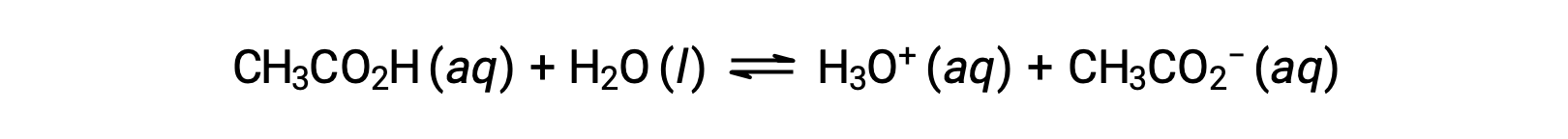
Asimismo, al añadir un ácido fuerte a esta solución tampón se neutralizará el ión acetato, desplazando el equilibrio de ionización anterior hacia la derecha y restaurando la [H3O+] cerca de su valor original. La figura 1 proporciona una ilustración gráfica de los cambios en la solución tampón cuando se añaden ácidos y bases fuertes. La acción amortiguadora de la solución es esencialmente el resultado de la conversión del ácido y la base fuerte añadidos en el ácido y la base débil que conforman el par conjugado del amortiguador. El ácido y la base más débiles experimentan sólo una ligera ionización, en comparación con la ionización completa del ácido y la base fuerte. El pH de la solución, por lo tanto, cambia mucho menos drásticamente que en una solución sin tampón.
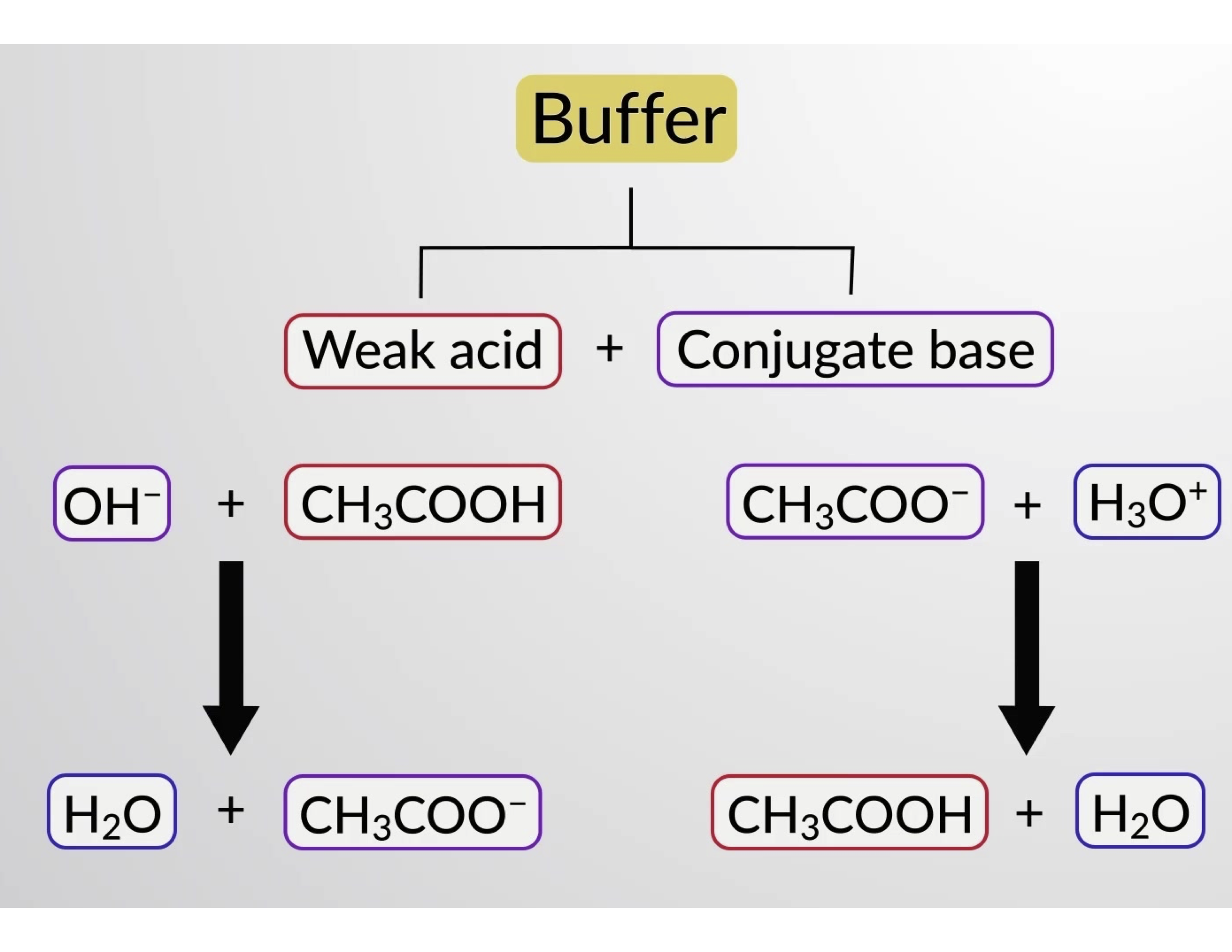
Figura 1.Acción amortiguadora en una mezcla de ácido acético y sal de acetato.
Este texto es adaptado de Openstax, Química 2e, Sección 14.6: Amortiguadores.
