16.2:
Buffer
16.2:
Buffer
Una soluzione contenente quantità apprezzabili di una coppia acido-base coniugata debole è chiamata soluzione tampone o tampone. Le soluzioni tampone resistono a un cambiamento di pH quando vengono aggiunte piccole quantità di acido forte o una base forte. Una soluzione di acido acetico e acetato di sodio è un esempio di tampone costituito da un acido debole e dal suo sale: CH3COOH (aq) + CH3COONa (aq). Un esempio di tampone costituito da una base debole e dal suo sale è una soluzione di ammoniaca e cloruro di ammonio: NH3 (aq) + NH4Cl (aq).
Come funzionano i buffer
Per illustrare la funzione di una soluzione tampone, considerare una miscela di quantità approssimativamente uguali di acido acetico e acetato di sodio. La presenza di una debole coppia acido-base coniugata nella soluzione conferisce la capacità di neutralizzare modeste quantità di acido o base forte aggiunto. Ad esempio, l’aggiunta di una base forte a questa soluzione neutralizzerà lo ione idronio e sposterà l’equilibrio di ionizzazione dell’acido acetico a destra, ripristinando parzialmente ladiminuzione della concentrazionedi H 3 O+:
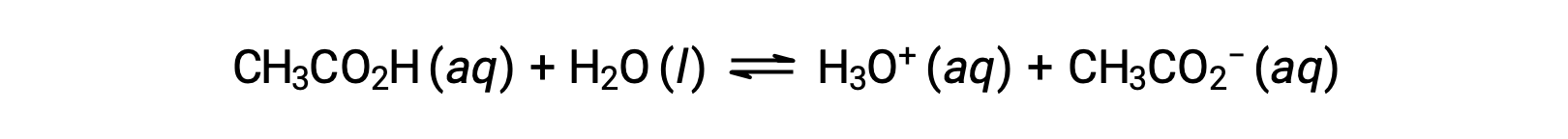
Allo stesso modo, l’aggiunta di un acido forte a questa soluzione tampone neutralizzerà lo ione acetato, spostando a destra l’equilibrio di ionizzazione di cui sopra e restituendo [H3O+] al suo valore originale. La figura 1 fornisce un’illustrazione grafica delle modifiche apportate alla soluzione tampone quando vengono aggiunti acido e base forti. L’azione tamponamento della soluzione è essenzialmente il risultato della conversione dell’acido forte e della base aggiunti nell’acido debole e nella base che coesistono nella coppia coniugata del buffer. L’acido e la base più deboli subiscono solo una leggera ionizzazione, rispetto alla completa ionizzazione dell’acido forte e della base. Il pH della soluzione, quindi, cambia molto meno drasticamente di quanto non farebbe in una soluzione senza buffer.
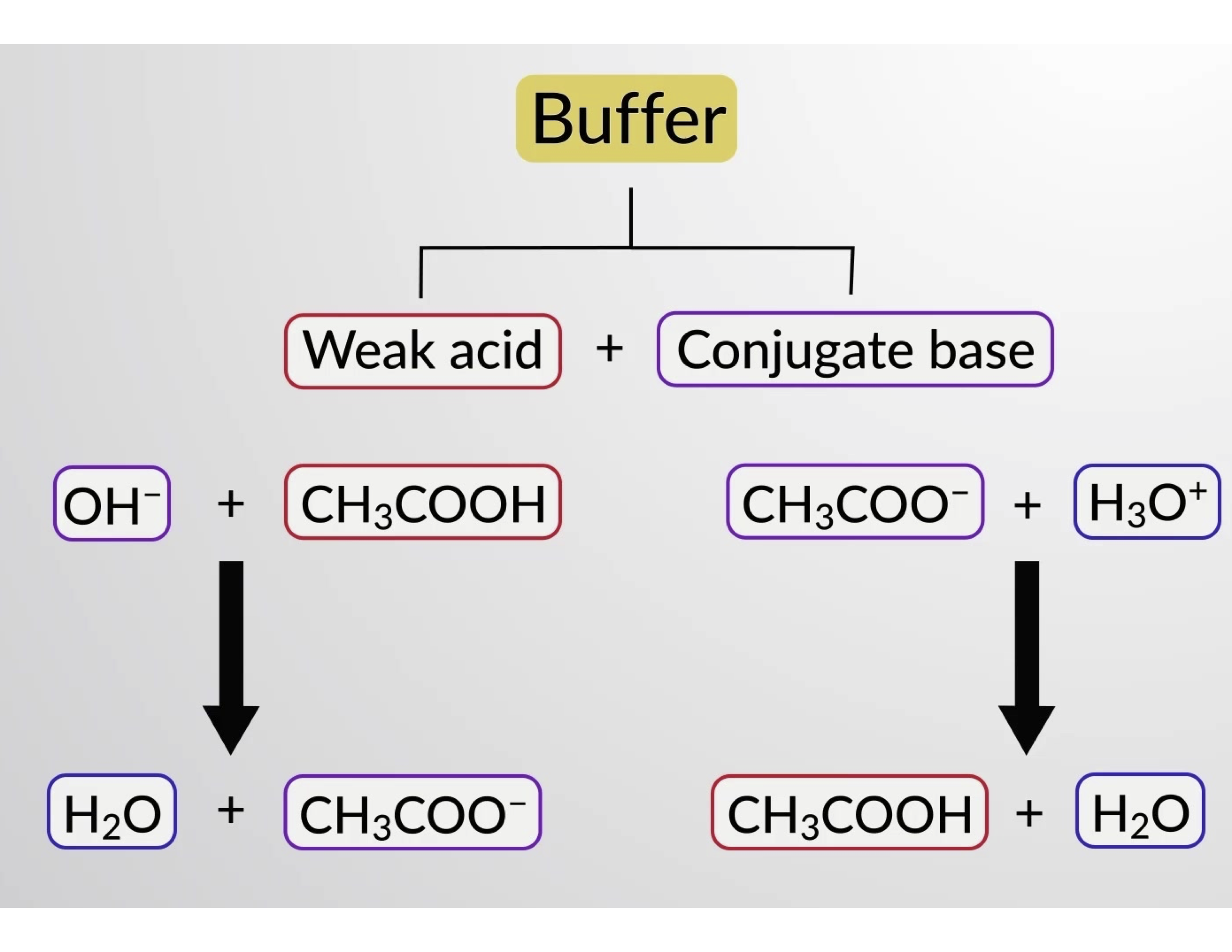
Figura 1. Azione tamponante in una miscela di acido acetico e sale acetato.
Questo testo è adattato da Openstax, Chimica 2e, Sezione 14.6: Buffers.
