17.5:
تغيير الإنتروبيا القياسي للتفاعل
17.5:
تغيير الإنتروبيا القياسي للتفاعل
إن الانتروبيا هي إحدى وظائف الحالة، لذا يمكن حساب التغيير القياسي في الانتروبيا لتفاعل كيميائي ΔS°rxn) من الفرق في الانتروبيا القياسية بين المنتجات والمواد المتفاعلة.
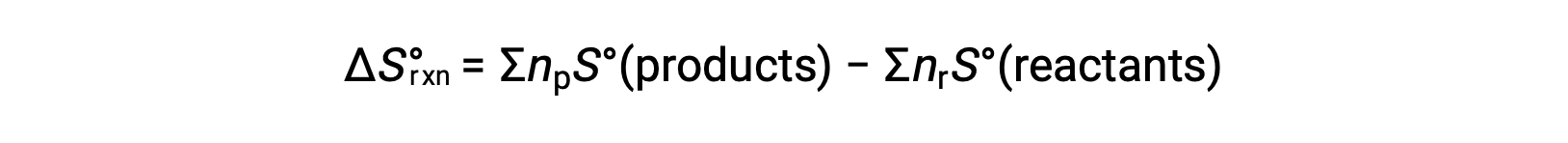
حيث تمثلnp و nr المعاملات المتكافئة في المعادلة المتوازنة للمنتجات والمواد المتفاعلة على التوالي.
على سبيل المثال، ΔS°rxn للتفاعل التالي في درجة حرارة الغرفة
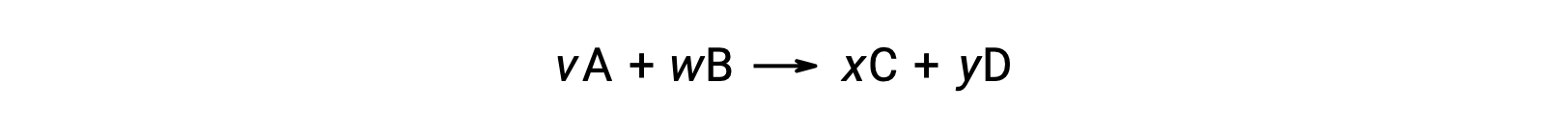
يتم حسابه على النحو التالي:
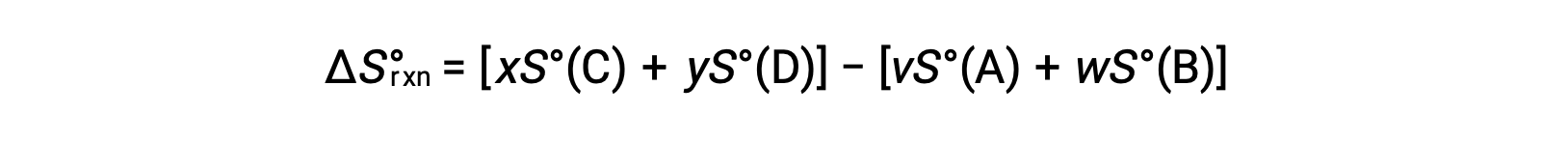
يتم توفير قائمة جزئية للانتروبيا القياسية في الجدول.
| مادة | S° (J/mol·K) |
| C (s, الجرافيت) | 5.740 |
| C (s, الألماس) | 2.38 |
| CO (g) | 197.7 |
| CO2 (g) | 213.8 |
| CH4 (g) | 186.3 |
| C2H4 (g) | 219.5 |
| C2H6 (g) | 229.5 |
| CH3OH (l) | 126.8 |
| C2H5OH (l) | 160.7 |
| H2 (g) | 130.57 |
| H (g) | 114.6 |
| H2O (g) | 188.71 |
| H2O (l) | 69.91 |
| HCI (g) | 186.8 |
| H2S (g) | 205.7 |
| O2 (g) | 205.03 |
تحديد ΔS°
ضع في اعتبارك تكثيف الماء، حيث يتغير مول واحد من H2O الغازي إلى مول واحد من السائلH2O.
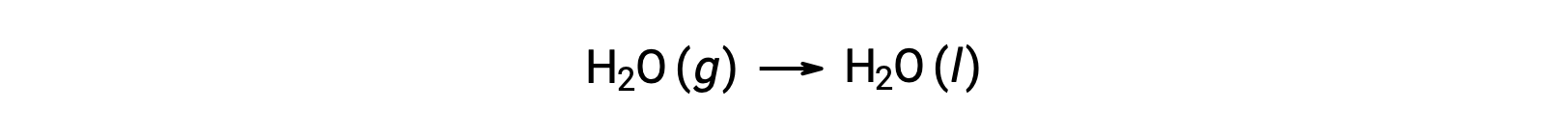
تغيرات الانتروبيا المعيارية للتفاعل، ΔS°rxn يتم حسابها باستخدام الانتروبيا المولية القياسية ومعاملات القياس المتكافئ.
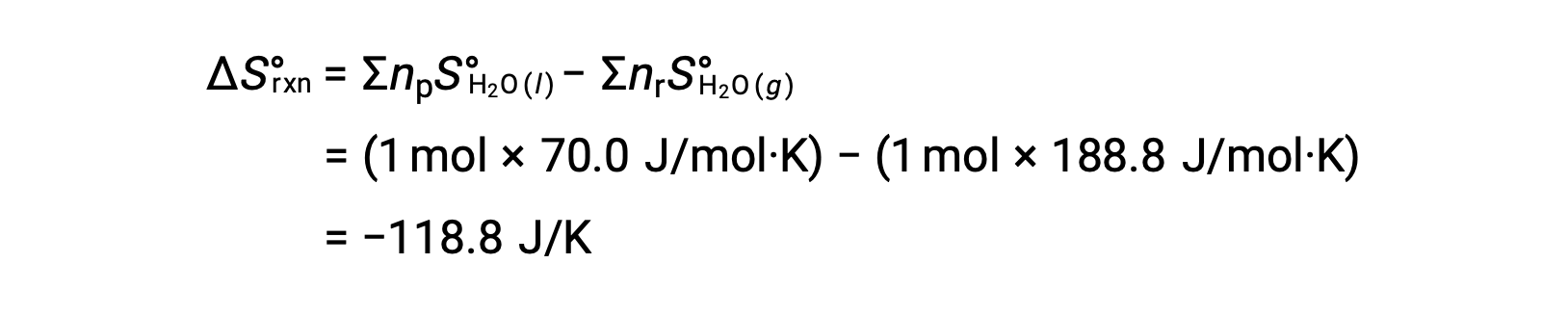
قيمة ΔS°rxn سالبة، كما هو متوقع لانتقال المرحلة (التكثيف).
كمثال ثانٍ، ضع في اعتبارك احتراق الميثانول، CH3OH:
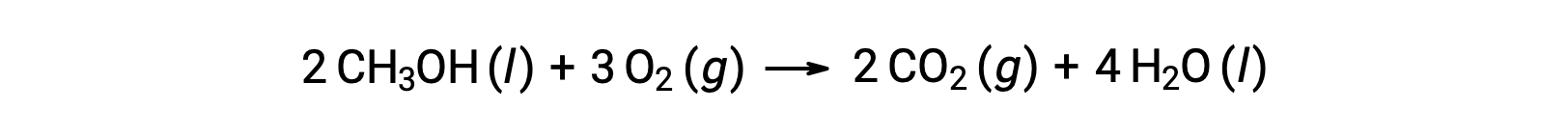
يتم اتباع نفس الإجراء لحساب تغيير الانتروبيا القياسي للتفاعل:
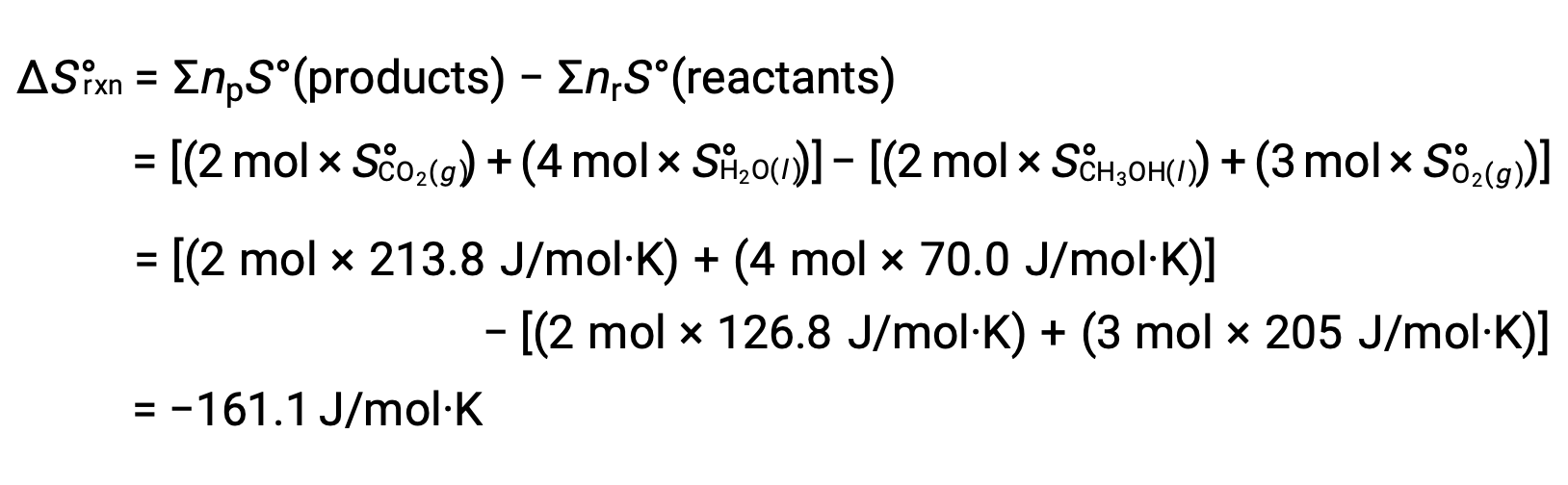
هذا النص مقتبس من Openstax, Chemistry 2e, Chapter 16.2: The Second and Third Law of Thermodynamics.
