17.5:
반응의 표준 엔트로피 변화
A subscription to JoVE is required to view this content. Sign in or start your free trial.
JoVE Core
Chemistry
Standard Entropy Change for a Reaction
화학 반응과 관련된 엔탈피 변화는 열량계로 측정할 수 있지만 반응과 관련된 엔트로피 변화는 직접 측정할 수 없습니다. 엔트로피는 상태 함수이며 이것은 엔트로피의 변화가 계의 초기 상태와 최종 상태에만 의존한다는 것을 의미합니다. 따라서 엔탈피 변화와 마찬가지로 엔트로피 변화도 계산된 표준 몰 엔트로피 기준표에서 얻어질 수 있습니다.표준 조건에서 발생하는 반응에 대해 관련 엔트로피 변화는 생성물의 표준 몰 엔트로피 합계에 화학양론계수를 곱한 반응물의 표준 몰 엔트로피 합계에 화학양론계수를 곱한 값 사이의 차이에 의해 결정됩니다. 표준 조건에서 에틸렌 가스 1몰이 산소 가스 3몰과 반응하여 이산화탄소 가스 2몰과 물 2몰을 생성하는 에틸렌의 연소를 생각해보십시오. 반응에 대한 표준 엔트로피 변화는 이산화탄소 기체의 표준 엔트로피의 2배와 물의 표준 엔트로피의 2배의 합에서 에틸렌 기체의 표준 엔트로피와 산소의 표준 엔트로피의 3배의 합을 뺀 값과 같습니다.0의 값을 가지는 원소의 표준 엔탈피와 달리 모든 물질의 표준 몰 엔탈피는 298 켈빈에서 0보다 크다는 것을 알아두십시오. 기준 표에서 반응물 및 생성물의 몰 엔트로피 값을 대체하면 2 x 213.8 2 x 70.0 219.5 3 x 205.3 이 산출됩니다. 생성물의 순 엔트로피는 켈빈당 567.6줄, 반응물의 순 엔트로피는 켈빈당 835.4줄입니다.생성물과 반응물 간의 차이는 에틸렌 연소에 의한 표준 엔트로피 변화에 대해 켈빈당 음의 268줄과 같습니다. 음수 값은 엔트로피가 감소함을 나타냅니다. 정확한 엔트로피 변화를 계산하지 않더라도 반응을 조사하여 엔트로피의 감소를 예측할 수 있습니다.기체가 액체보다 더 무질서하다는 것을 상기시킵니다. 다른 생성물은 액체이고 다른 생성물은 단지 2몰의 이산화탄소 기체만 있는 데 비해 반응물에는 더 많은 몰의 기체, 1몰의 에틸렌과 3몰의 산소를 포함한 4몰의 기체가 있습니다. 따라서 이 반응에서 반응물은 생성물보다 더 무질서합니다.따라서 반응이 진행됨에 따라 엔트로피는 감소합니다.
17.5:
반응의 표준 엔트로피 변화
엔트로피는 상태 기능이므로 화학 반응(ΔS°rxn)에대한 표준 엔트로피 변화는 제품과 반응제 간의 표준 엔트로피의 차이로부터 계산될 수 있다.
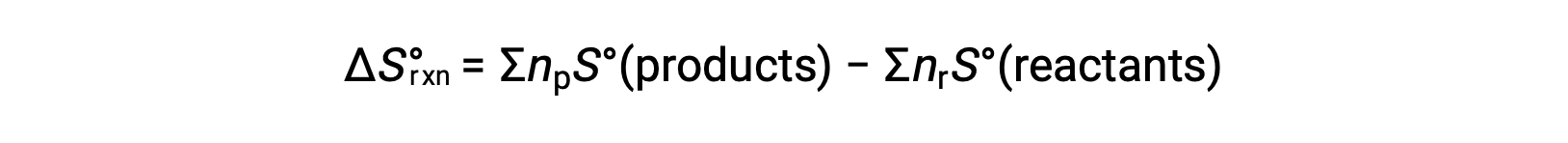
여기서 np 및 nr은 제품 및 반응제의 균형 잡힌 방정식에서 stoichiometric 계수를 각각 나타낸다.
예를 들어,실온에서 다음 반응을 위한 ΔS°rxn
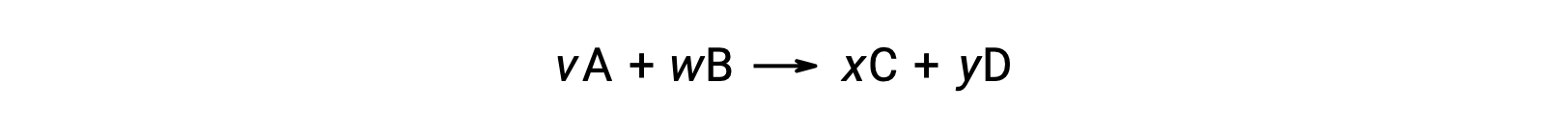
다음과 같이 계산됩니다.
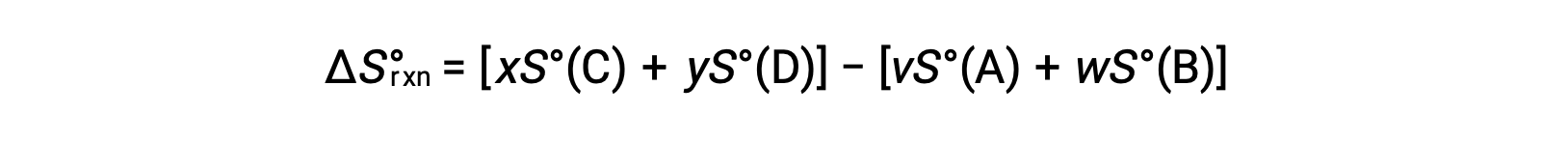
표준 엔트로피의 부분 목록이 표에 제공됩니다.
| 물질 | S° (J / mol· K) |
| C(s,흑연) | 5.740 |
| C(s,다이아몬드) | 2.38 |
| CO(g) | 197.7 |
| CO2 (g) | 213.8 |
| CH4 (g) | 186.3 |
| C2H4 (g) | 219.5 |
| C2H6 (g) | 229.5 |
| CH3OH(l) | 126.8 |
| C2H5OH(l) | 160.7 |
| H2 (g) | 130.57 |
| H(g) | 114.6 |
| H2O(g) | 188.71 |
| H2O(l) | 69.91 |
| HCI(g) | 186.8 |
| H2S(g) | 205.7 |
| O2 (g) | 205.03 |
ΔS°의 결정
기체 H2O의 1 두더지가 액체 H2O의 1 두더지로 변경되는 물의 응축을 고려하십시오.
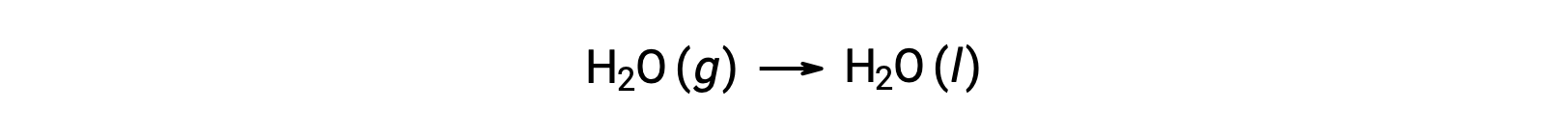
반응에 대한 표준 엔트로피 변화, ΔS°rxn은 표준 어음 엔트로피 및 스토이치오메트릭 계수를 사용하여 계산된다.
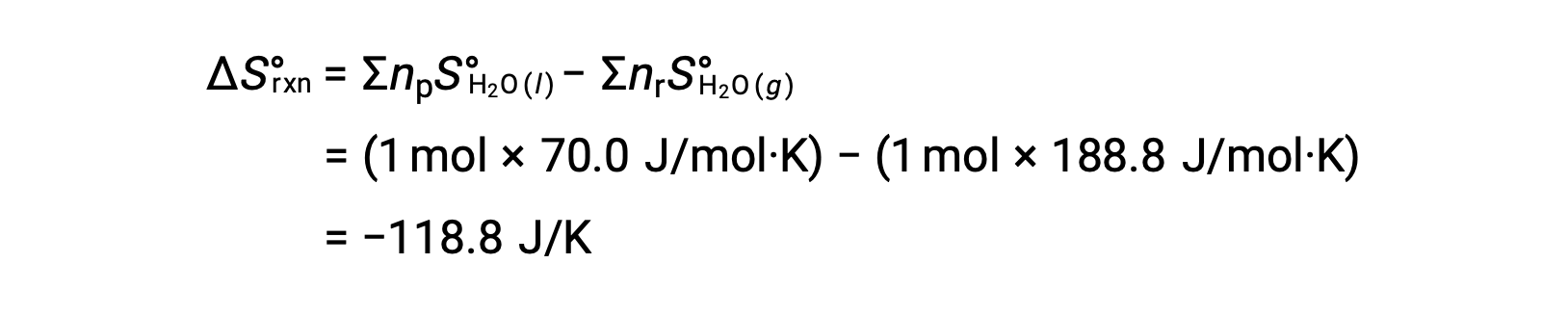
ΔS°rxn의 값은 이 위상 전환(응축)에 예상대로 음수입니다.
두 번째 예로, 메탄올, CH3OH의 연소를 고려하십시오.
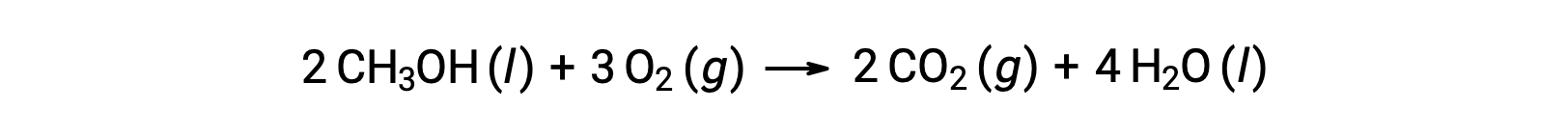
반응의 표준 엔트로피 변화를 계산하기 위해 동일한 절차가 수행됩니다.
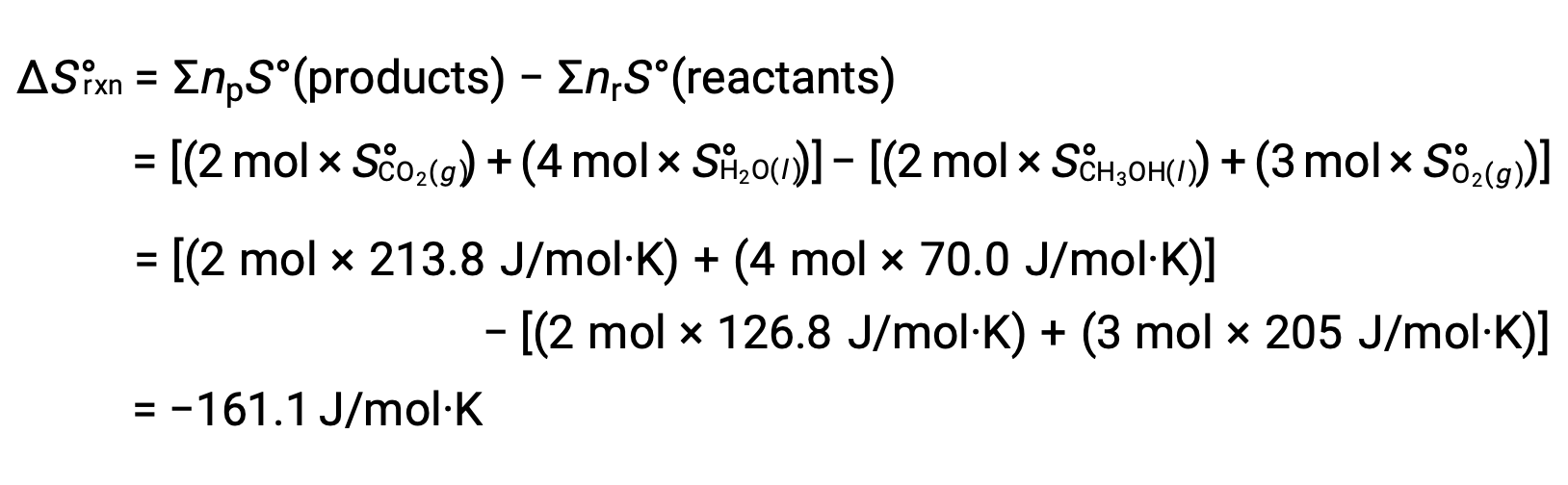
이 텍스트는 Openstax, 화학 2e, 제 16.2 장: 열역학의 두 번째 및 세 번째 법칙에서 채택됩니다.
