17.5: 反応における標準エントロピーの変化
エントロピーは状態関数なので、化学反応の標準エントロピー変化( ΔS°rxn )は、生成物と反応物の標準エントロピーの差から計算できます。
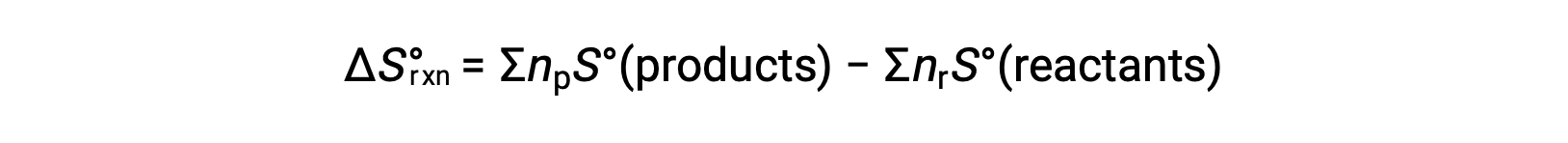
ここで、npとnrは、それぞれ生成物と反応物の平衡式における化学量論的な係数を表します。
例えば、室温での次のような反応における ΔS°rxn
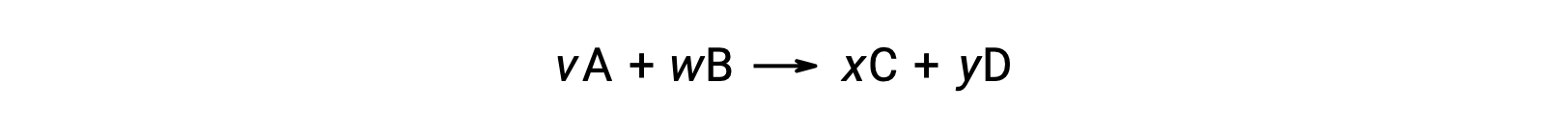
は、次のように計算できます。
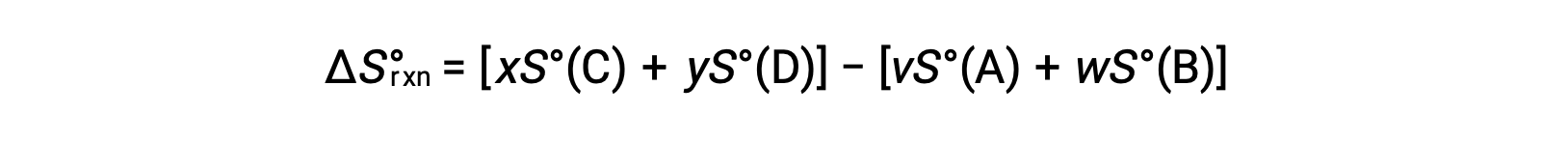
標準的なエントロピーの一部を表にまとめました。
| 物質 | S° (J/mol·K) |
| C (s, graphite) | 5.740 |
| C (s, diamond) | 2.38 |
| CO (g) | 197.7 |
| CO2 (g) | 213.8 |
| CH4 (g) | 186.3 |
| C2H4 (g) | 219.5 |
| C2H6 (g) | 229.5 |
| CH3OH (l) | 126.8 |
| C2H5OH (l) | 160.7 |
| H2 (g) | 130.57 |
| H (g) | 114.6 |
| H2O (g) | 188.71 |
| H2O (l) | 69.91 |
| HCI (g) | 186.8 |
| H2S (g) | 205.7 |
| O2 (g) | 205.03 |
ΔS°の決定
気体のH2O 1 molが液体のH2O 1 molに変化する水の凝縮を考えます。
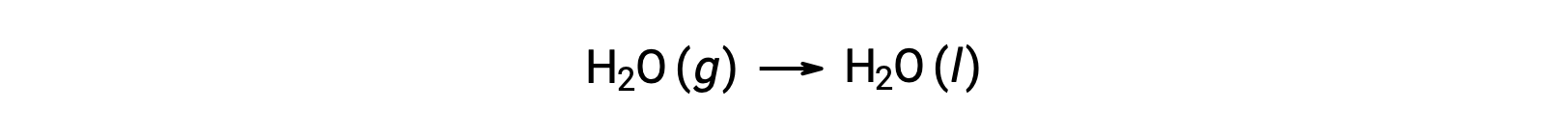
反応に対する標準エントロピー変化である ΔS°rxn を、標準モルエントロピーと化学量論的係数を用いて計算します。
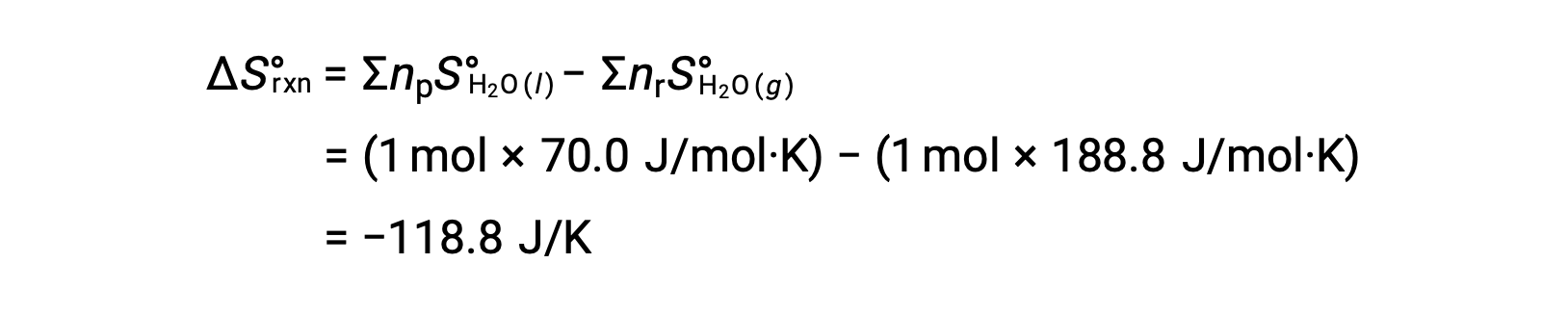
ΔS°rxnの値は、この相転移(凝縮)で予想されるように負の値を示しています。
2つ目の例として、メタノール(CH3OH)の燃焼を考えます。
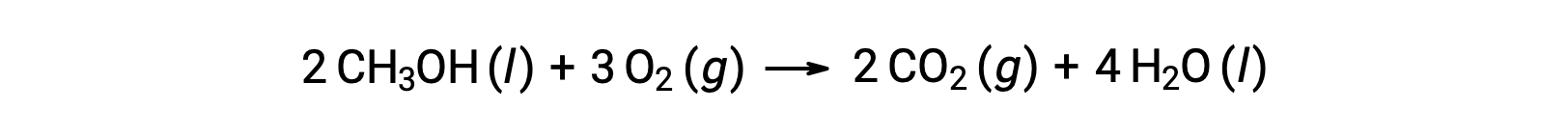
同様の手順で、反応の標準エントロピー変化を計算すると、次のようになります。
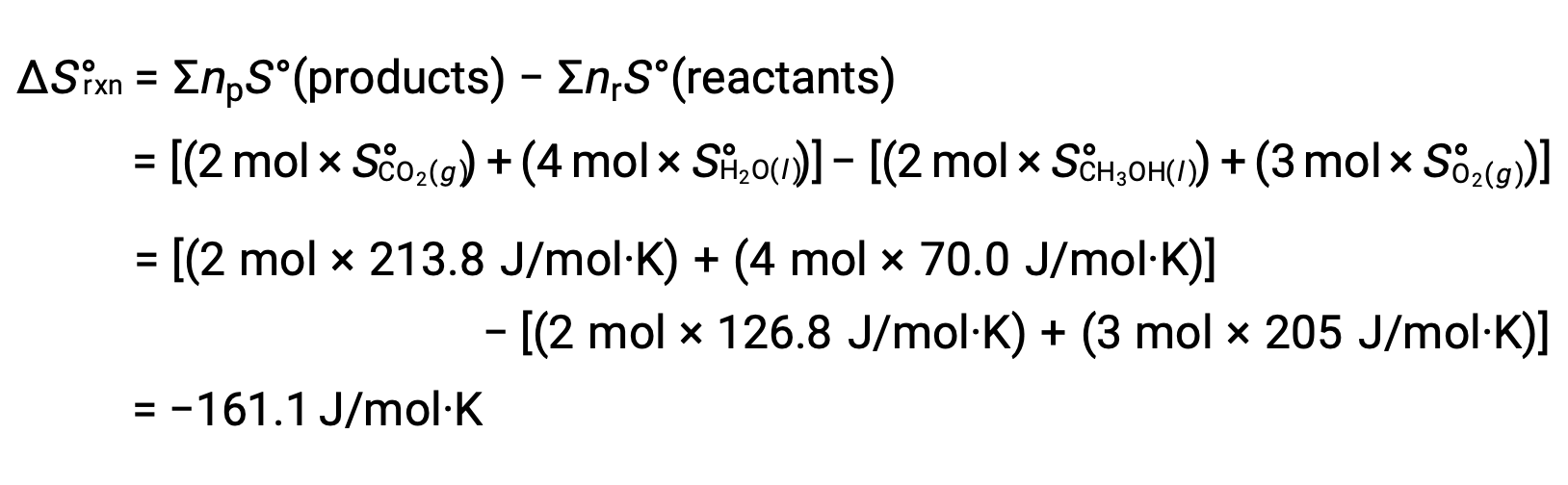
上記の文章は以下から引用しました。Openstax, Chemistry 2e, Chapter 16.2: The Second and Third Law of Thermodynamics.


