18.6:
能斯特方程(Nernst equation)
18.6:
能斯特方程(Nernst equation)
非标准反应条件
标准电池电势与各种热力学参数 (如标准自由能变化 G° 和平衡常数 K) 之间的互联之前已经过探讨。 例如,在 Eºcell = +0.291 V 和 ΔG° = −56.2 kJ 的情况下,在 1 M 浓度下发生的氧化还原反应 (含锌 (II) 和锡 (II) 离子) 是自发的。
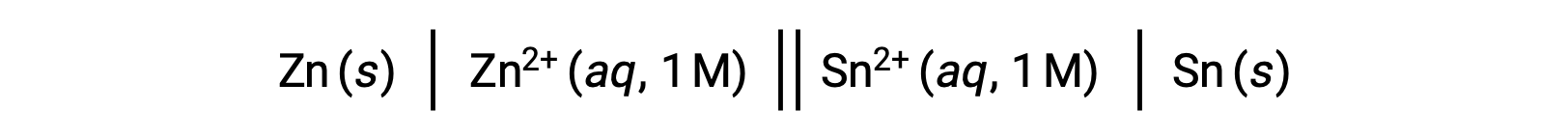
但是,释放此单元格会导致反应物浓度发生变化,电池电势也会稳步下降。 但是,在这种情况下,电池电势和热动力参数之间的关系不容易建立,因为它们只在浓度,温度和压力 (即 1 M 浓度, 298 K 或 25 °C 以及 1 个大气压力) 的标准化条件下才是真实的。 许多具有重大科学意义的氧化还原反应发生在非标准状态下,例如,在原电池(伽凡尼电池)或浓度梯度中,生物膜出现不同的反应物浓度。 因此,必须计算这种系统的潜力。
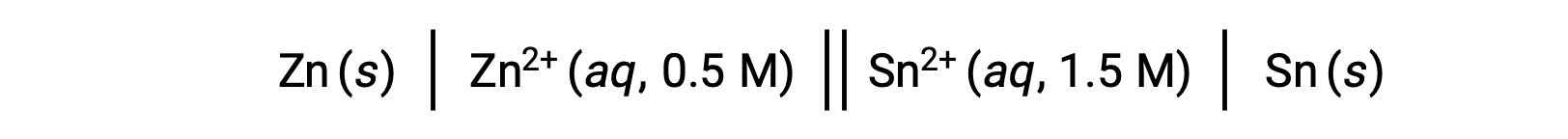
当反应中的锌离子浓度较小,锡离子的浓度比标准条件大时,氧化还原反应的自发性可以通过 勒夏特列原理(Le Chatelier’s Principle) 进行定性的预测。 鉴于生成物对反应物的浓度越高,反应就越倾向于朝着有利于生成物代人的方向前进。 这会导致电池电势值或 Ecell 高于 E°单元格值。
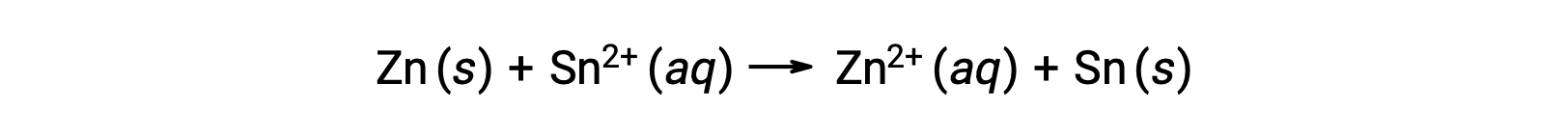
这种反应朝着前进的方向发展;但是,无法轻易确定此电池电势的定量的值。
在下发生的氧化还原反应的 能斯特方程(Nernst equation) 派生 非标准条件
Ecell 和 E°单元格值之间的关系可以从自由能变化在标准和非标准条件下之前建立的关系中导出,具体如下:
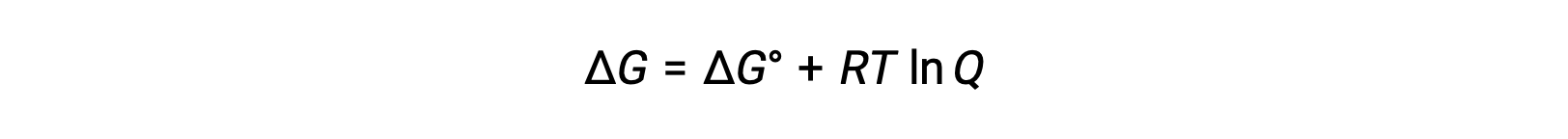
ΔG 是自由能的变化, ΔG° 是自由能的标准变化, R 是气体常数 (值 = 8.314 焦耳 / 摩尔∙K) , Q 是反应商,这是由于反应混合物成分的差异,自由能的变化。 如果反应物为实心,则忽略 Q 值。
替换与自由能电池电势更改相关的方程时,将获得一个已修改的方程,称为 能斯特方程(Nernst equation)。
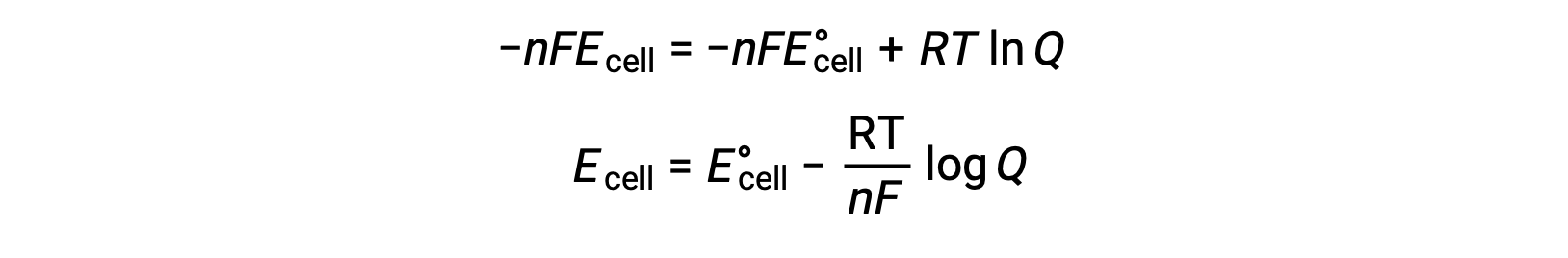
能斯特方程(Nernst equation) 描述了氧化还原系统 (如原电池(伽凡尼电池)) 与其标准状态值之间的电位变化。 它取决于氧化还原反应过程中传输的电子数量, n ,以开氏, T 为单位测得的温度以及以 Q 为单位给出的反应混合物成分
对于大多数工作, 能斯特方程(Nernst equation) 的简化形式是包含基本常量 (R 和 F) 的值以及从自然日志转换为基 -10 对数的系数:
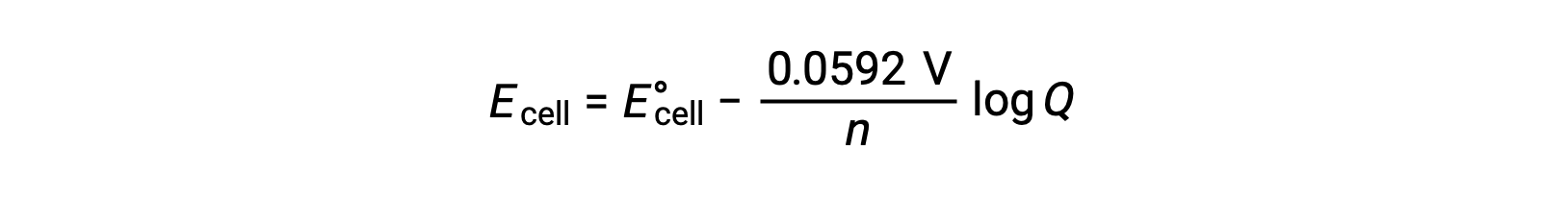
在标准状态条件下,反应商 Q 的值为单位,其对数为零。 这是由于在标准状态条件下反应物和生成物的浓度相等。 此处, Ecell 等于 E°cell。 Q 值小于 One 表示反应物的浓度较高,将反作用平衡向右移动,从而产生较高的电池电势值。 Q 值大于 1 表示生成物浓度越高,左侧的反应越大,电池电势的值越低。 在平衡, Q 值等于 K ,电池电势变为零,即,反应表明没有朝任何一个方向继续的趋势。 这解释了电池在连续放电时“没电”的原因:反应物浓度的下降推动了对平衡的反应,而其电池电势稳步下降到零。
