18.6:
Nernst Denklemi
18.6:
Nernst Denklemi
Standart Olmayan Reaksiyon Koşulları
Standart hücre potansiyelleri ile standart serbest enerji değişimi ΔG° ve denge sabiti K gibi çeşitli termodinamik parametreler arasındaki bağlantı daha önce araştırılmıştır. Örneğin, Eºhücre = +0,291 V ve ΔG° = −56,2 kJ ile 1 M konsantrasyonda çinko(II) ve kalay(II) iyonlarını içeren bir redoks reaksiyonu spontandır.
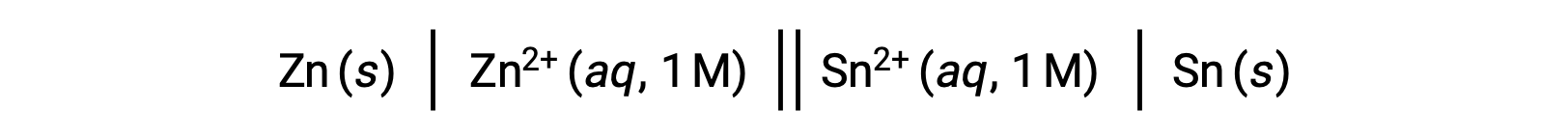
Bununla birlikte, bu hücrenin deşarjı, reaktan konsantrasyonunda bir değişikliğe ve hücre potansiyelinde sürekli bir azalmaya neden olur. Bununla birlikte, böyle bir durumda, hücre potansiyeli ile termodinamik parametreler arasındaki ilişkiler, sadece standart konsantrasyon, sıcaklık ve basınç koşullarında (yani, 1 M konsantrasyon, 298 K veya 25 °C ve 1 atmosfer basıncı) geçerli oldukları için kolayca kurulamaz. Önemli bilimsel ilgiye sahip birçok redoks reaksiyonu, standart olmayan durum koşulları altında, örneğin bir galvanik hücredeki farklı reaktan konsantrasyonları veya biyolojik membranlarda oluşan konsantrasyon gradyanları altında meydana gelir. Bu nedenle, bu tür sistemlerin potansiyellerini hesaplamak önemlidir.
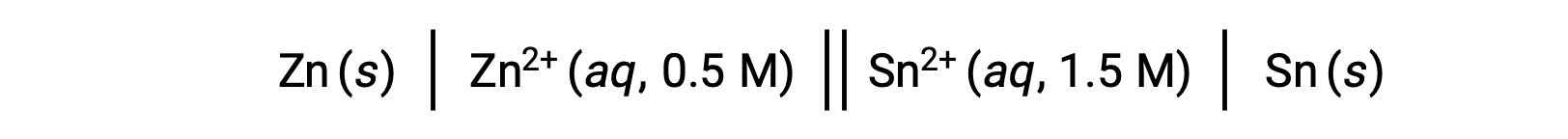
Reaksiyondaki çinko iyonlarının konsantrasyonu daha az olduğunda ve kalay iyonlarının konsantrasyonu standart koşullara kıyasla daha büyük olduğunda, redoks reaksiyonunun spontanlığı Le Chatelier prensibi kullanılarak niteliksel olarak tahmin edilebilir. Reaktan için daha yüksek ürün konsantrasyonu göz önüne alındığında, reaksiyon, ürünlerin üretimini destekleyen yönde ilerlemek için daha yüksek bir eğilime sahiptir. Bu, E°hücre hücre değerinden daha yüksek bir hücre potansiyeli değeri veya Ehücre neden olur.
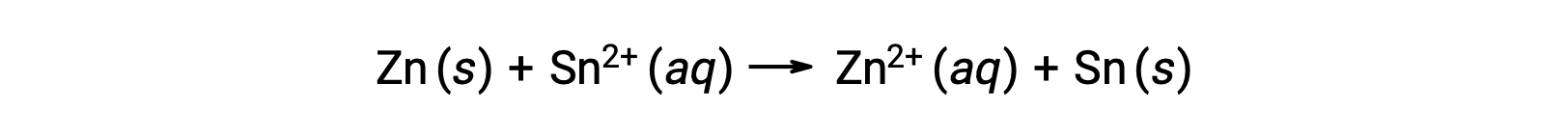
Bu reaksiyon ileri yönde ilerler, ancak bu hücre potansiyelinin nicel değeri kolayca belirlenemez.
Standart Olmayan Koşullarda Meydana Gelen Redoks Reaksiyonları için Nernst Denkleminin Türetilmesi
Ehücre veE°hücre değerleri arasındaki ilişki, standart ve standart olmayan koşullarda serbest enerji değişiklikleri arasında daha önce kurulan ilişkiden türetilebilir ve bu ilişki aşağıdaki gibi verilmiştir:
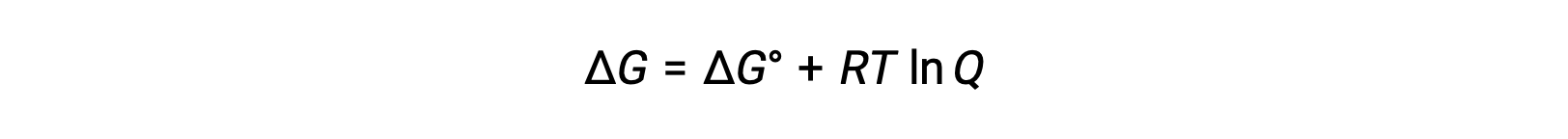
ΔG serbest enerjideki değişimdir, ΔG° serbest enerjideki standart değişimdir, R gaz sabitidir (değer = 8,314 J/mol∙K) ve Q, reaksiyon karışımlarının bileşimindeki farktan dolayı serbest enerjideki değişimi hesaba katan reaksiyon katsayısıdır. Reaktanların katı olması durumunda Q değeri atlanır.
Hücre potansiyeline serbest enerji değişikliğine ilişkin denklemin değiştirilmesi üzerine, Nernst denklemi olarak bilinen bir modifiye denklem elde edilir.
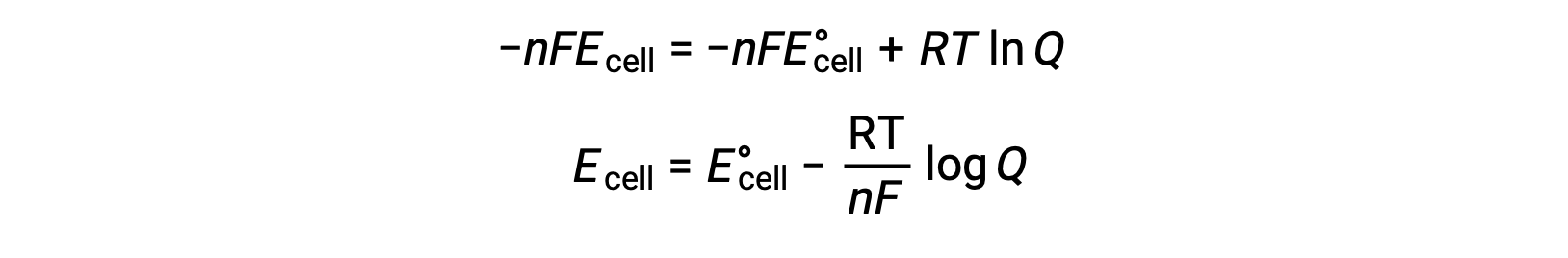
Nernst denklemi, standart durum değerinden bir redoks sisteminin (galvanik hücre gibi) potansiyelindeki değişimi açıklar. Redoks reaksiyonu sırasında aktarılan elektron sayısına, n, kelvin cinsinden ölçülen sıcaklığa T ve Q olarak verilen reaksiyon karışımı bileşimine bağlıdır.
Çoğu çalışma için Nernst denkleminin basitleştirilmiş bir formu, temel sabitlerin (R ve F) ve doğal logaritmadan taban-10 logaritmalarına dönüştürülen bir faktörün değerlerinin dahil edildiği formdur:
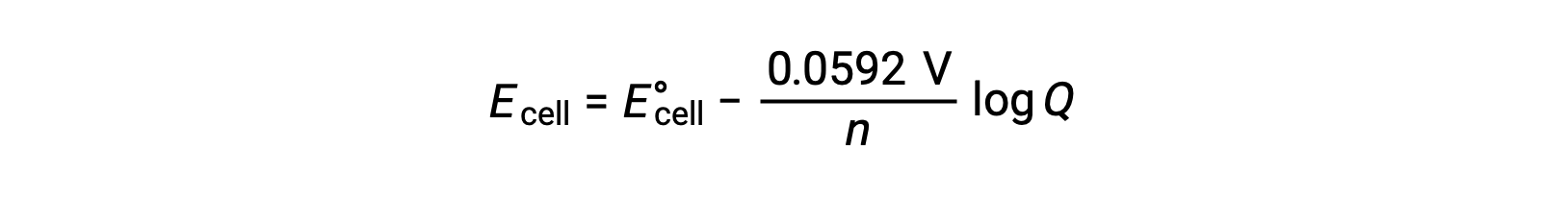
Standart durum koşulları altında, reaksiyon katsayısı Q değeri, logaritması sıfır olan birimdir. Bu, standart durum koşullarında reaktanların ve ürünlerin eşit konsantrasyonundan kaynaklanmaktadır. Burada, Ehücre E°hücre eşittir. Bir Q değerinden daha küçük bir değer, reaksiyon dengesini sağa kaydırarak ve böylece daha yüksek bir hücre potansiyeli değeri veren daha yüksek bir reaktif konsantrasyonunu gösterir. Birden büyük bir Q değeri, reaksiyonu sola yönlendiren daha yüksek bir ürün konsantrasyonunu ve daha düşük bir hücre potansiyeli değerini gösterir. Dengede, Q değeri K‘ye eşittir ve hücre potansiyeli sıfır olur, yani reaksiyon her iki yönde de ilerleme eğilimi göstermez. Bu, pillerin sürekli deşarjda neden “öldüğünü” açıklar: reaktan konsantrasyonundaki azalma reaksiyonu dengeye doğru yönlendirir ve hücre potansiyeli sürekli olarak sıfıra düşer.
Bu metin bu kaynaktan uyarlanmıştır: Openstax, Chemistry 2e, Section 17.4: Potential, Free Energy, and Equilibrium.
