18.6:
L'équation de Nernst
18.6:
L'équation de Nernst
Conditions de réaction non standard
L’interconnexion entre les potentiels de cellule standard et divers paramètres thermodynamiques tels que la variation d’énergie libre standard ΔG° et la constante d’équilibre K a été vue précédemment. Par exemple, une réaction redox impliquant des ions zinc(II) et étain(II) à une concentration de 1 M avec E°cellule = +0,291 V et ΔG° = −56,2 kJ est spontanée.
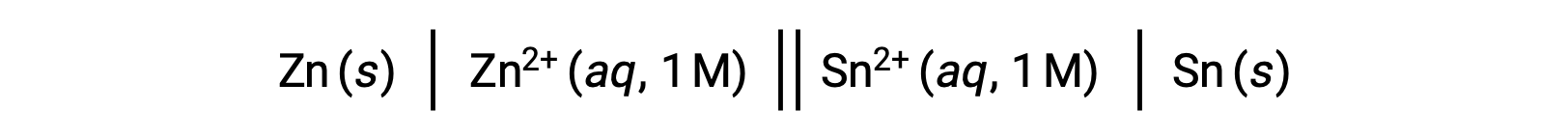
Toutefois, la décharge de cette cellule entraîne une modification de la concentration du réactif et une diminution constante du potentiel de cellule. Dans une telle condition, cependant, les relations entre le potentiel de cellule et les paramètres thermodynamiques ne peuvent pas être facilement établies car elles ne sont vraies que dans des conditions normalisées de concentration, de température et de pression (c.-à-d., une concentration de 1 M, 298 K ou 25 °C et une pression de 1 atmosphère). De nombreuses réactions redox d’intérêt scientifique significatif se produisent dans des conditions d’état non standard, comme par exemple les différentes concentrations de réactifs dans une cellule galvanique ou des gradients de concentration se produisant à travers les membranes biologiques. Par conséquent, il devient important de calculer les potentiels de tels systèmes.
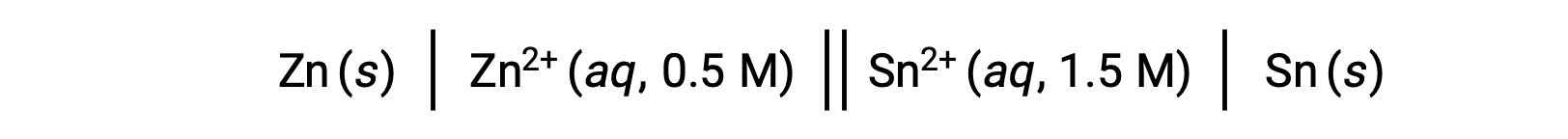
Lorsque la concentration en ions zinc dans la réaction est moindre et que la concentration des ions étain est supérieure aux conditions standard, la spontanéité de la réaction redox peut être prévue qualitativement en utilisant le principe de Le Chatelier. Étant donné la concentration plus élevée du produit par rapport au réactif, la réaction a plus tendance à se poursuivre dans le sens favorisant la génération des produits. Cela entraîne une valeur du potentiel de cellule, ou Ecellule, plus élevée que celle de E°cellule.
Cette réaction se poursuit dans le sens direct ; cependant, la valeur quantitative de ce potentiel de cellule ne peut pas être déterminée facilement.
Déduction de l’équation de Nernst pour les réactions redox se produisant dans des conditions non standard
La relation entre les valeurs de Ecellule et E°cellule peut être déduite à partir de la relation précédemment établie entre les variations d’énergie libre dans des conditions standard et non standard, qui est donnée comme suit :
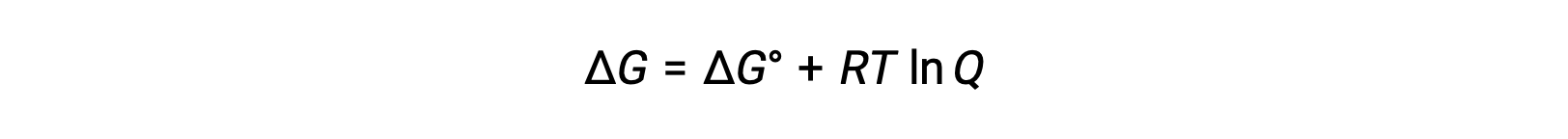
ΔG est la variation de l’énergie libre, ΔG° est la variation standard de l’énergie libre, R est la constante des gaz (valeur = 8,314 J/mol∙K) et Q est le quotient réactionnel, qui explique la variation de l’énergie libre due à la différence dans la composition des mélanges réactionnel. La valeur Q est omise si les réactifs sont solides.
Lors de la substitution de l’équation reliant la variation d’énergie libre au potentiel de cellule, on obtient une équation modifiée, appelée l’équation de Nernst.
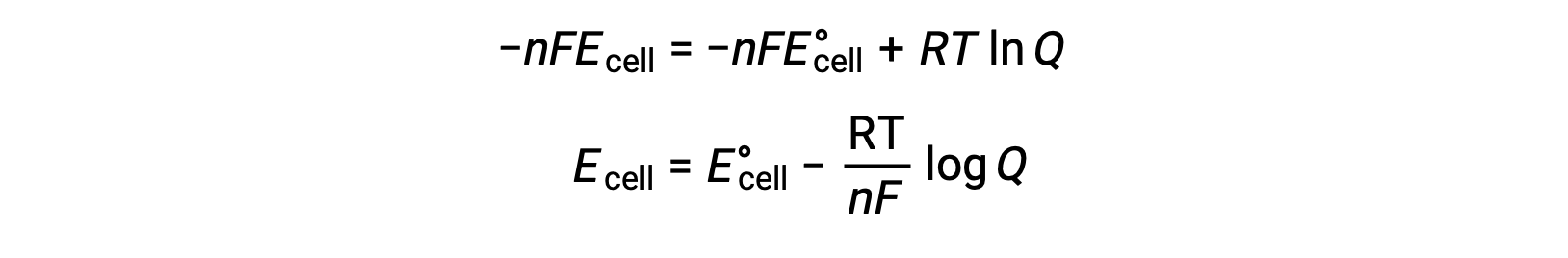
L’équation de Nernst décrit la variation du potentiel d’un système redox (comme une cellule galvanique) par rapport à sa valeur dans l’état standard. Elle dépend du nombre d’électrons transférés pendant la réaction redox, n, de la température mesurée en Kelvin, T, et de la composition du mélange réactionnel donnée par Q.
Une forme simplifiée de l’équation de Nernst pour la plupart des travaux est celle dans laquelle ont été inclues les valeurs des constantes fondamentales (R et F) et un facteur de conversion des logarithmes népériens en logarithmes de base-10 :
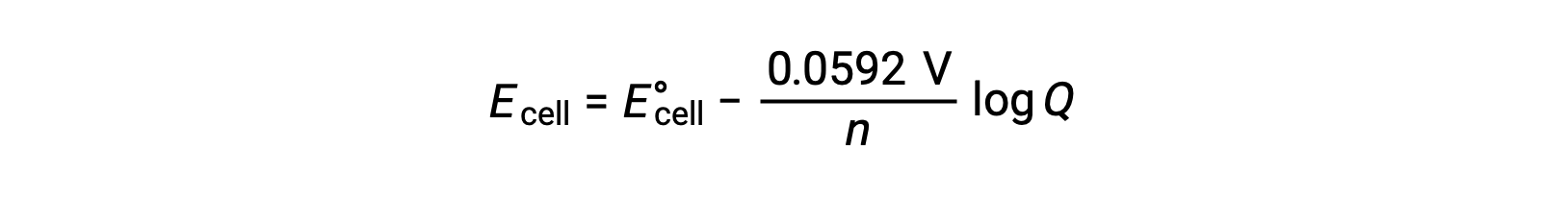
Dans des conditions d’état standard, la valeur du quotient réactionnel Q est d’une unité, dont le logarithme est zéro. Ceci est dû à la concentration égale de réactifs et de produits dans des conditions d’état standard. Ici, Ecellule est égal à E°cellule. Une valeur de Q inférieure à un indique une concentration plus élevée de réactifs, déplaçant l’équilibre de la réaction vers la droite et, par conséquent, une valeur plus élevée du potentiel de cellule est obtenue. Une valeur Q supérieure à un indique une concentration plus élevée du produit, entrainant la réaction vers la gauche et conduisant à une valeur plus basse du potentiel de cellule. À l’équilibre, la valeur de Q est égale à K et le potentiel de cellule devient nul, c’est-à-dire que la réaction ne montre aucune tendance à se poursuivre dans un sens ou dans l’autre. Ceci explique pourquoi les batteries “ sont à plat ” en cas de décharge continue : la diminution de la concentration en réactifs entraîne la réaction vers l’équilibre et son potentiel de cellule diminue progressivement jusqu’à zéro.
Ce texte est adapté deOpenstax, Chimie 2e, Section 17.4 : Potentiel, énergie libre et équilibre.
