18.6:
A Equação de Nernst
18.6:
A Equação de Nernst
Condições de Reação Não Padrão
A interconexão entre os potenciais celulares padrão e vários parâmetros termodinâmicos, como a alteração de energia livre padrão ΔG° e a constante de equilíbrio K, foi previamente explorada. Por exemplo, uma reação redox envolvendo iões de zinco(II) e estanho(II) a uma concentração de 1 M com Eºcell = +0,291 V e ΔG° = −56,2 kJ é espontânea.
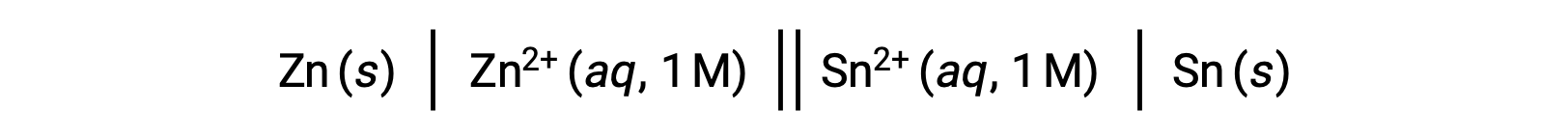
A descarga desta célula, no entanto, resulta em uma alteração da concentração de reagentes e em uma diminuição constante do potencial celular. No entanto, em tal condição, as relações entre o potencial celular e os parâmetros termodinâmicos não podem ser facilmente estabelecidas, uma vez que só se mantêm verdadeiras em condições padronizadas de concentração, temperatura, e pressão (ou seja, concentração de 1 M, 298 K ou 25 °C e pressão de 1 atmosfera). Muitas reações redox de interesse científico significativo ocorrem em condições de estado não padrão, por exemplo, diferentes concentrações de reganetes em uma célula galvânica ou gradientes de concentração que ocorrem nas membranas biológicas. Assim, torna-se importante calcular os potenciais de tais sistemas.
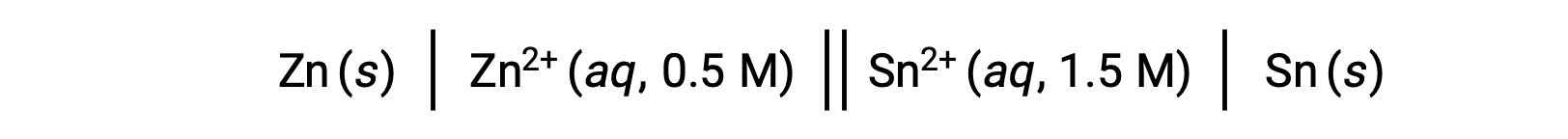
Quando a concentração de iões de zinco na reação é menor e a concentração de iões de estanho é maior em comparação com as condições normais, a espontaneidade da reação redox pode ser qualitativamente prevista utilizando o Princípio de Le Chatelier. Dada a maior concentração de produto para reagente, a reação tem uma maior tendência para avançar na direção que favorece a geração dos produtos. Isso resulta em um valor de potencial celular ou Ecell maior que o valor de E°cell.
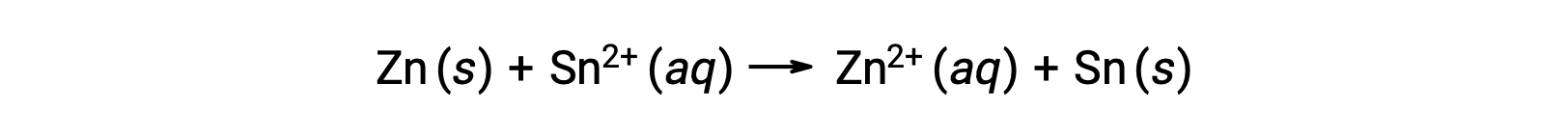
Esta reação prossegue na direção direta; no entanto, o valor quantitativo deste potencial celular não pode ser facilmente determinado.
Derivação da Equação de Nernst para Reações Redox que Ocorrem sob Condições Não Padrão
A relação entre os valores de Ecell e E°cell pode ser derivada da relação previamente estabelecida entre as alterações de energia livre em condições padrão e não padrão, que é dada da seguinte forma:
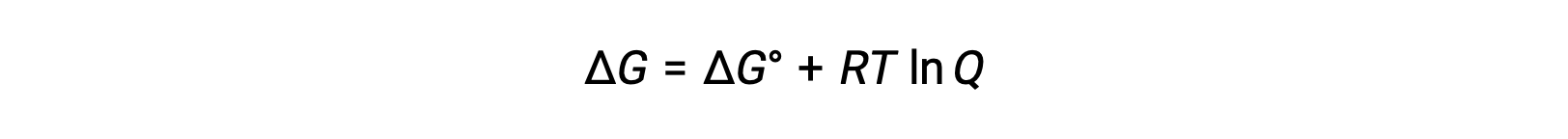
ΔG é a alteração na energia livre, ΔG° é a alteração na energia livre padrão, R é a constante de gás (valor = 8,314 J/mol∙K), e Q é o quociente de reação, que tem em conta a alteração na energia livre devido à diferença na composição das misturas da reação. O valor Q é omitido se os reagentes forem sólidos.
Em substituição da equação relativa à alteração de energia livre para potencial celular, obtém-se uma equação modificada, conhecida como equação de Nernst.
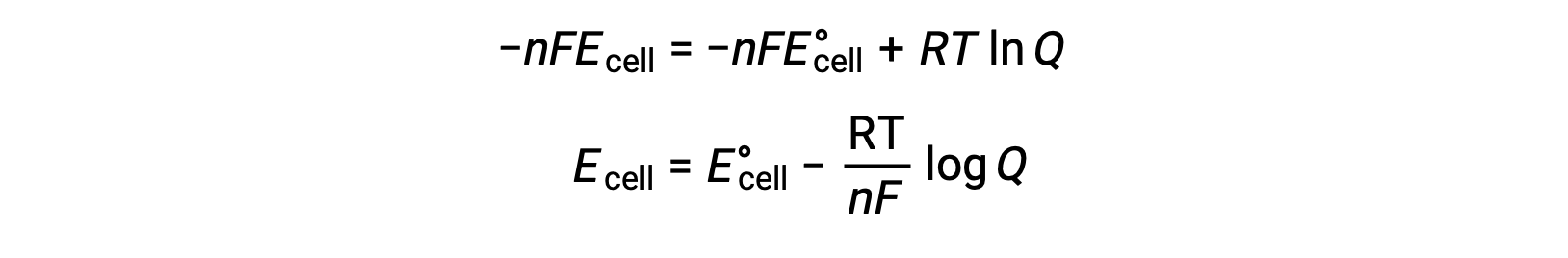
A equação de Nernst descreve a variação no potencial de um sistema redox (como uma célula galvânica) a partir do seu valor de estado padrão. Ela depende do número de eletrões transferidos durante a reação redox, n, da temperatura medida em kelvin, T, e da composição da mistura de reação fornecida como Q.
Uma forma simplificada da equação de Nernst para a maioria dos trabalhos é aquela em que foram incluídos valores para as constantes fundamentais (R e F) e um factor de conversão de log natural para logaritmos de base 10:
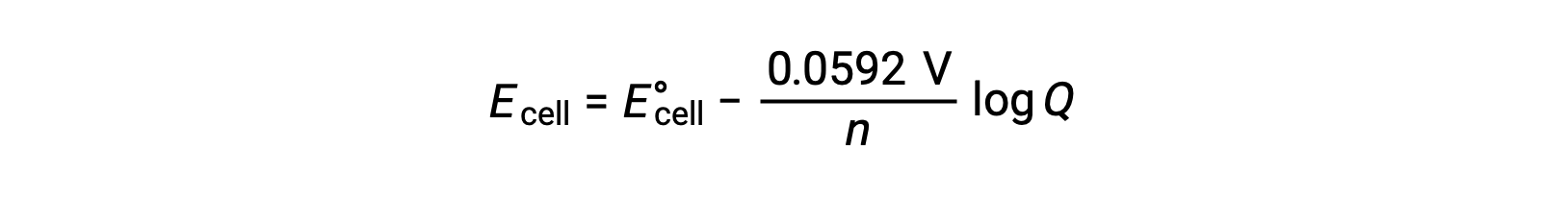
Em condições de estado padrão, o valor do quociente de reação Q é unidade, cujo logaritmo é zero. Isto deve-se à concentração igual de reagentes e produtos em condições de estado padrão. Aqui, Ecell é igual a E°cell. Um valor Q inferior a um indica uma concentração mais elevada de reagentes, deslocando o equilíbrio da reação para a direita e, assim, produzindo um valor mais elevado de potencial celular. Um valor Q superior a um indica uma concentração superior do produto, conduzindo a reação para a esquerda, e um valor inferior do potencial celular. Em equilíbrio, o valor Q é igual a K, e o potencial celular torna-se zero, ou seja, a reação não mostra tendência para prosseguir em qualquer direcção. Isto explica porque as baterias “morrem” após descarga contínua: a diminuição da concentração de reagente conduz a reação para o equilíbrio e o potencial celular diminui de forma constante para zero.
Este texto é adaptado de Openstax, Chemistry 2e, Section 17.4: Potential, Free Energy, and Equilibrium.
