Summary
여기서는 세포 사멸 유도 후 접종된 잎을 지속적으로 이미징하여 프로그래밍된 세포 사멸 개시 속도를 연구하기 위한 프로토콜을 제시합니다.
Abstract
과민반응(HR) 부여 저항은 N 저항 유전자에 의해 결정될 수 있는 효과적인 방어 반응입니다. HR은 접종된 잎에 세포 사멸 구역이 형성되는 것으로 나타납니다. 여기에서, 디지털 현미경을 이용하여 세포 사멸 개시와 세포 사멸 출현 사이의 시간 동안 접종된 잎을 이미징하여 세포 사멸 개시 속도를 연구하기 위한 프로토콜이 제시된다. 디지털 현미경은 원하는 간격으로 연속 이미징 프로세스를 가능하게 하여 기존 방법의 몇 시간과 달리 세포 사멸 개시 속도를 최대 몇 분 만에 정확하게 측정할 수 있습니다. 디지털 현미경을 사용한 이미징은 빛과 무관하므로 식물의 생체 리듬을 방해하지 않고 낮과 밤에 사용할 수 있습니다. 프로그램된 세포 사멸 발달을 초래하는 다른 병리체계는 약간의 수정을 가진 이 프로토콜을 사용하여 공부할 수 있었습니다. 전반적으로, 이 프로토콜은 세포 사멸 개시율의 간단하고 정확하며 저렴한 식별을 가능하게 합니다.
Introduction
감자는 세계에서 가장 널리 재배되는 식량 작물 중 하나이며 쌀, 밀, 옥수수에 이어 4위를 차지합니다. 그러나 감자 생산은 현재 가장 중요한 바이러스 병원체로 간주되는 감자 바이러스 Y(PVY)에 의해 심각한 영향을 받을 수 있습니다 1,2. 감자 식물 cv. Rywal, PVY의 여러 균주(PVY 균주 N-Wilga 포함)는 감염 부위에 대한 병원체의 제한이 접종된 잎에 괴사성 병변으로 나타나는 과민반응(HR) 부여 내성을 유발합니다3. 이 병리계에서 HR은 온도에 의존하는 Ny-1 저항성 유전자에 의해 매개되는데, 이는 낮은 온도에서 자란 식물이 괴사성 병변을 효율적으로 발달시키는 반면, 고온(28°C)에서 체질적으로 자란 식물에서는 병변 형성 부족과 전신 바이러스 확산으로 저항성 포기가 입증된다 3,4. 식물이 더 낮은 온도(22°C)로 옮겨지면 세포 사멸이 시작되며, 이는 세포 사멸 시작과 세포 사멸 외관 사이의 시간에 접종된 잎을 이미징하여 세포 사멸 개시 속도를 추적하기 위해 이용될 수 있습니다.
이 프로토콜은 디지털 현미경을 사용하여 세포 사멸 개시율을 결정하는 간단한 방법을 보여줍니다. 식물을 28°C에서 22°C로 옮긴 후 접종된 잎을 이미징함으로써 디지털 현미경을 통해 원하는 간격으로 잎을 연속적으로 관찰할 수 있습니다. 다른 방법(예: 공초점 현미경 또는 육안으로 병변 형성 관찰)의 사용과 달리, 이를 통해 병변 형성의 정확한 시간을 결정할 수 있으므로 앞서 언급한 방법 5,6의 시간과 달리 세포 사멸 개시율을 최대 분까지 정확하게 측정할 수 있습니다. 디지털 현미경 사용은 빛과 무관하므로 낮과 밤에 사용할 수 있습니다. 이 프로토콜은 또한 세포 사멸 개시에 관련된 성분을 식별하거나 사용된 식물이 형질전환되고 관심 성분의 변경된 수준을 갖는 경우 세포 사멸 개시 속도에 대한 다른 성분의 효과를 결정하는 데 사용할 수 있습니다.
Protocol
참고: 섹션 1과 2는 Lukan et al.7이 설명한 방법을 기반으로 식물 재료 준비를 위한 수정된 프로토콜을 설명합니다. 특히, 통제된 환경 조건 및 접종 준비에 대한 일부 수정이 이루어졌습니다.
1. 감자 재배
- 건강한 감자 이력서를 재배하십시오. 줄기 마디 조직 배양에 있는 Rywal 식물8.
- 6-8주 후, 멸균 핀셋과 메스 나이프를 사용하여 멸균 조건에서 멸균 종이에 감자 식물의 마디가 포함된 1cm 길이의 외피 10개를 자릅니다.
- Murashige 및 Skoog(MS30) 배지(그림 1A)가 있는 플라스틱 상자에 옮기고 통제된 환경 조건(상대 습도 55% ± 5%)에서 250μE 또는 μmol/m2/s 방사선 및 16시간 광주기로 밝은 곳에서 22°C, 어두운 곳에서 19°C에서 재배합니다.
- 미세 번식 후 2 주 후에 토양으로 옮깁니다.
- 화분(r = 10cm)에 흙을 채웁니다. 손가락을 사용하여 화분 중앙의 흙에 3-4cm 깊이의 구멍을 만들고 구멍을 채우고 흡수될 때까지 기다립니다.
- 화분당 한 그루의 식물을 구멍에 넣고 잎은 표면 위에 남겨 둡니다. 뿌리를 흙으로 부드럽게 덮습니다(그림 1B).
알림: 일부 식물은 뿌리가 발달하지 않을 수 있습니다. 이러한 식물을 분석에서 제외합니다.
- 통제된 환경 조건(밝은 곳에서 22°C, 어두운 곳에서 19°C, 상대 습도 55% ± 5%, 방사선 250μmol/m2/s 및 16시간 광주기)의 성장 챔버에서 식물을 성장실의 토양에서 키웁니다.
- 3-4주가 지나면 식물이 준비됩니다. 이 식물을 사용하여 접종하십시오.
참고: 식물은 눈에 보이는 전단지가 있는 완전히 발달된 잎이 최소 3-4개 있어야 합니다(그림 1C). 눈에 띄는 증상(노란색 또는 갈색 잎)이 없이 건강해 보여야 하며, 이는 PVY로 인한 병변으로 오인될 수 있습니다. 비교 가능한 결과를 얻기 위해, 식물은 모든 실험에서 동시에 (예를 들어, 오전 9시에) 접종되어야 하며, 이는 식물 면역 반응 및 병변 형성에 대한 일주기 리듬의 가능한 영향을 피하기 위한 것이다 9,10,11.
2. 접종 준비 및 감자 접종
- PVY 균주 N-Wilga(PVYN-Wi, 등록 번호. EF558545) 아래와 같이 접종한다.
알림: 둘 이상의 디지털 현미경을 사용할 수 있는 경우 더 많은 식물을 병렬로 접종할 수 있습니다. 식물은 접종 전에 적어도 3개의 완전히 발달된 잎이 있어야 합니다(그림 1C). PVYN-Wi 는 감자 cv. Pentland에서 곱해지고 유지됩니다.- 접종을 위해 나트륨 디에틸디티오카르바메이트(DIECA)가 보충된 인산염 완충액을 준비합니다: 0.2M NaH2PO4 1.3mL, 0.2M Na2HPO4 8.7mL 및 DIECA 0.225g을 혼합합니다. ddH20을 사용하여 부피를 100mL로 구성합니다. 7.6M NaOH 또는 1M HCl 용액을 추가하여 pH를 1로 조정합니다.
- 6-8주 된 PVYN-Wi 감염된 감자 cv를 수확합니다. 필터 그물 (6 개 식물 당 0.5g)을 사용하여 추출 백에 조직 배양 된 Pentland 식물을 넣고 DIECA (식물 재료의 4 배 질량, 질량 : 부피 비율)로 보충 된 인산염 완충액을 첨가합니다. 균질한 용액을 얻기 위해 1-2분 동안 손 균질기를 사용하십시오.
- 3-4 주 된 감자 식물 (1.6 단계)의 처음 3 개의 완전히 발달 된 잎에 카보런덤 가루를 가볍게 뿌립니다.
알림: 카보런덤 분말의 양을 조절하십시오. 너무 많으면 손상이 발생할 수 있고 너무 적으면 감염이 비효율적일 수 있습니다. 최적으로는 0.1mg/cm의 카보런덤 분말이 사용되며, 이는 평균 크기(약15cm2)의 잎당 약 1.5mg의 분말입니다. - 접종물(잎당 ~100μL)로 잎을 부드럽게 문지릅니다. 10분 후 수돗물로 잎을 깨끗이 씻습니다.
- 잎이 다치지 않도록 주의하십시오. 배양 시간을 초과하지 마십시오. 잎 크기에 따라 접종량을 조절한다 - 6.5 μL/cm, 평균 크기(약 15cm2)의 잎 당 약 100 μL이다.
- 식물을 성장 챔버로 옮기고 통제된 환경 조건(상대 습도 55% ± 5%, 250μmol/m2/s 방사선 및 16시간 광주기)에서 3일 동안 통제된 환경 조건(밝은 곳에서 28°C, 어두운 곳에서 28°C)에서 자랍니다.
3. 식물 준비 및 병변 발달 기록을 위한 디지털 현미경 사용
- 접종 3일 후, 28°C로 유지된 생장실로부터 22°C의 생장실로 접종 단계 1.5에 기술된 바와 같은 다른 조건으로 접종된 식물을 이송한다.
- 관찰할 식물을 선택합니다. 테이프를 사용하여 두 번째 접종된 잎을 고정합니다(그림 1D). 이미징을 시작하기 전에 원하는 리프가 완전히 고정되었는지 확인합니다(그림 1D).
- 랩톱 컴퓨터에 이미지 캡처용 소프트웨어 응용 프로그램을 설치합니다. 디지털 현미경을 컴퓨터에 연결합니다. 소프트웨어를 엽니다.
알림: 식물, 디지털 현미경 및 노트북이 컴퓨터를 연결할 소켓 근처의 선반에 있는지 확인하십시오. 모니터링할 잎의 선택에 대한 결정은 연구된 생물학적 질문, 예를 들어 제한된 프로그램된 세포 사멸의 형성으로 이어지는 과정의 유형에 따라 달라질 수 있습니다. - 고정된 잎 위의 현미경을 조정합니다. 디지털 현미경의 다이얼을 사용하여 초점을 맞춥니다( 그림 1E 참조).
- 병변의 형성을 포착할 가능성을 높이기 위해 시야가 가능한 한 넓어야 하지만 병변의 모양을 발견할 수 있을 만큼 충분히 확대되어야 합니다(일반적으로 25배 배율 사용).
- 카메라 설정을 지정합니다. 이미지의 오른쪽 상단 모서리에 있는 설정 버튼(그림 2A, 원 1부)을 클릭하고 밝기(60-70), 대비(10-15), 색조(0), 화이트 밸런스, 채도(45-50), 선명도(0), 감마(5)와 같은 카메라 설정을 조정합니다(그림 2B). 이 연구에서 사용된 설정은 밝기(64), 대비(14), 색조(0), 채도(47), 선명도(0), 감마(5)입니다.
알림: 최상의 이미지 품질을 보장하려면 카메라 설정을 외부 조명으로 조정해야 합니다. 설정은 성장실에서 사용자의 조건에 따라 조정할 수 있습니다. - 이미지 캡처 아이콘을 클릭하여 이미지 캡처 설정을 지정합니다(그림 2C, 원 2부). Time-Lapsed Video 버튼을 클릭하고 15시간 동안 24분마다 Image Capture(이미지 캡처 )를 설정합니다(그림 2C).
참고: 촬영된 이미지와 이미징 지속 시간 사이의 간격은 완전히 유연하며 실험의 필요에 따라 조정할 수 있습니다. 이미지 캡처 사이에 LED 표시등이 꺼집니다. LED 조명은 이미지 캡처 중에 자동으로 켜집니다. - START 버튼을 클릭하여 이미지 캡처를 시작합니다(그림 2C).
참고: 28°C에서 22°C로 옮긴 후 식물은 24시간 이내에 병변이 발생하기 시작해야 합니다. 그렇지 않다면 접종이 효과적이지 않다는 신호일 수 있습니다. 카보런덤 분말의 양을 조절하고, 잎에 접종한 배양 시간이 정확한지 확인하고, qPCR로 접종물의 바이러스 풍부도를 측정합니다. - 이미지를 저장하려면 모든 이미지를 선택하고 저장 아이콘을 클릭합니다(그림 2B, 원 3부). 내보내기 옵션을 설정합니다. DPI를 최대값(300)으로 설정합니다(그림 2D). 저장 후 프로그램의 모든 사진을 삭제하십시오.
- 이미지 분석의 경우 이미지 보기/편집을 위한 모든 프로그램으로 충분합니다. 이미지 편집을 위한 무료 소프트웨어인 ImageJ의 사용법은 아래에 설명되어 있습니다.
- 단일 시야에서 이미지의 시간 시퀀스를 가져옵니다(왼쪽 상단 모서리에서 File(파일)을 클릭하고 Import(가져오기)를 선택한 다음 Image Sequence(이미지 시퀀스)를 선택합니다). 저장된 사진 디렉토리의 경로를 붙여넣고 OK 버튼을 눌러 변환을 시작합니다.
- 변환 후 소프트웨어는 최종 비디오를 보여주는 내부 비디오 플레이어를 자동으로 엽니다. 파일 > 다른 이름으로 저장 옵션을 클릭하고 AVI 형식을 선택하여 비디오 파일을 내보냅니다. 작은 창이 열립니다. 프레임 속도를 0.3fps로 설정하고 확인을 눌러 비디오를 AVI 비디오 파일로 저장합니다.
참고: 병변 발생 시간은 모든 이미지를 수동으로 확인하고 병변이 나타나는 이미지를 찾아 결정할 수도 있습니다.
Representative Results
이 연구는 감자 cv의 병변 발생을 통한 세포 사멸 개시를 연구하기 위한 단계별 프로토콜을 보여줍니다. 디지털 현미경을 사용하는 Rywal. 이를 통해 프로그래밍된 세포 사멸 시작의 정확한 시간을 결정할 수 있습니다.
뿌리가 발달한 식물은 감자 cv 후 2주 후에 토양에 넣었습니다. Rywal 미세전파(그림 1A,B). 기술된 조건 하에서 3-4주간의 성장 후, 적어도 3-4개의 완전히 발달된 잎을 가진 식물은 절제의 징후 없이 건강해 보이는 눈에 띄는 잎사귀를 추가 분석을 위해 사용하였다(그림 1C). 이 프로토콜에 설명된 대로 디지털 현미경을 사용하여 접종한 잎의 동일한 영역을 15분 간격으로 관찰하고 병변 발생 및 확장을 적시에 측정했습니다(그림 3). 병변은 15시간 30분에 발생했습니다(그림 3).

그림 1: 디지털 현미경을 사용한 분석을 위한 식물 준비 . (A) MS 30 배지와 감자 cv가 들어 있는 플라스틱 상자. 노드를 포함하는 Rywal 식물 explants. (B) 감자 이력서. 토양에 Rywal 식물 (미세 증식 후 2 주). (C) 감자 이력서. Rywal 식물, 접종 준비 (토양에 넣은 후 4 주), 적어도 3 개의 완전히 발달 된 잎이 있습니다. (D) 감자 cv의 두 번째 접종 잎(화살표). Rywal 공장은 테이프로 배치하고 고정(화살표)합니다. (E) 초점에 사용되는 다이얼을 가리키는 화살표가 있는 디지털 현미경 아래에 위치한 식물. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 병변 발생을 기록하기 위한 디지털 소프트웨어 설정. (A) 소프트웨어 인터페이스 - 빨간색 원으로 표시된 버튼은 (1) 카메라 설정, (2) 이미지 캡처 설정 및 (3) 이미지 저장 버튼에 대한 옵션입니다. (B) 패널 A에서 (1)을 클릭하면 열리는 카메라 설정 창. 밝기, 대비, 채도, 선명도 및 감마를 적절하게 조정해야 합니다. (C) 패널 A에 표시된 (2)를 클릭하면 열리는 이미지 캡처 설정이 있는 창. (D) 패널 A에 표시된 (3)을 클릭하면 열리는 이미지 저장 설정이 있는 창. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: 디지털 현미경으로 관찰한 접종된 잎의 병변 형성. 디지털 현미경으로 5분 간격으로 촬영한 23.6배 배율로 PVY를 접종한 감자 잎의 중앙 부분 이미지. 접종한 식물을 28°C에서 3일간 두고, 3일째는 7:00부터 22°C에서 디지털 현미경으로 관찰을 개시했다. (A) 21:02에는 병변이 아직 보이지 않고, (B) 90분 후인 22:32에는 병변이 보입니다. (C) 병변 확장은 다음날 아침 01:02 및 (D) 07:32에 관찰되었다. 실험을 두 번 반복하였고, 병변은 각각 세포 사멸 개시 후 8시간 15분 및 12시간 후에 발생하였다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Discussion
시연된 프로토콜을 통해 사용자는 디지털 현미경을 사용하여 세포 사멸 시작과 세포 사멸 외관 사이의 시간 동안 접종된 잎을 지속적으로 이미징하여 세포 사멸 개시율을 정확하게 결정할 수 있습니다. 병변 및 식물 질병 발생을 모니터링하는 방법에는 여러 가지가 있지만(12,13,14,15), 이 프로토콜은 측정 사이에 빛이 꺼지기 때문에 식물의 일주기 리듬을 방해하지 않고 빛과 무관한 측정의 이점을 제공합니다.
접종 후 식물은 28°C에서 3일 동안 자라야 합니다. 과민반응을 유발하는 Ny-1 저항성 유전자는 온도에 따라 달라지며, 고온에서 자란 식물에서는 저항성 결핍을 유발하여 병변 형성 부족과 전신 바이러스 확산으로 나타난다3. 식물을 22°C로 옮긴 후 세포 사멸이 시작되므로 정확한 결과를 얻으려면 이 이동 후 가능한 한 빨리 디지털 현미경으로 관찰을 시작해야 합니다. 이미징을 위한 식물 준비의 또 다른 중요한 단계는 잎을 고정하는 것인데(그림 1D), 이미징 중에 식물이 계속 자라 관찰된 잎이 초점에서 벗어나거나 이러한 설정이 원하는 결과를 얻지 못할 수 있기 때문입니다.
설명된 프로토콜이 세포 사멸 개시에 관여하는 것으로 가정되는, 관심의 변경된 성분을 갖는 형질전환 식물에 사용되는 경우, 프로토콜은 사용자가 연구된 성분의 감소된 수준이 세포 사멸 개시 속도에 영향을 미치는지 여부를 결정할 수 있게 한다. 이를 통해 세포 사멸 개시에 관여하는 구성 요소는 이 프로토콜을 사용하여 프로그래밍된 세포 사멸이 발생하는 병리계에서 확인할 수 있습니다. 이러한 성분을 식별하기 위한 다른 방법은, 예를 들어, RNA-seq 또는 다양한 형태의 현미경과 같은 전사체 분석이며, 이는 비용과 시간이 많이 소요될 수 있다16. 이 프로토콜에 기술된 방법은 형질전환 식물과 대조군 식물 사이의 세포 사멸 개시율의 차이를 관찰함으로써 세포 사멸 개시에 관여하는 성분의 쉽고 저렴한 식별을 가능하게 한다. 최적으로, 이러한 설정에서는 형질전환 식물이 동일한 실험 내에서 대조 식물과 병렬로 분석되어야 하기 때문에 두 대의 디지털 카메라를 사용해야 합니다.
이 프로토콜에서는 PVY 균주 N-Wilga가 사용되었습니다. 그러나 이 바이러스의 다른 변종, 예를 들어 GFP 표지 PVY(PVY-N605(123)-GFP)7도 사용할 수 있습니다. 더욱이, 프로그램된 세포 사멸 발달을 초래하는 다른 병리계는 약간의 수정과 함께 이 프로토콜을 사용하여 연구될 수 있습니다.
Disclosures
저자는 이해 상충이 없음을 선언합니다.
Acknowledgments
기술 지원을 제공해 주신 Barbara Jaklič에게 감사드립니다. 이 연구는 슬로베니아 연구 혁신 기관(연구 핵심 자금 지원 번호 P4-0165 및 프로젝트 Z4-3217: 바이러스에 대한 감자 내성의 산화 환원 관련 신호 상호 연결성 해독)의 재정 지원을 받았습니다.
Materials
| Name | Company | Catalog Number | Comments |
| Alcohol burner | Mikro+Polo | SH-234002455 | For tweezers and scalpel sterilization |
| Autoclave A-21 CAV | Kambi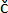 |
N/A | |
| Bacto Agar | Becton, Dickinson and Company | 214010 | |
| Carborundum powder | VWR Chemicals | 22505297 | |
| DinoCapture 2.0 | Dino-Lite | Version 2.0 | software for digital microscope |
| Dino-Lite Edge AM7915MZTL digital microscope | AnMo Electronics Corporation | AM7915MZTL | |
| Ethanol, 70% | Stella Tech | P94000 | For tweezers and scalpel sterilization |
| Extraction bags | Bioreba | 420100 | |
| Growth chamber FS-WI | Photon Systems Insturments | N/A | |
| Hand homogenizer | Bioreba | 400010 | |
| Hawita Special Substrate | HAWITA Gruppe | 2000000071701 | Ready to use substrate, made using peat (H4-H6 and H6-H8) |
| Hydrochloric acid (HCl) | Merck | 109057 | |
| Label tape | Sigma | L8144-5EA | |
| Laptop computer with installed DinoCapture 2.0 | HP | Z2V77EA#BED | Computer needs to be transferable as experiment takes part in a growth chamber |
| Murashige and Skoog medium | Duchefa Biochemie | M02220100 | |
| Na2HPO4 | Emsure | 1065860500 | |
| NaH2PO4 | Emsure | 1064700250 | |
| Pasteur pipette 0.5 mL | Brand | 21500209 | |
| pH-meter | Mettler Toledo | ML1601 | |
| Plastic boxes | Cvetlice Dornig | VCG10.5 | Radius = 10.5 cm |
| Plastic pots | Lab Associates | DIS40003 | Radius = 11.5 cm (top), Radius = 9.8 cm (bottom) |
| Saccharose | Kemika d.d. | 1800408 | |
| Sodium Diethyldithiocarbamate (DIECA) | Sigma-Aldeich | 228680 | Sodium diethyldithiocarbamate trihydrate, ACS reagent |
| Sodium hydroxide (NaOH) | Merck | 106462 | |
| Sterile surgical blades | Braun | 4511733633 | |
| Tweezers | Braun | BD033R |
References
- Karasev, A. V., Gray, S. M. Continuous and emerging challenges of potato virus y in potato. Annual Review of Phytopathology. 51, 571-586 (2013).
- Quenouille, J., Vassilakos, N., Moury, B. Potato virus Y: A major crop pathogen that has provided major insights into the evolution of viral pathogenicity. Molecular Plant Pathology. 14 (5), 439-452 (2013).
- Szajko, K., et al. The novel gene Ny-1 on potato chromosome IX confers hypersensitive resistance to Potato virus Y and is an alternative to Ry genes in potato breeding for PVY resistance. Theoretical and Applied Genetics. 116 (2), 297-303 (2008).
- Szajko, K., Strzelczyk-Żyta, D., Marczewski, W. Ny-1 and Ny-2 genes conferring hypersensitive response to potato virus Y (PVY) in cultivated potatoes: Mapping and marker-assisted selection validation for PVY resistance in potato breeding. Molecular Breeding. 34 (1), 267-271 (2014).
- Lukan, T., et al. Cell death is not sufficient for the restriction of potato virus Y spread in hypersensitive response-conferred resistance in potato. Frontiers in Plant Science. 9, 168 (2018).
- Baebler, Š, et al. Salicylic acid is an indispensable component of the Ny-1 resistance-gene-mediated response against Potato virus y infection in potato. Journal of Experimental Botany. 65 (4), 1095-1109 (2014).
- Lukan, T., Coll, A., Baebler, Š, Gruden, K. Analysis of virus spread around the cell death zone at spatiotemporal resolution using confocal microscopy. Methods in Molecular Biology. 2447, 261-270 (2022).
- Vinterhalter, D., Dragiüeviü, I., Vinterhalter, B. Potato in vitro culture techniques and biotechnology. Fruit, Vegetable and Cereal Science and Biotechnology. 2, Special Issue 16-45 (2008).
- Wang, W., et al. Timing of plant immune responses by a central circadian regulator). Nature. 470, 110-115 (2011).
- Roden, L. C., Ingle, R. A. Lights, rhythms, infection: The role of light and the circadian clock in determining the outcome of plant-pathogen interactions. Plant Cell. 21 (9), 2546-2552 (2009).
- Srivastava, D., et al. Role of circadian rhythm in plant system: An update from development to stress response. Environmental and Experimental Botany. 162, 256-271 (2019).
- Mulaosmanovic, E., et al. High-throughput method for detection and quantification of lesions on leaf scale based on trypan blue staining and digital image analysis. Plant Methods. 16, 62 (2020).
- Martinelli, F., et al. Advanced methods of plant disease detection. A review. Agronomy for Sustainable Development. 35, 1-25 (2015).
- Ali, M., Bachik, N., Muhadi, N. A., Tuan Yusof, T. N., Gomes, C. Non-destructive techniques of detecting plant diseases: A review. Physiological and Molecular Plant Pathology. 108, 101426 (2019).
- Sankaran, S., Mishra, A., Ehsani, R., Davis, C. A review of advanced techniques for detecting plant diseases. Computers and Electronics in Agriculture. 72 (1), 1-13 (2010).
- Rowarth, N. M., et al. RNA-Seq analysis reveals potential regulators of programmed cell death and leaf remodelling in lace plant (Aponogeton madagascariensis). BMC Plant Biology. 21 (1), 375 (2021).



