Summary
Här presenterar vi ett protokoll för att studera graden av programmerad celldödsinitiering genom att kontinuerligt avbilda inokulerade blad efter celldödsinduktion.
Abstract
Hypersensitivt svar (HR)-konfedererat motstånd är ett effektivt försvarssvar som kan bestämmas av N-resistensgenerna . HR manifesteras som bildandet av celldödszoner på inokulerade blad. Här presenteras ett protokoll för att studera graden av celldödsinitiering genom att avbilda inokulerade blad under tiden mellan celldödsinitieringen och celldödens uppkomst med hjälp av ett digitalt mikroskop. Det digitala mikroskopet möjliggör en kontinuerlig avbildningsprocess i önskade intervall, vilket möjliggör en exakt bestämning av celldödens initieringshastighet upp till minuter exakt, i motsats till timmar i traditionella metoder. Avbildning med det digitala mikroskopet är också oberoende av ljus och kan därför användas dag och natt utan att störa växtens dygnsrytm. Olika patosystem som resulterar i programmerad celldödsutveckling kan studeras med hjälp av detta protokoll med mindre modifieringar. Sammantaget möjliggör protokollet således enkel, exakt och billig identifiering av initieringshastigheten för celldöd.
Introduction
Potatis är en av världens mest odlade livsmedelsgrödor, på fjärde plats efter ris, vete och majs. Potatisproduktionen kan dock påverkas kraftigt av potatisvirus Y (PVY), som för närvarande anses vara den viktigaste viruspatogenen 1,2. I potatisplantor cv. Rywal, flera stammar av PVY (inklusive PVY-stammen N-Wilga) utlöser resistens som orsakas av hypersensitivt svar (HR), där patogenens begränsning till infektionsstället manifesterar sig som nekrotiska lesioner på inokulerade blad3. I detta patosystem medieras HR av Ny-1-resistensgenen, som är temperaturberoende, eftersom växter som odlas vid lägre temperaturer effektivt utvecklar nekrotiska lesioner, medan i växter som odlas konstitutivt vid förhöjd (28 °C) temperatur, visar sig resistensabort som avsaknad av lesionsbildning och systemisk virusspridning 3,4. När plantorna överförs till en lägre temperatur (22 °C) initieras celldöd, vilket kan utnyttjas för att följa graden av celldödsinitiering genom att avbilda inokulerade blad under tiden mellan celldödsinitieringen och celldödens framträdande.
Detta protokoll demonstrerar en enkel metod för bestämning av initieringshastigheten för celldöd med hjälp av ett digitalt mikroskop. Genom att avbilda de inokulerade bladen efter att ha flyttat växten från 28 °C till 22 °C möjliggör ett digitalt mikroskop kontinuerlig observation av bladet i önskade intervall. Till skillnad från användningen av andra metoder (till exempel konfokalmikroskopi eller observation av lesionsbildning med blotta ögat) möjliggör detta bestämning av den exakta tidpunkten för lesionsbildning och därmed initieringshastigheten för celldöd upp till minuter exakt, i motsats till timmar i tidigare nämnda metoder 5,6. Användningen av digitala mikroskop är också oberoende av ljus och kan därför användas dag och natt. Detta protokoll kan också användas för att identifiera komponenter som är involverade i initiering av celldöd eller för att bestämma effekterna av olika komponenter på initieringshastigheten för celldöd om använda växter är transgena och har förändrade nivåer av komponenter av intresse.
Protocol
OBS: Avsnitt 1 och 2 beskriver ett modifierat protokoll för beredning av växtmaterial baserat på de metoder som beskrivs av Lukan et al.7. Specifikt gjordes vissa modifieringar av kontrollerade miljöförhållanden och inokulatberedning.
1. Odling av potatisplantor
- Odla frisk potatis cv. Rywal-växter i stamnodvävnadskultur8.
- Efter 6-8 veckor, skär tio 1 cm långa explantor som innehåller noder från potatisplantor på sterilt papper under sterila förhållanden med steril pincett och en skalpellkniv.
- Överför dem till plastlådor med Murashige och Skoog (MS30) medium (Figur 1A) och odla dem under kontrollerade miljöförhållanden (22 °C i ljus och 19 °C i mörker med 250 μE eller μmol/m2/s strålning och en 16-timmars fotoperiod, vid en relativ luftfuktighet på 55 % ± 5 %).
- Överför dem till jorden 2 veckor efter mikroförökning.
- Fyll krukorna (r = 10 cm) med jord. Använd ett finger för att skapa ett 3-4 cm djupt hål i jorden i mitten av en kruka, fyll hålet med vatten och vänta tills det absorberas.
- Placera en planta per kruka i hålet och lämna bladen ovanför ytan. Täck försiktigt rötterna med jord (Figur 1B).
OBS: Vissa växter kanske inte utvecklar rötter. Undanta dessa växter från analysen.
- Odla växterna i jord i en odlingskammare under kontrollerade miljöförhållanden (22 °C i ljus och 19 °C i mörker, vid en relativ luftfuktighet på 55 % ± 5 %, med 250 μmol/m2/s strålning och en fotoperiod på 16 timmar).
- Efter 3-4 veckor är plantorna klara. Använd dessa växter för att inokuleras.
OBS: Plantor bör ha minst 3-4 fullt utvecklade blad med synliga blad (Figur 1C). De ska se friska ut, utan synliga symtom (gula eller bruna blad), som kan misstas för skador orsakade av PVY. För att uppnå jämförbara resultat bör växterna inokuleras samtidigt (t.ex. kl. 9) i alla försök för att undvika eventuella effekter av dygnsrytmen på växternas immunsvar och lesionsbildning 9,10,11.
2. Beredning av ympning och inokulering av potatis
- Inokulera växten med PVY-stammen N-Wilga (PVYN-Wi; accessionsnr. EF558545) Inokulat enligt nedan.
OBS: Fler växter kan inokuleras parallellt om mer än ett digitalt mikroskop finns tillgängligt. Plantorna bör ha minst tre fullt utvecklade blad före inokulering (figur 1C). PVYN-Wi multipliceras och underhålls i potatis cv. Pentland.- Förbered fosfatbuffert, kompletterad med natriumdietylditiokarbamat (DIECA), för inokulering: Blanda 1,3 ml 0,2 M NaH 2 PO 4, 8,7 ml 0,2M Na2HPO4 och 0,225 g DIECA. Fyll på volymen till 100 ml med ddH20. Justera pH till 7,6 genom att tillsätta 1 M NaOH eller 1 M HCl-lösning.
- Skörda 6-8 veckor gammal PVYN-Wi-infekterad potatis cv. Pentlandplantor från vävnadskultur i extraktionspåsar med filternät (0,5 g per 6 plantor) och tillsätt fosfatbuffert kompletterad med DIECA (4x massa växtmaterial, massa: volymförhållande). Använd en handhomogenisator i 1-2 minuter för att få en homogen lösning.
- Pudra lätt de tre första fullt utvecklade bladen på 3-4 veckor gamla potatisplantor (från steg 1.6) med karborundumpulver.
OBS: Justera mängden karborundumpulver. För mycket kan orsaka skada, medan för lite kan leda till ineffektiv infektion. Optimalt används 0,1 mg/cm karborundumpulver, vilket är cirka 1,5 mg pulver per blad av genomsnittlig storlek (cirka 15 cm2). - Gnugga försiktigt bladen med inokulatet (~100 μL per blad). Tvätta bladen noggrant med kranvatten efter 10 minuter.
- Var försiktig så att du inte skadar bladen. Överskrid inte inkubationstiden. Justera mängden ympning efter bladstorlek - 6,5 μL/cm, vilket är cirka 100 μL per blad av medelstorlek (cirka 15 cm2).
- Överför plantorna till en odlingskammare och odla dem under kontrollerade miljöförhållanden (28 °C i ljus och 28 °C i mörker vid en relativ luftfuktighet på 55 % ± 5 %, med 250 μmol/m2/s strålning och en fotoperiod på 16 timmar) i 3 dagar.
3. Växtförberedelse och användning av det digitala mikroskopet för att registrera lesionsutveckling
- Överför de inokulerade plantorna från den odlingskammare som hålls vid 28 °C till en odlingskammare vid 22 °C 3 dagar efter inokuleringen, med andra villkor som beskrivs i steg 1.5.
- Välj en växt för observation. Immobilisera det andra inokulerade bladet med tejp (Figur 1D). Se till att det önskade bladet är helt immobiliserat innan du börjar med avbildning (Figur 1D).
- Installera ett program för bildtagning på den bärbara datorn. Anslut det digitala mikroskopet till datorn. Öppna programvaran.
OBS: Se till att anläggningen, det digitala mikroskopet och den bärbara datorn är placerade på hyllan nära uttaget för att ansluta datorn. Beslutet om valet av blad som ska övervakas kan bero på den biologiska frågeställningen som studeras, t.ex. vilken typ av process som leder till bildandet av begränsad programmerad celldöd. - Justera mikroskopet ovanför det immobiliserade bladet. Fokusera med hjälp av ratten på det digitala mikroskopet (visas i figur 1E).
- Se till att siktlinjen är så bred som möjligt för att öka chanserna att fånga bildandet av lesionen men fortfarande förstorad nog för att upptäcka lesionens utseende (vanligtvis används 25x förstoring).
- Ställ in kamerainställningarna. Klicka på knappen Inställningar i bildens övre högra hörn (Figur 2A, inringad del 1) och justera kamerainställningarna: Ljusstyrka (60-70), Kontrast (10-15), Nyans (0), Vitbalans, Mättnad (45-50), Skärpa (0), Gamma (5) (Figur 2B). Inställningarna som användes i denna studie var följande: Ljusstyrka (64), Kontrast (14), Nyans (0), Mättnad (47), Skärpa (0), Gamma (5).
OBS: Kamerainställningarna bör justeras till utomhusljus för att säkerställa bästa bildkvalitet. Inställningarna kan anpassas efter användarens förutsättningar i odlingskammaren. - Ställ in inställningarna för bildtagning genom att klicka på ikonen för Bildtagning (Figur 2C, inringad del 2). Klicka på knappen Time-Lapsed Video och ställ in Image Capture var 15:e minut i 24 timmar (Figur 2C).
OBS: Intervallet mellan de tagna bilderna och bildernas varaktighet är helt flexibelt och kan anpassas efter experimentets behov. Under tiden mellan bildtagningen släcks LED-lampan. LED-lampan tänds automatiskt under bildtagningen. - Starta bildtagningen genom att klicka på START-knappen (Figur 2C).
OBS: Efter att ha överförts från 28 °C till 22 °C bör plantorna börja utveckla lesioner inom 24 timmar. Om inte, kan detta vara ett tecken på ineffektiv vaccinering. Justera mängden karborundumpulver, se till att tidpunkten för inokulatinkubation på bladen var korrekt och bestäm virusförekomsten i inokulatet med qPCR. - Om du vill spara bilder markerar du alla bilder och klickar på ikonen Spara (bild 2B, inringad del 3). Ange exportalternativ. Ställ in DPI på max (300) (Figur 2D). När du har sparat tar du bort alla bilder i programmet.
- För bildanalys räcker det med vilket program som helst för bildvisning/redigering. Användningen av fri programvara för bildredigering, ImageJ, förklaras nedan.
- Importera tidssekvensen av bilder från ett enda synfält (klicka på Arkiv i det övre vänstra hörnet, välj Importera och sedan Bildsekvens). Klistra in sökvägen till katalogen med sparade bilder och tryck på OK-knappen för att starta konverteringen.
- Efter konverteringen öppnar programvaran automatiskt en intern videospelare som visar den slutliga videon. Exportera videofilen genom att klicka på alternativet Arkiv > Spara som och välja AVI-format. Ett litet fönster öppnas. Ställ in bildfrekvensen till 0.3 fps och tryck på OK för att spara videon som en AVI-video file.
OBS: Tiden för lesionens utveckling kan också bestämmas genom att manuellt kontrollera alla bilder och hitta en bild där lesionen visas.
Representative Results
Denna studie visar ett steg-för-steg-protokoll för att studera celldödsinitiering genom lesionsförekomst på potatis-cv. Rywal, med ett digitalt mikroskop. Detta gör det möjligt att bestämma den exakta tidpunkten för programmerad celldöd initiering.
Plantor som har utvecklat rötter sattes i jord 2 veckor efter potatisens cv. Rywals mikroförökning (figur 1A,B). Efter 3-4 veckors tillväxt under beskrivna förhållanden användes plantor med minst 3-4 fullt utvecklade blad med synliga blad som såg friska ut, utan tecken på avskärning, för vidare analys (Figur 1C). Med hjälp av ett digitalt mikroskop enligt beskrivningen i detta protokoll observerade vi samma område på det inokulerade bladet med 15 minuters mellanrum och bestämde lesionens förekomst och expansion i tid (Figur 3). Lesionen inträffade efter 15 timmar och 30 minuter (Figur 3).

Figur 1: Växtberedning för analys med ett digitalt mikroskop . (A) En plastlåda med MS 30 medium och potatis cv. Rywal-växtexplantor som innehåller noder. B) Potatis cv. Rywal-planta i jord (2 veckor efter mikroförökning). c) Potatis cv. Rywal-planta, redo för ympning (4 veckor efter att den satts i jord), med minst tre fullt utvecklade blad. (D) Det andra inokulerade bladet (pilen) av potatisen cv. Rywal-anläggningen positionerad och immobiliserad (pil) med tejp. (E) Växten placerad under det digitala mikroskopet med pilen pekande på den ratt som används för fokusering. Klicka här för att se en större version av denna figur.

Figur 2: Digital programvaruinställning för registrering av lesionsutveckling. (A) Programvarugränssnitt - inringat med rött finns alternativ för knappen för (1) kamerainställningar, (2) inställningar för bildtagning och (3) spara bilder. (B) Fönster med kamerainställningar, som öppnas med ett klick på (1) i panel A. Ljusstyrka, kontrast, mättnad, skärpa och gamma bör justeras korrekt. (C) Fönster med bildtagningsinställningar, som öppnas med ett klick på (2) betecknat i panel A. (D) Fönster med inställningar för att spara bilder, som öppnas med ett klick på (3) betecknat i panel A. Klicka här för att se en större version av denna figur.

Figur 3: Lesionsbildning på det inokulerade bladet observerat under det digitala mikroskopet. Bilder av den centrala delen av PVY-inokulerade potatisblad vid 23,6x förstoring sett under det digitala mikroskopet, tagna med 5 minuters mellanrum. Inokulerade plantor sattes vid 28 °C i 3 dagar, och på den tredje dagen började observationen med ett digitalt mikroskop vid 22 °C klockan 7:00. (A) Klockan 21:02 är skadan ännu inte synlig, (B) 90 minuter senare, klockan 22:32, är skadan synlig. (C) Lesionens expansion observerades kl. 01:02 och (D) 07:32 nästa morgon. Experimentet upprepades två gånger och lesionerna inträffade 8 timmar och 15 minuter respektive 12 timmar efter att celldöden påbörjats. Klicka här för att se en större version av denna figur.
Discussion
Det demonstrerade protokollet gör det möjligt för användaren att exakt bestämma initieringshastigheten för celldöd genom att kontinuerligt avbilda inokulerade blad under tiden mellan celldödsinitieringen och celldödens utseende med hjälp av ett digitalt mikroskop. Även om det finns många sätt att övervaka förekomst av skador och växtsjukdomar12,13,14,15, har detta protokoll fördelen att det kan mätas oberoende av ljus utan att störa växtens dygnsrytm, eftersom ljuset släcks mellan mätningarna.
Efter vaccinationen ska plantorna växa vid 28 °C i 3 dagar. Ny-1-resistensgenen , som inducerar en överkänslig respons, är temperaturberoende och i växter som odlas vid högre temperaturer leder den till abort av resistens, vilket yttrar sig som utebliven lesionsbildning och systemiskvirusspridning. Efter att växterna har överförts till 22 °C initieras celldöd, så för korrekta resultat bör observationen med ett digitalt mikroskop påbörjas så snart som möjligt efter denna överföring. Ett annat viktigt steg i förberedelsen av växten för avbildning är immobiliseringen av bladet (Figur 1D), eftersom växten kommer att fortsätta att växa under avbildningen, vilket kan flytta det observerade bladet ur fokus, eller så kommer en sådan uppsättning inte att ge önskat resultat.
Om det beskrivna protokollet används på transgena växter med förändrade komponenter av intresse, som antas vara involverade i initiering av celldöd, gör protokollet det möjligt för användaren att avgöra om den minskade nivån av en studerad komponent påverkar graden av celldödsinitiering. På så sätt kan komponenter som är involverade i initiering av celldöd identifieras i patosystem, där programmerad celldöd inträffar, med hjälp av detta protokoll. Andra metoder för att identifiera dessa komponenter är till exempel transkriptomisk analys som RNA-seq eller olika former av mikroskopi, vilket kan vara dyrt och tidskrävande. Metoden som beskrivs i detta protokoll möjliggör enkel och billig identifiering av komponenter som är involverade i initiering av celldöd genom att observera skillnader i initieringshastigheter för celldöd mellan transgena växter och kontrollväxter. Optimalt, i en sådan uppställning, måste två digitalkameror användas, eftersom en transgen anläggning bör analyseras parallellt med en kontrollanläggning inom samma experiment.
I detta protokoll användes PVY-stammen N-Wilga; Andra stammar av detta virus, t.ex. GFP-märkt PVY (PVY-N605(123)-GFP)7, kan dock också användas. Dessutom kan andra patosystem, som resulterar i programmerad celldöd, studeras med hjälp av detta protokoll med mindre modifiering.
Disclosures
Författarna förklarar att de inte har några intressekonflikter.
Acknowledgments
Vi tackar Barbara Jaklič för den tekniska hjälpen. Denna forskning stöddes ekonomiskt av den slovenska forsknings- och innovationsbyrån (forskningsbasfinansiering nr P4-0165 och projekt Z4-3217: Dechiffrera redoxrelaterad signalering interconnectedness i potatisresistens mot virus).
Materials
| Name | Company | Catalog Number | Comments |
| Alcohol burner | Mikro+Polo | SH-234002455 | For tweezers and scalpel sterilization |
| Autoclave A-21 CAV | Kambi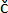 |
N/A | |
| Bacto Agar | Becton, Dickinson and Company | 214010 | |
| Carborundum powder | VWR Chemicals | 22505297 | |
| DinoCapture 2.0 | Dino-Lite | Version 2.0 | software for digital microscope |
| Dino-Lite Edge AM7915MZTL digital microscope | AnMo Electronics Corporation | AM7915MZTL | |
| Ethanol, 70% | Stella Tech | P94000 | For tweezers and scalpel sterilization |
| Extraction bags | Bioreba | 420100 | |
| Growth chamber FS-WI | Photon Systems Insturments | N/A | |
| Hand homogenizer | Bioreba | 400010 | |
| Hawita Special Substrate | HAWITA Gruppe | 2000000071701 | Ready to use substrate, made using peat (H4-H6 and H6-H8) |
| Hydrochloric acid (HCl) | Merck | 109057 | |
| Label tape | Sigma | L8144-5EA | |
| Laptop computer with installed DinoCapture 2.0 | HP | Z2V77EA#BED | Computer needs to be transferable as experiment takes part in a growth chamber |
| Murashige and Skoog medium | Duchefa Biochemie | M02220100 | |
| Na2HPO4 | Emsure | 1065860500 | |
| NaH2PO4 | Emsure | 1064700250 | |
| Pasteur pipette 0.5 mL | Brand | 21500209 | |
| pH-meter | Mettler Toledo | ML1601 | |
| Plastic boxes | Cvetlice Dornig | VCG10.5 | Radius = 10.5 cm |
| Plastic pots | Lab Associates | DIS40003 | Radius = 11.5 cm (top), Radius = 9.8 cm (bottom) |
| Saccharose | Kemika d.d. | 1800408 | |
| Sodium Diethyldithiocarbamate (DIECA) | Sigma-Aldeich | 228680 | Sodium diethyldithiocarbamate trihydrate, ACS reagent |
| Sodium hydroxide (NaOH) | Merck | 106462 | |
| Sterile surgical blades | Braun | 4511733633 | |
| Tweezers | Braun | BD033R |
References
- Karasev, A. V., Gray, S. M. Continuous and emerging challenges of potato virus y in potato. Annual Review of Phytopathology. 51, 571-586 (2013).
- Quenouille, J., Vassilakos, N., Moury, B. Potato virus Y: A major crop pathogen that has provided major insights into the evolution of viral pathogenicity. Molecular Plant Pathology. 14 (5), 439-452 (2013).
- Szajko, K., et al. The novel gene Ny-1 on potato chromosome IX confers hypersensitive resistance to Potato virus Y and is an alternative to Ry genes in potato breeding for PVY resistance. Theoretical and Applied Genetics. 116 (2), 297-303 (2008).
- Szajko, K., Strzelczyk-Żyta, D., Marczewski, W. Ny-1 and Ny-2 genes conferring hypersensitive response to potato virus Y (PVY) in cultivated potatoes: Mapping and marker-assisted selection validation for PVY resistance in potato breeding. Molecular Breeding. 34 (1), 267-271 (2014).
- Lukan, T., et al. Cell death is not sufficient for the restriction of potato virus Y spread in hypersensitive response-conferred resistance in potato. Frontiers in Plant Science. 9, 168 (2018).
- Baebler, Š, et al. Salicylic acid is an indispensable component of the Ny-1 resistance-gene-mediated response against Potato virus y infection in potato. Journal of Experimental Botany. 65 (4), 1095-1109 (2014).
- Lukan, T., Coll, A., Baebler, Š, Gruden, K. Analysis of virus spread around the cell death zone at spatiotemporal resolution using confocal microscopy. Methods in Molecular Biology. 2447, 261-270 (2022).
- Vinterhalter, D., Dragiüeviü, I., Vinterhalter, B. Potato in vitro culture techniques and biotechnology. Fruit, Vegetable and Cereal Science and Biotechnology. 2, Special Issue 16-45 (2008).
- Wang, W., et al. Timing of plant immune responses by a central circadian regulator). Nature. 470, 110-115 (2011).
- Roden, L. C., Ingle, R. A. Lights, rhythms, infection: The role of light and the circadian clock in determining the outcome of plant-pathogen interactions. Plant Cell. 21 (9), 2546-2552 (2009).
- Srivastava, D., et al. Role of circadian rhythm in plant system: An update from development to stress response. Environmental and Experimental Botany. 162, 256-271 (2019).
- Mulaosmanovic, E., et al. High-throughput method for detection and quantification of lesions on leaf scale based on trypan blue staining and digital image analysis. Plant Methods. 16, 62 (2020).
- Martinelli, F., et al. Advanced methods of plant disease detection. A review. Agronomy for Sustainable Development. 35, 1-25 (2015).
- Ali, M., Bachik, N., Muhadi, N. A., Tuan Yusof, T. N., Gomes, C. Non-destructive techniques of detecting plant diseases: A review. Physiological and Molecular Plant Pathology. 108, 101426 (2019).
- Sankaran, S., Mishra, A., Ehsani, R., Davis, C. A review of advanced techniques for detecting plant diseases. Computers and Electronics in Agriculture. 72 (1), 1-13 (2010).
- Rowarth, N. M., et al. RNA-Seq analysis reveals potential regulators of programmed cell death and leaf remodelling in lace plant (Aponogeton madagascariensis). BMC Plant Biology. 21 (1), 375 (2021).



