Introduction
Myxoviruset motstand (Mx) proteiner er en viktig del av det medfødte immunforsvaret mot virus patogener. Disse proteinene er store dynamin lignende GTPases som er indusert av type I og type III-interferoner. De tilsvarende Mx-gener er til stede i nesten alle virveldyr i ett eller flere kopier og deres genprodukter inhibere et bredt spekter av virus, inkludert Orthomyxoviridae (f.eks., Influensavirus), Rhabdoviridae (f.eks., Vesikulært stomatitt-virus), Bunyaviridae (f.eks. , la crosse virus) og Retroviridae (f.eks humant immunsviktvirus-1) 1-4. Det er uklart hvordan disse proteinene gjenkjenne et så bredt spekter av virus, uten noen åpenbar delt primær sekvens motivene i disse virusene. Analysere samspillet av Mx proteiner med sine viral mål, potensielt involverer høyere ordens komplekser med andre vertscelle faktorer, vil bidra til å forstå de molekylære mekanismene tlue har utviklet seg i våpenkappløpet mellom virus og deres verter.
Samspillet mellom pattedyr Mx-proteiner og virale mål har blitt studert i utstrakt grad for human MXa. Humant MXa kan hemme replikasjon av flere virus, herunder ortomyksovirus influensa A og Thogoto virus. MXa binder Thogoto virus ribonukleoproteinpartikler komplekser (vRNPs), for derved å hindre deres atom inn, noe som resulterer i blokk av infeksjon 5. Dette samspillet mellom MXA og Thogoto virus vRNPs har blitt demonstrert med co-sedimente og co-immunoutfellingsstudier eksperimenter 6-9. Hvordan Mx proteiner hindre influensa A-virus er mindre klar. Et stort problem er at det er ikke enkelt å påvise en interaksjon mellom en Mx-protein og et influensa-genproduktet. En rapport viste et samspill mellom menneske MXA og NP protein i influensa A virus infiserte celler 10. Dette samspillet kan bare vises ved co-immunoprecipitation hvis cellene var blitt behandlet med det tverrbindende reagens-ditiobis (succinimidyl propionat) før lysering, noe som antyder at interaksjonen er forbigående og / eller svak. Nyere studier har vist at den differensielle Mx følsomheten av forskjellige influensa A-stammer bestemmes av opprinnelsen av NP-proteinet 11,12. I tråd med dette, kan influensa A-virus delvis flykte fra Mx kontroll ved å mutere spesifikke rester i NP protein 13. Dette tyder på at hovedmålet for influensa A-virus for verts Mx er NP protein, mest sannsynlig NP montert i vRNP komplekser. Men ingen av disse nyere studiene viste en interaksjon mellom influensa NP eller vRNPs og enten menneskelig MXA eller mus Mx1.
Nylig viste, for første gang, en interaksjon mellom influensa NP og musen Mx1 protein med en optimalisert co-immunoutfelling protokoll 14 som er beskrevet her i detalj. Generelt, co-immunoprecipitation er en av de mest brukte biokjemiske metoder for å undersøke protein-protein interaksjoner. Denne teknikk blir ofte foretrukket fremfor alternative teknikker, for eksempel, gjær to-hybrid, siden det gjør det mulig å undersøke protein-protein interaksjoner i sitt naturlige miljø. Co-immunoutfelling kan utføres på endogent uttrykte proteiner dersom antistoffer mot proteiner av interesse er tilgjengelig. Alternativt kan proteinene av interesse bli uttrykt i cellen gjennom transfeksjon eller infeksjon, og en affinitetsmerkelapp kan anvendes. I tillegg til de ovennevnte fordeler, tillater den beskrevne ko-immunoutfelling protokoll detektering av svake og / eller forbigående protein interaksjoner. Hovedkomponenten i dette optimalisert protokollen er tilsetning av N-etylmaleimid (NEM) i cellelyseringsbuffer. NEM er et alkylerende reagens som reagerer med frie tiol-grupper som er til stede i cysteiner, ved en pH på 6,5 til 7,5, for å danne en stabil tio-esteren(Figur 1). Ved høyere pH-verdi, kan NEM også reagere med aminogrupper eller gjennomgå hydrolyse 15. NEM blir typisk brukt for å blokkere frie tiolgrupper, for å hindre dannelse av disulfidbinding eller inhibere enzymatisk aktivitet. For eksempel er NEM ofte brukt til å blokkere desumoylating enzymer, som er cysteinproteaser. I den beskrevne ko-immunoutfelling protokollen, ble NEM innledningsvis inkludert i lyseringsbuffer, fordi det var blitt rapportert at sumoylation av influensa proteiner kan påvirke interaksjonen mellom virale proteiner 16. Uventet, tillegg av NEM viste seg å være nøkkelen til å dokumentere samspillet mellom influensa NP og mus Mx1 av co-immunoprecipitation. Det er uklart hvorfor tilsetningen av NEM er avgjørende for å detektere NP-Mx1 interaksjon. Muligens samspillet er for forbigående og / eller svak. NEM kunne stabilisere samhandling, for eksempel, ved å bevare en bestemt konformasjon av Mx1, en viral protein eller til og med en ukjent tredje component. En slik stabiliserende effekt av NEM har blitt observert før, for eksempel, for samspillet mellom ribonukleotidreduktase M1 og dens inhibitor gemcitabin (F2dC) 17. MX1 og NP begge inneholder flere cysteinrester som kan være modifisert med NEM. For eksempel, en fersk undersøkelse utført av Rennie et al. Viste at en stalkless MXA-varianten inneholder tre løsemiddel utsatt cysteinresiduer som kan modifiseres av iodoacetamide. Mutere disse rester til seriner ikke påvirke den enzymatiske aktiviteten til MXa, men forhindret disulfid-mediert aggregering 18. Ettersom disse cysteiner er bevart i Mx1, tyder dette på at de analoge cysteiner i Mx1 kan endres av NEM og som sådan innflytelse sin konformasjon eller oppløselighet. I tillegg kan NEM også påvirke GTPase aktivitet av Mx1, noe som er viktig for anti-influensaaktivitet av Mx1, og derved stabilisere interaksjonen mellom Mx1 og NP. Men en direkte effekt av NEM på GTPase aktiteten av Mx1 er usannsynlig, som NEM er også nødvendig for å påvise samspillet mellom influensa NP og GTPase inaktive mutanter av den Mx1 protein 14. Åpenbart trengs mer forskning for å avdekke effekten av NEM på NP-Mx1 interaksjon.
Oppsummert kan den beskrevne ko-immunoutfelling protokollen for å studere interaksjonen mellom den antivirale Mx1 protein og dets virale mål, influensa NP-protein. Denne protokollen kan også brukes til å studere andre svake eller flyktige interaksjoner som avhenger av stabilisering av spesifikke protein-konformasjoner. Protein-protein interaksjon som er avhengig av bestemte konformasjoner er blitt beskrevet tidligere, f.eks for kalsiumbindende proteiner så som kalmodulin 19. Endelig kunne det gunstig rolle for NEM også brukes i andre fremgangsmåter som gjenkjenner protein-protein interaksjoner, for eksempel ko-sedimenteringsanalyser.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Merk: Følgende transfeksjon og co-immunopresipitering protokollen er etablert for en 9 cm petriskål format. Andre formater er også mulig etter skalering protokollen.
1. Seeding Human Embryonic Nyre (HEK) 293T Cells
- Seed den HEK293T cellene én dag før transfeksjon til 1,2 x 10 6 celler pr 9 cm Petri-skål i 12 ml Dulbeccos modifiserte Eagles medium (DMEM) supplert med 10% føtalt kalveserum, 2 mM L-glutamin, 0,4 mM Na-pyruvat, 0,1 mM ikke-essensielle aminosyrer, 100 U / ml penicillin og 0,1 mg / ml streptomycin.
- Dyrke cellene i 16 timer ved 37 ° C og 5% CO2.
- Inspiser morfologi og levedyktighet av cellene med en invertert lys mikroskop før transfeksjon. Cellene må være sub-konfluent for optimal transfeksjonseffektivitet.
2. Kalsiumfosfat Transfeksjon av HEK293T Cells
Notat: Bruk 0,5-1 mikrogram pCAXL-NP eller tom pCAXL plasmid i kombinasjon med 1-3 mikrogram av pCAXL-Mx1 per 9 cm parabolen. Bruke en like stor mengde av den samlede plasmid-DNA i alle prøver; justere med tomt plasmid om nødvendig.
- Forbered følgende transfeksjonsteknologier buffere:
- Forbered Tris-EDTA (TE) med konsentrasjoner på 1,0 mM Tris-HCl pH 8,0 og 0,1 mM EDTA pH 8,0.
- Forbered BS / HEPES med konsentrasjoner på 25 mM HEPES (5,96 g / l, 4- (2-hydroksyetyl) -1-piperazinetansulfonsyre), 274 mM NaCl (16 g / L), 10 mM KCl (0,74 g / l), 1,5 mM NaHPO 4 · 12 H 2 O (0,5 g / l) og 11,1 mM glukose (2 g / l). Justere pH til 7,05.
- Forbered CaCl2 / HEPES med konsentrasjoner av 1,25 M CaCl2 · 2 H 2 O (183,8 g / l) og 125 mM HEPES (29,79 g / l). Juster pH-verdien til 7,05 med NaOH.
- Varm transfeksjonsagensene buffere ved 37 ° C før bruk.
- Fremstille plasmid-prøvene ved fortynning av plasmid-DNA i 600 ul TE.Fremstille disse blandinger i brønner i en 6-brønns plate.
- Tilsett 150 ul av CaCl2 / HEPES på en dråpevis måte til de plasmid-prøvene og blandes ved pipettering 3 ganger opp og ned.
- Klargjør transfeksjon løsningen ved dråpevis tilsetning av plasmid-løsning (TE + DNA + CaCl2 / HEPES; 750 ul) til 750 ul av BS / HEPES-buffer levert i en frisk 6-brønns plate. Distribuere plasmidet løsning jevnt over hele godt inneholder BS / HEPES buffer.
- Rist transfeksjon løsning på en platerister i 90 sekunder ved 1000 RPM.
- Inkuber blandingen i 5 min ved romtemperatur.
- Tilsett transfeksjon løsning (1,5 ml) dråpevis til cellene. Bruk en P1000 mikropipette å dryppe transfeksjon løsning på cellene. Spre blandingen over hele 9 cm petriskål og riste platen veldig forsiktig.
- Inkuber cellene ved 37 ° C og 5% CO2 i 6 timer. Deretter fjerner mediet ved aspirasjon og umiddelbart erstatte with 12 ml frisk, forvarmet medium. Forsiktig tilsett friskt medium til cellene for å forhindre celle-løsgjøring. For dette holder spissen av pipetten mot siden av brønnen og trykk forsiktig ut i mediet.
- Cellene inkuberes i ytterligere 16 timer ved 37 ° C og 5% CO2.
3. Co-immunoprecipitation
Merk: Utfør co-immunpresipitering 24 timer etter transfeksjon.
- Fremstilling av den lave salt lysis buffer og høy saltvaskebuffer.
- Fremstille en stamoppløsning av 2 M N-etylmaleimid (NEM) ved å veie mengden av NEM og oppløse det i absolutt etanol. Klargjør NEM stamløsning frisk før bruk.
FORSIKTIG: NEM er svært giftig, forberede og bruke denne stamløsning i en avtrekkshette. - Forbered lav salt lysisbuffer ved konsentrasjoner på 50 mM Tris-HCl pH 8, 150 mM NaCl, 5 mM ethylendiamintetraeddiksyre (EDTA), 1% NP40, og en protease inhibitor cocktail (oppløse 1 tabellt i 50 ml lyseringsbuffer). Legg NEM til en sluttkonsentrasjon på 25 mM (dvs. fortynnes 1:80). Hold på is etter tilsetting av proteasehemmere og NEM.
Merk: Alltid legge proteasehemmere og NEM fersk før bruk. - Tilbered en høy saltvaskebuffer ved konsentrasjoner på 50 mM Tris-HCl pH 8, 500 mM NaCl, 5 mM EDTA og 1% NP40. Legg merke til at den høye saltvaskebuffer ikke inneholder NEM.
- Fremstille en stamoppløsning av 2 M N-etylmaleimid (NEM) ved å veie mengden av NEM og oppløse det i absolutt etanol. Klargjør NEM stamløsning frisk før bruk.
- Utarbeidelse av cellelysater.
- Fjern mediet og vask cellene med 2 ml iskald fosfatbufret saltløsning (PBS). Veldig forsiktig legge vaskebufferen, som HEK293T celler løsne lett.
- Ta av PBS og tilsett 600 mL av iskald lav salt lysisbuffer per 9 cm petriskål.
- Platene inkuberes i 20 minutter på is. Pass på at platene holdes horisontalt, for å sikre fullstendig dekning av platen overflaten med lysisbuffer. Rist platene hvert 5 min.
- Samle cellelysat i et 1,5 ml mikrosentrifugerør og sentrifuger i 3 min ved 4 ° C og 16.000 x g for å pelletere uoppløselig fraksjon.
- Overfør den løselige fraksjon, dvs. cellelysat til en frisk 1,5 ml mikrosentrifugerør og hold på is. Umiddelbart fortsette med co-immunoutfelling protokollen, for å forhindre dissosiering av de interagerende proteiner. Utføre alle de følgende steg så mye som mulig på is eller ved 4 ° C for å begrense proteolytisk aktivitet i lysatene.
- Generasjon av immunkomplekser.
Merk: I dette trinnet, er proteinet av interesse bundet av den aktuelle antistoff. Å studere NP-Mx1 interaksjon, bruke en mus anti-NP monoklonalt antistoff.- For hver prøve blande 135 ul av lysatet med 2 ul av anti-NP-monoklonalt antistoff og 113 pl av lav salt lysis buffer (totalt volum på 250 ul). Lagre de gjenværende lysat ved -20 ° C for videre analyse som Western-blotting, for å dokumentere de ekspresjonsnivåene av antatt interaDette skjer partnere i de transfekterte celler.
Merk: Alternativt kan måle proteinkonsentrasjonen av løsningen (for eksempel med Bradford-reagens), og bruke en fast mengde av totalt protein, f.eks, 400 ug, for hvert lysat. - Inkuber antistoff-lysat blandingen i 3 timer på et vendehjul ved 4 ° C. Dette trinnet kan bli utvidet til en inkubering over natten.
- For hver prøve blande 135 ul av lysatet med 2 ul av anti-NP-monoklonalt antistoff og 113 pl av lav salt lysis buffer (totalt volum på 250 ul). Lagre de gjenværende lysat ved -20 ° C for videre analyse som Western-blotting, for å dokumentere de ekspresjonsnivåene av antatt interaDette skjer partnere i de transfekterte celler.
- Fremstilling av protein-G-perler.
Merk: protein G perler fraktes og lagres i 20% etanol for bevaring. Vulsten-oppslemming som normalt består av 50% perler og disse perler må vaskes før de brukes til å immunoutfelle immunkomplekser.- Bruke 50 ul av perler, dvs. 100 ul perle-oppslemming, for hver prøve. Vask mengden av perler som er nødvendig for alle prøver i det ko-immunoutfelling assay i en tube. Skjær tuppen av en 1 ml pipette å lette pipettering av perlen-slurry.
- Sentrifuger protein G perle-slurry på 8000 xg og 4 ° C i 30 sek. Fjerne etanol-løsning og tilsett et likt volum av lav saltoppløsningsbuffer. Sentrifuger protein G perle-oppslemming ved 8.000 x g og 4 ° C i 30 sek og fjern supernatanten forsiktig. Gjenta dette vasketrinn 3 ganger.
Merk: Den lave saltoppløsningsbuffer som brukes til å vaske perlene trenger ikke å inneholde proteaseinhibitorer eller NEM. - Estimere volumet av protein G-perler og tilsett et likt volum av lav saltlyseringsbuffer for å lage en ny 50% perle-oppslemming i lav saltlyseringsbuffer.
- For hver prøve overføre 100 ul perle-oppslemming i en frisk 1,5 ml mikrosentrifugerør og lagre på is inntil bruk. Vær nøye med å resuspendere perle-oppslemming før oppdelingen, da disse perler raskt sedimentere til bunnen av røret.
- Immunoutfelling av immunkomplekser med protein G-perler og deres eluering.
- Før du bruker protein G perler for immunopresipitering, sentrifuger alle rørene 30 sek ved 8000 xg og 4 ° C ogbekreftet ved visuell inspeksjon at det er en lik mengde av perler til stede i alle prøver. Hvis det er nødvendig å justere mengden av perler i noen av prøvene, og sentrifuger på nytt. Forkaste Supernatantene. Vær forsiktig for ikke å forstyrre de pelleterte protein G perler.
- I korthet sentrifuger immunkomplekser (f.eks., Lysater med antistoffet, 250 mL) i 30 sekunder ved 8.000 x g og 4 ° C samle hele prøven i bunnen av røret. Overfør immunkomplekser til protein G-perler (50 ul).
- Inkuber 60 min på et vendehjulet ved 4 ° C. Ikke inkuber disse immunkomplekser er lengre enn 75 min med kulene for å redusere ikke-spesifikk binding av proteiner til protein G-perler.
- Sentrifuger protein G-perler (med bundne immunkomplekser) i 30 sekunder ved 8.000 x g og 4 ° C, og fjerne supernatanten. Vær forsiktig for ikke å forstyrre de pelleterte protein G perler. Valgfritt: lagre denne Supernatantene ved 4 ° C eller -20 ° C for senere analyse,eksempel, for å estimere mengden av ubundet protein.
- Vask protein G-perler i ca. 5 min med 900 ul av høy saltoppløsningsbuffer. Pass på at perlene er helt resuspendert i vaskebufferen for optimal vasking. Sentrifuger protein G-perler i 30 sekunder ved 8.000 x g og 4 ° C og supernatantene kastes. Gjenta dette vasketrinn 4 ganger. Vær forsiktig for ikke å forstyrre de pelleterte protein G perler for å unngå tap av immunpresipitert materiale.
- Etter siste vasketrinn, tilsett 50 pl av 2 x Laemmli-prøvebuffer til kulene, og oppvarming av suspensjonen i 10 min ved 95 ° C for å eluere de (ko) immunpresipiterte proteiner.
- Forbered 10 ml 6 x Laemmli-buffer med 1 g natriumdodecylsulfat, 3,5 ml glyserol, 3,5 ml 1 M Tris-HCl pH 6,8, og 420 ul av β-merkaptoetanol. Juster til et totalt volum på 10 ml ved tilsetning av destillert vann. Fortynn 3 ganger i destillert vann for å oppnå 2x Laemmli buffer.
FORSIKTIG: &# 946; merkaptoetanol er giftig, forberede og bruke Laemmli buffer i en avtrekkshette.
- Forbered 10 ml 6 x Laemmli-buffer med 1 g natriumdodecylsulfat, 3,5 ml glyserol, 3,5 ml 1 M Tris-HCl pH 6,8, og 420 ul av β-merkaptoetanol. Juster til et totalt volum på 10 ml ved tilsetning av destillert vann. Fortynn 3 ganger i destillert vann for å oppnå 2x Laemmli buffer.
- Etter oppvarming, sentrifuger protein G-perler i 30 sekunder ved 8.000 x g og lagres prøvene ved 4 ° C (kortvarig) eller -20 ° C (langtids).
4. Analyser (med) immunpresipitert Proteiner
- Visualisere proteinene som er tilstede i cellelysat og eluatet fra co-immunoutfelling ved SDS-PAGE 20 og western-blotting 21,22. Vanligvis legger halvparten av Laemmli eluatet på gel. Vær forsiktig for ikke å forstyrre de pelleterte protein G perler når du tar prøver for gel lasting. MX1 og NP ekspresjon ble avdekket med en anti-Mx1 og anti-NP-antistoff, henholdsvis 14. Båndene ble påvist med HRP-baserte chemiluminescence og en X-ray film utvikler.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
N-etylmaleimid er en organisk forbindelse som kan benyttes for å irreversibelt modifisere frie tiolgrupper, for eksempel for å inhibere cysteinproteaser (figur 1).
Antiviral Mx1 protein hemmer influensa A virus replikasjon ved å samhandle med viral nucleoprotein. Den optimaliserte co-immunoprecipitation protokollen beskrevet her gjør det mulig å studere dette NP-Mx1 interaksjon. HEK293T-celler ble transfektert med ekspresjonsvektorer for de antivirale Mx1 protein i fravær eller nærvær av influensa NP-protein. Deretter NP-proteinet ble trukket ned fra de totale cellelysatene med en NP-spesifikt monoklonalt antistoff. Figur 2 viser at MX1-proteinet bare er ko-immunopresipitert i nærvær av ko-uttrykt NP. Mulig ikke-spesifikk ko-immunoutfelling av Mx1 i fravær av NP er forårsaket av enten ikke-spesifikk pull-down av MX1 protein ved anti-NP-antistoff eller ved ikke-spesifikk binding av Mx1 tilprotein G perler. Derfor alltid inneholde en negativ kontroll for å vurdere denne ikke-spesifikk ko-immunoutfelling. Figur 3 viser at NP-Mx1 interaksjon kan kun bli detektert i nærvær av NEM. I dette forsøk, ikke-spesifikk binding av Mx1 til protein G-perler ble vurdert med en styre co-immunoutfelling reaksjon i fravær av anti-NP-antistoff.
Denne protokollen kan også brukes til å studere interaksjonen mellom Mx1 og influensa NP-protein isolert fra infiserte celler eller fra virioner. For denne anvendelse ble den ovennevnte protokoll svakt tilpasses ved å kombinere lysater av Mx1 uttrykkende celler med lysater inneholdende det virale NP-proteinet før ko-immunopresipitering protokoll. Figur 4 viser den ko-immunopresipitering av Mx1 med NP isolert fra transfekterte celler, infiserte cellene eller viruspartikler.
Som konklusjon viser disse resultater at denne co-immunoutfelling protocol kan brukes til å studere interaksjonen mellom et antiviralt protein og dets virale mål.
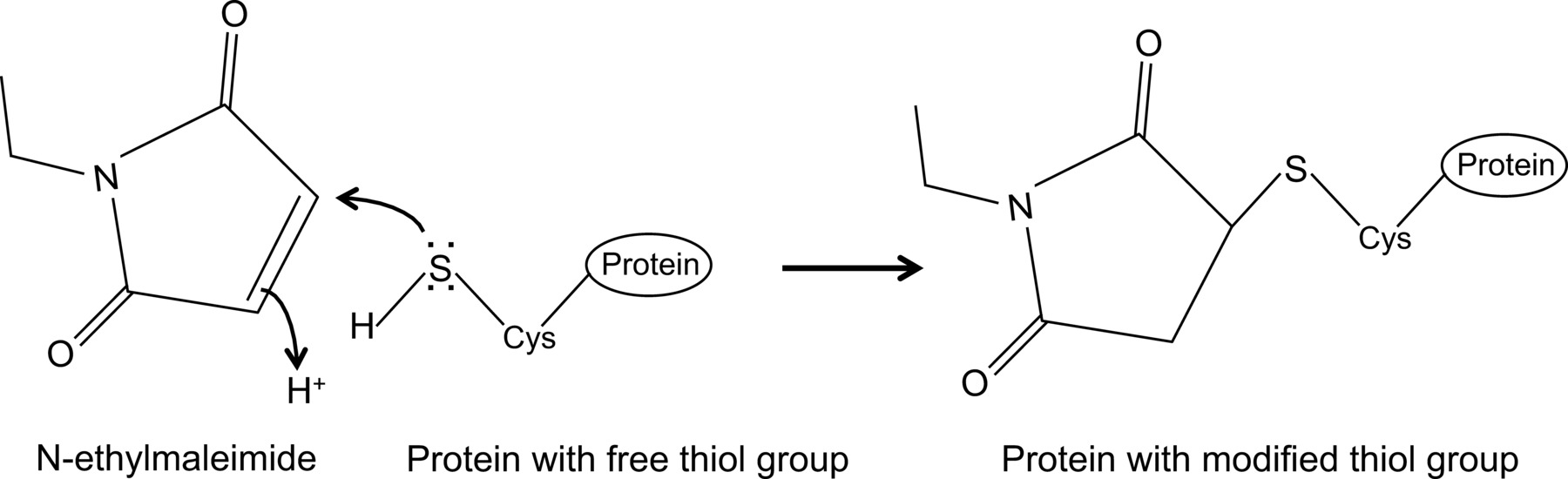
Figur 1:. Irreversible modifikasjon av frie tiolgrupper av N-etylmaleimid Vennligst klikk her for å se en større versjon av dette tallet.

Figur 2:. Mx1 samhandler med NP Western blot analyse av en co-immunoprecipitation eksperiment med to prøver: en der både Mx1 og NP er til stede og en kontroll oppsett der NP protein er fraværende. NP ble immunopresipitert med anti-NP og NP og Mx1 ble visualisert ved hjelp av western-blotting. Dette tallet har blitt endret from 14.

Figur 3: N-etylmaleimid er viktig å detektere NP - MX1 interaksjon Western blot-analyse av et ko-immunoutfelling eksperiment utføres i nærvær eller fravær av N-etylmaleimid.. NP ble immunopresipitert med anti-NP og Mx1 og NP ble visualisert ved hjelp av western-blotting.

Figur 4:. Mx1 samhandler med NP isolert fra infiserte celler eller fra virions Lysater inneholder Mx1 ble kombinert med lysatene inneholder NP fra ulike kilder: en kontroll lysat (ingen vRNPs), transfektert vRNPs, vRNPs fra infiserte celler eller vRNPs isolert fra influensa A virions . Etter blanding lysatene, co-immunopreUtfellingen med anti-NP ble utført og Mx1 og NP ble visualisert ved hjelp av western-blotting.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Å studere interaksjonen mellom antivirale proteiner og deres virale mål er svært viktig å forstå detaljene i den antivirale mekanismen for disse proteinene. Dette kan gi ny innsikt i hvordan virus og deres verter co-utviklet seg og være grunnlag for utvikling av nye antivirale strategier. Den optimaliserte co-immunoprecipitation protokollen beskrevet her gjør det mulig å studere samspillet mellom mus Mx1 protein og dens viral målet, influensa NP protein. Det viktigste aspekt ved denne protokollen er tilsetningen av NEM i lyseringsbuffer, som NP-Mx1 interaksjonen ikke påvises i fravær av NEM (figur 3). Til dags dato er det ikke kjent hvorfor tilstedeværelsen av NEM er viktig å detektere denne interaksjonen. Imidlertid kunne denne protokollen være nyttige for å studere andre svake og / eller forbigående interaksjoner som er avhengig av den stabilisering av spesifikke protein-konformasjoner, spesielt hvis cysteiner som er involvert.
Enviktig begrensning av co-immunoutfellingsstudier analyser generelt er tilgjengeligheten av spesifikke og høy kvalitet antistoffer som gjenkjenner konformasjonelle epitoper i en av interaksjonspartnere med høy affinitet. NP-Mx1 interaksjon kan ikke påvises med vår i huset produsert anti-Mx1 polyklonale antiserum. Dette antiserum immunopresipitater også influensa NP-protein, selv i fravær av Mx1. Videre er anti-NP monoklonalt antistoff som ble brukt, gjenkjenner NP-proteinet av A / Puerto Rico / 8/34 influensastamme, men dessverre er det ikke er egnet til å trekke ned NP av fugleinfluensavirus-stammer. En annen begrensning av denne co-immunoutfelling protokollen er den ikke-spesifikke binding av Mx1 til protein G-perler. Den sistnevnte binding kan overvinnes ved å øke saltkonsentrasjonen i vaskebuffer, og redusere kontakttiden mellom lysat og protein G-perler. I tillegg, å redusere mengden av perler anvendes for hver immunoutfellingReaksjonen fra 50 ul til 25 ul, kan ytterligere redusere ikke-spesifikk binding av Mx1 til disse perler. Generelt er det uønsket rullegardin av kontaminerende proteiner, forårsaket av ikke-spesifikk binding til protein G-perler, kan også reduseres ved andre strategier. For eksempel kan disse proteinene bli fjernet i løpet av en forhånds klart trinn, hvor disse proteinene blir fjernet ved å inkubere lysatet med protein G-perler i fravær av antistoff. De forurensende proteiner blir deretter fjernet sammen med kulene og den forhånds klarede lysat anvendes for ko-immunoutfelling. Denne strategi er kun fordelaktig dersom de forurensende proteiner er forskjellig fra protein (er) under studien. Alternativt kan de uspesifikke bindingssteder på protein G-perler kunne bli blokkert med BSA. Imidlertid er denne strategi bare anbefales hvis kulene først belagt med antistoff, som BSA kan også redusere utfelling av immunkomplekser (dvs. redusert antistoff-binding med de belagte-perler). Tattsammen, er det meget viktig å inkludere egnede kontroller for å utelukke ikke-spesifikk binding av proteiner av interesse for protein G-perler eller til antistoffene benyttes.
Den beskrevne co-immunoprecipitation protokollen kan bli endret for å studere samspillet av Mx1 med NP protein som finnes i et annet miljø, for eksempel i infiserte celler eller i rensede vRNPs. MX1 hemmer ekspresjon av virale proteiner, inkludert NP, under influensavirusinfeksjon 23. Derfor er det teknisk meget vanskelig å studere NP-Mx1 interaksjon i Mx1 transfekterte celler som deretter blir infisert. Likevel kan denne co-immunoutfelling protokoll også bli utført etter å kombinere lysater av Mx1 uttrykkende celler og infiserte celler, noe som gir vellykket påvisning av NP-Mx1 interaksjon (figur 4). Som det kritiske målet for NEM ikke er kjent, ble NEM tilsatt i løpet av lysis av begge cellepopulasjoner. Om ønsket, kan pH-verdienlyseringsbuffer, kan endres. Forsøkene som er beskrevet her, blir utført ved pH 8 (som i Turan et al. 10), men NP-Mx1 co-immunoutfelling ble også med hell utføres med en pH 7,2 lyseringsbuffer. Faktisk en pH-verdi på 7,2 er foretrukket, fordi ved denne pH NEM reagerer utelukkende med frie tiolgrupper, og denne pH-verdi øker også utbyttet av ekstraksjonen MX1-proteinet. I tillegg kan protein G-perler erstattes med protein A-kuler, avhengig av vertsarter fra hvilke brukt antistoffer er avledet fra. Imidlertid er renere resultater oppnådd med protein G-perler. Endelig kan denne protokollen også benyttes for å studere interaksjonen mellom Mx1 og andre influensa-proteiner, for eksempel, PB2 14. I dette tilfellet en V5-epitop merket PB2 ble benyttet, noe som i prinsippet kunne kombineres med kommersielt tilgjengelig anti-V5 affinitet agarose gel.
I fremtidige eksperimenter, kan denne protokollen være verdifullt å identifisere regionene i Mx1 ogNP som er viktige for NP-Mx1 interaksjon. En slik region i Mx1 kan være sløyfe L4, da denne sløyfen er blitt vist å være kritiske for interaksjon mellom MXa og Thogoto virus NP 8,9. Hvis egnede NP-spesifikke antistoffer blir tilgjengelige, vil denne protokollen også tillate å bestemme om den økte følsomheten av fugleinfluensa en belastning for Mx1 korrelerer med en sterkere NP-Mx1 interaksjon eller ikke, noe som kan bidra til å forstå mekanismen for Mx følsomhet. I tillegg interaksjonen mellom Mx1 og komponenter av virus som hører til andre familier enn Orthomyxoviridae, kan også løses ved denne tilpasset co-immunopresipitering protokoll. Til slutt, for videre studier rakne effekten av NEM på NP-Mx1 vil være svært verdifullt for å bedre forstå denne spesifikke interaksjon, men også for å få innsikt i den bredere anvendelser av tilsetning av denne forbindelse under cellelyse og co-immunoutfellingsstudier eksperimenter.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Forfatterne hevder at de ikke har noen konkurrerende økonomiske interesser.
Acknowledgments
Dette arbeidet ble støttet av FWO-Vlaanderen, IOF prosjektet IOF10 / STARTt / 027 og Ghent universitet Spesialstipend BOF12 / GOA / 014.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM high glucose | Gibco | 52100-047 | |
| N-Ethylmaleimide | Sigma | E-3876 | Toxic |
| Igepal CA-630 | Sigma | I-30212 | also known as NP40 |
| Protease inhibitor cocktail | Roche | 11 873 580 001 | |
| anti-NP monoclonal antibody | NIH Biodefense and Emerging Infections Research Resources Repository | NR-4282 | ascites blend of clones A1 and A3 |
| anti-RNP polyclonal serum | NIH Biodefense and Emerging Infections Research Resources Repository | NR-3133 | directed against A/Scotland/840/74 (H3N2) |
| Protein G Sepharose 4FF | GE Healthcare | 17-0618-01 | |
| Hyperfilm ECL 18 x 24 cm | GE Healthcare | 28-9068-36 | |
| ECL western blotting substrate | Pierce | 32106 |
References
- Verhelst, J., Hulpiau, P., Saelens, X. Mx proteins: antiviral gatekeepers that restrain the uninvited. Microbiol Mol Biol Rev. 77 (4), 551-566 (2013).
- Goujon, C., et al. Human MX2 is an interferon-induced post-entry inhibitor of HIV-1 infection. Nature. 502 (7472), 559-562 (2013).
- Kane, M., et al. MX2 is an interferon-induced inhibitor of HIV-1 infection. Nature. 502 (7472), 563-566 (2013).
- Liu, Z., et al. The interferon-inducible MxB protein inhibits HIV-1 infection. Cell Host Microbe. 14 (4), 398-410 (2013).
- Kochs, G., Haller, O. Interferon-induced human MxA GTPase blocks nuclear import of Thogoto virus nucleocapsids. Proc Natl Acad Sci U S A. 96 (5), 2082-2086 (1999).
- Flohr, F., Schneider-Schaulies, S., Haller, O., Kochs, G. The central interactive region of human MxA GTPase is involved in GTPase activation and interaction with viral target structures. FEBS Lett. 463 (1-2), 24-28 (1999).
- Kochs, G., Haller, O. GTP-bound human MxA protein interacts with the nucleocapsids of Thogoto virus (Orthomyxoviridae). J Biol Chem. 274 (7), 4370-4376 (1999).
- Mitchell, P. S., et al. Evolution-guided identification of antiviral specificity determinants in the broadly acting interferon-induced innate immunity factor MxA. Cell Host Microbe. 12 (4), 598-604 (2012).
- Patzina, C., Haller, O., Kochs, G. Structural requirements for the antiviral activity of the human MxA protein against Thogoto and influenza A virus. J Biol Chem. 289 (9), 6020-6027 (2014).
- Turan, K., et al. Nuclear MxA proteins form a complex with influenza virus NP and inhibit the transcription of the engineered influenza virus genome. Nucleic Acids Res. 32 (2), 643-652 (2004).
- Dittmann, J., et al. Influenza A virus strains differ in sensitivity to the antiviral action of Mx-GTPase. J Virol. 82 (7), 3624-3631 (2008).
- Zimmermann, P., Manz, B., Haller, O., Schwemmle, M., Kochs, G. The viral nucleoprotein determines Mx sensitivity of influenza A viruses. J Virol. 85 (16), 8133-8140 (2011).
- Manz, B., et al. Pandemic influenza A viruses escape from restriction by human MxA through adaptive mutations in the nucleoprotein. PLoS Pathog. 9 (3), e1003279 (2013).
- Verhelst, J., Parthoens, E., Schepens, B., Fiers, W., Saelens, X. Interferon-inducible protein Mx1 inhibits influenza virus by interfering with functional viral ribonucleoprotein complex assembly. J Virol. 86 (24), 13445-13455 (2012).
- Brewer, C. F., Riehm, J. P. Evidence for possible nonspecific reactions between N-ethylmaleimide and proteins. Anal Biochem. 18 (2), 248-255 (1967).
- Wu, C. Y., Jeng, K. S., Lai, M. M. The SUMOylation of matrix protein M1 modulates the assembly and morphogenesis of influenza A virus. J Virol. 85 (13), 6618-6628 (2011).
- Chen, Z., Zhou, J., Zhang, Y., Bepler, G. Modulation of the ribonucleotide reductase M1-gemcitabine interaction in vivo by N-ethylmaleimide. Biochem Biophys Res Commun. 413 (2), 383-388 (2011).
- Rennie, M. L., McKelvie, S. A., Bulloch, E. M., Kingston, R. L. Transient dimerization of human MxA promotes GTP hydrolysis, resulting in a mechanical power stroke. Structure. 22 (10), 1433-1445 (2014).
- Gifford, J. L., Walsh, M. P., Vogel, H. J. Structures and metal-ion-binding properties of the Ca2+-binding helix-loop-helix EF-hand motifs. Biochem J. 405 (2), 199-221 (2007).
- Separating Protein with SDS-PAGE. , JoVE. Available from: http://www.jove.com/science-education/5058/separating-protein-with-sds-page (2014).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Pavlovic, J., Haller, O., Staeheli, P. Human and mouse Mx proteins inhibit different steps of the influenza virus multiplication cycle. J Virol. 66 (4), 2564-2569 (1992).



