Introduction
חלבוני התנגדות Myxovirus (MX) הם חלק חשוב של ההגנה החיסונית המולדת נגד פתוגנים נגיפיים. חלבונים אלה הם GTPases כמו dynamin-גדול הנגרמים על ידי הסוג I וסוג III אינטרפרונים. גני Mx המקבילים נמצאים כמעט בכל בעלי חוליות בעותקים אחד או מספר המוצרים והגן לעכב מגוון רחב של וירוסים, כולל Orthomyxoviridae (למשל., וירוס שפעת), Rhabdoviridae (למשל., וירוס stomatitis שלפוחי), Bunyaviridae (למשל. , וירוס LA CROSSE) וRetroviridae (למשל, וירוס כשל חיסוני אנושי-1) 1-4. לא ברור כיצד חלבונים אלה להכיר מגוון רחב כל כך של וירוסים, ללא כל רצף ראשוני משותף לכאורה מוטיבים בוירוסים אלה. ניתוח האינטראקציה של חלבוני MX עם המטרות נגיפיות שלהם, שעלול להיות כרוכות במתחמים מסדר גבוהים יותר עם גורמי תא מארח אחרים, יעזור להבין את המנגנונים המולקולריים tכובע התפתח במרוץ החימוש בין וירוסים ומארחיהם.
האינטראקציה בין חלבוני Mx יונקים ומטרות נגיפיות נחקרה בצורה נרחבת ביותר לMXA האנושי. MXA האדם יכול לעכב את השכפול של וירוסים רבים, כוללים שפעת orthomyxoviruses ווירוס Thogoto. MXA נקשר מתחמי Thogoto ribonucleoprotein הווירוס (vRNPs), ובכך למנוע הכניסה הגרעינית שלהם, וכתוצאה מכך הבלוק של זיהום 5. אינטראקציה זו בין vRNPs וירוס MXA וThogoto הודגמה בניסויי שיתוף שקיעה ושיתוף immunoprecipitation 6-9. איך חלבוני Mx לעכב נגיפי שפעת הוא פחות ברור. אחת בעיות עיקריות הוא שזה לא פשוט להפגין אינטראקציה בין חלבון מושלם וזה מוצר גן השפעת. דו"ח אחד הפגין אינטראקציה בין MXA אדם וחלבון NP בשפעת תאים נגועים בוירוס 10. אינטראקציה זו יכולה להיות מוצגת רק על ידי שיתוף immunoprecipitation אם טופלו התאים עם dithiobis cross-linking מגיב (propionate succinimidyl) לפני תמוגה, המצביע על כך האינטראקציה היא חולפת ו / או חלשה. מחקרים מאוחרים יותר הראו כי רגישות Mx ההפרש של זני שפעת שונים נקבעת על ידי המקור של חלבון NP 11,12. בקנה אחד עם זו, נגיפי שפעת יכולים לברוח בחלק משליטת Mx על ידי מוטציה שאריות ספציפיות בחלבון NP 13. הדבר מצביע על כך היעד העיקרי של וירוסי שפעת למארח MX הוא חלבון NP, ככל הנראה NP התאסף במתחמי vRNP. עם זאת, אף אחד מהמחקרים שנעשה לאחרונה הראה יותר אלה אינטראקציה בין השפעת NP או vRNPs וגם MXA אדם או לעכבר MX1.
לאחרונה הראו, בפעם הראשונה, אינטראקציה בין השפעת NP וחלבון MX1 עכבר עם פרוטוקול מותאם שיתוף immunoprecipitation 14, שתואר כאן בהרחבה. בשיתוף i הכללית,mmunoprecipitation הוא אחת הגישות הנפוצות ביותר בשימוש ביוכימיים לחקור אינטראקציות חלבון-חלבון. טכניקה זו לעתים קרובות עדיפה על טכניקות חלופיות, למשל, שמרי שתי היברידיים, שכן הוא מאפשר לחקור אינטראקציות חלבון-חלבון בסביבתם הטבעית. Co-immunoprecipitation יכול להתבצע על חלבונים הביעו endogenously אם נוגדנים נגד חלבוני עניין זמינים. לחלופין, חלבוני עניין יכולים לבוא לידי ביטוי בתא דרך transfection או זיהום ותג זיקה ניתן להשתמש. בנוסף ליתרונות שהוזכר לעיל, פרוטוקול שיתוף immunoprecipitation המתואר מאפשר זיהוי של אינטראקציות חלבון חלשות ו / או חולפות. המרכיב העיקרי בפרוטוקול מותאם זה הוא התוספת של N-ethylmaleimide (Nem) במאגר תמוגה התא. Nem הוא מגיב אלקילציה שמגיבה עם קבוצות תיאול חופשיות כמו הווה בcysteines, בpH של 6.5-7.5, כדי ליצור thio-אסתר יציבה(איור 1). ב- pH גבוה יותר, nem יכול גם להגיב עם קבוצות אמינו או לעבור הידרוליזה 15. Nem משמש בדרך כלל כדי לחסום קבוצות תיאול חופשיות, על מנת למנוע היווצרות קשר דיסולפיד או לעכב פעילות האנזימטית. לדוגמא, nem משמש לעתים קרובות כדי לחסום אנזימי desumoylating, אשר פרוטאזות ציסטאין. בפרוטוקול שיתוף immunoprecipitation תאר, nem תחילה כלול במאגר תמוגה משום שכבר דווחו כי sumoylation של חלבוני שפעת יכולה להשפיע על האינטראקציה בין חלבונים נגיפיים 16. באופן בלתי צפוי, התוספת של nem הוכיחה להיות מפתח ללתעד את האינטראקציה בין השפעת NP ועכבר MX1 על ידי שיתוף immunoprecipitation. לא ברור מדוע התוספת של nem היא חיונית כדי לזהות את האינטראקציה NP-MX1. אולי האינטראקציה מדי חולפת ו / או חלשה. Nem יכול לייצב את האינטראקציה, למשל, על ידי שמירת קונפורמציה ספציפית של MX1, חלבון נגיפי או אפילו compo שלישי לא ידועnent. כגון השפעה מייצבת של nem נצפתה לפני, למשל, לאינטראקציה בין reductase ribonucleotide M1 וgemcitabine המעכב (F2dC) 17. MX1 וNP שניהם מכילים שאריות ציסטאין מרובות אשר יכול להיות שונה על ידי nem. לדוגמא, מחקר שנערך לאחרונה על ידי רני et al. הוכיח כי stalkless MXA-variant מכיל שלוש שאריות ציסטאין נחשפו ממס שניתן לשנות על ידי iodoacetamide. מוטציה שאריות אלה לserines לא השפיעה על הפעילות האנזימטית של MXA, אבל מנעה צבירה בתיווך דיסולפיד 18. כcysteines אלה נשמרים בMX1, זה מצביע על כך cysteines המקביל בMX1 ניתן לשנות על ידי nem וכקונפורמציה השפעה כזו או מסיסות. בנוסף, nem עשוי להשפיע גם על פעילות GTPase של MX1, שהוא חיוני לפעילות נגד השפעת של MX1, ובכך לייצב את יחסי הגומלין בין MX1 וNP. עם זאת, השפעה ישירה של nem על acti GTPasevity של MX1 הוא סביר, כnem נדרש גם כדי לזהות את יחסי הגומלין בין השפעת NP וGTPase מוטציות לא פעילה של חלבון MX1 14. ברור, יש צורך במחקר נוסף כדי לפענח את ההשפעה של nem על האינטראקציה NP-MX1.
לסיכום, פרוטוקול שיתוף immunoprecipitation המתואר מאפשר לחקור את האינטראקציה בין החלבונים אנטי MX1 והיעד הנגיפי שלה, חלבון NP שפעת. פרוטוקול זה יכול לשמש גם כדי לחקור אינטראקציות חלשות או חולפות אחרות שתלויים בייצוב של תצורות חלבון ספציפיות. אינטראקציה בין חלבונים התלויים בתצורות ספציפיות תוארה קודם לכן, למשל, למחייב חלבוני סידן כגון calmodulin 19. לבסוף, התפקיד מועיל של nem יכול לשמש גם בשיטות אחרות המזהות חלבונים אינטראקציות, כגון מבחני שיתוף שקיעה.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
הערה: פרוטוקול transfection ושיתוף immunoprecipitation הבא נקבע לפורמט צלחת פטרי 9 סנטימטרים. פורמטים אחרים גם אפשריים לאחר שטפס על הפרוטוקול.
1. הכליה העוברית האנושי תאי 293T זריעה (HEK)
- זרעי יום אחד תאי HEK293T לפני transfection 1.2 x 10 6 תאים לכל 9 סנטימטר צלחת פטרי ב 12 מיליליטר של המדיום של הנשר שונה Dulbecco (DMEM) בתוספת 10% עגל בסרום עוברי, L-גלוטמין 2 מ"מ, 0.4 מ"מ Na-פירובט, 0.1 מ"מ חומצות אמינו שאינו חיוניים, 100 U / ml פניצילין ו 0.1 מ"ג / מיליליטר סטרפטומיצין.
- לגדול התאים 16 שעות על 37 מעלות צלזיוס, 5% CO 2.
- ראייה לבדוק את המורפולוגיה ויכולת קיום של התאים עם מיקרוסקופ אור הפוכה לפני transfection. התאים צריכים להיות תת-ומחוברות ליעילות transfection אופטימלית.
2. Transfection סידן-פוספט של תאי HEK293T
הערה: השתמש 0.5-1 מיקרוגרם של pCAXL-NP או פלסמיד pCAXL הריק בשילוב עם 1-3 מיקרוגרם של pCAXL-MX1 לכל צלחת סנטימטר 9. השתמש בכמות שווה של DNA פלסמיד הכולל בכל הדגימות; להתאים עם פלסמיד הריק במידת צורך.
- הכן את מאגרי transfection הבאים:
- הכן טריס-EDTA (TE) עם ריכוזים של 1.0 מ"מ טריס-HCl pH 8.0 ו -0.1 מ"מ EDTA pH 8.0.
- הכן BS / HEPES עם ריכוזים של 25 מ"מ HEPES (5.96 גר '/ ליטר, 4 (2-hydroxyethyl) חומצת -1-piperazineethanesulfonic), 274 מ"מ NaCl (16 גר' / ל '), 10 מ"מ KCl (0.74 גר' / ליטר), 1.5 מ"מ NaHPO 4 · 12H 2 O (0.5 g / L) ודקסטרוז 11.1 מ"מ (L / 2 ז). התאם ל- pH 7.05.
- הכן CaCl 2 / HEPES עם ריכוזים של 1.25 M CaCl 2 · 2H 2 O (183.8 g / L) ו- 125 מ"מ HEPES (29.79 g / L). התאם ל- pH 7.05 עם NaOH.
- לחמם את מאגרי transfection על 37 מעלות צלזיוס לפני השימוש.
- הכן את דגימות פלסמיד על ידי דילול DNA פלסמיד ב600 μl של TE.הכן תערובות אלה בבארות של צלחת 6-גם.
- להוסיף 150 μl של CaCl 2 / HEPES באופן מושכל ירידה לדגימות פלסמיד ומערבבים על ידי pipetting 3 פעמים למעלה ולמטה.
- הכן את פתרון transfection אחר טיפה חכמה הוספת פתרון פלסמיד (TE + DNA + CaCl 2 / HEPES; 750 μl) 750 μl של חיץ BS / HEPES ניתן בצלחת 6-גם טרי. להפיץ את הפתרון באופן שווה על פלסמיד BS החיץ / HEPES המכיל גם המלא.
- לנער את פתרון transfection על שייקר צלחת למשך 90 שניות ב 1000 סל"ד.
- דגירה את התערובת במשך 5 דקות בטמפרטורת חדר.
- מוסיף את פתרון transfection (1.5 מיליליטר) שחרר חכם לתאים. השתמש micropipet P1000 לטפטף פתרון transfection בתאים. לפזר את התערובת על צלחת פטרי 9 סנטימטרים השלם ולנער את הצלחת בעדינות רבה.
- דגירה התאים ב 37 מעלות צלזיוס, 5% CO 2 למשך 6 שעות. לאחר מכן להסיר את המדיום על ידי שאיפה ולהחליף wi מיידה בינונית טרי, מחומם מראש 12 מיליליטר. בעדינות להוסיף בינוני הטרי לתאים כדי למנוע ניתוק תא. לשם כך, מחזיק את קצה pipet נגד הצד השני של הבאר ודחף בעדינות את המדיום.
- דגירה התאים עבור 16 שעות נוספות על 37 מעלות צלזיוס, 5% CO 2.
3. Co-immunoprecipitation
הערה: בצע את שיתוף immunoprecipitation 24 שעות לאחר transfection.
- הכנת מאגר תמוגה מלח הנמוך ולשטוף חיץ מלח גבוה.
- הכן פתרון מניות של 2 M N-ethylmaleimide (Nem) על ידי שקילת הסכום של nem ופירוקה באתנול המוחלט. הכן את פתרון מניות nem הטרי לפני השימוש.
זהירות: nem הוא רעיל מאוד, להכין ולהשתמש בפתרון זה המניה במנדף. - הכן מאגר תמוגה מלח נמוך בריכוזים של 50 מ"מ טריס pH-HCl 8, 150 מ"מ NaCl, חומצת ethylenediaminetetraacetic 5 מ"מ (EDTA), 1% NP40 ומעכבי פרוטאז קוקטייל (לפזר שולחן 1t במאגר תמוגה 50 מיליליטר). להוסיף nem לריכוז סופי של 25 מ"מ (כלומר, לדלל 1:80). שמור על קרח לאחר הוספת מעכבי פרוטאז וnem.
הערה: תמיד להוסיף מעכבי פרוטאז וnem טריים לפני השימוש. - הכן לשטוף חיץ מלח גבוה בריכוזים של 50 מ"מ טריס pH-HCl 8, 500 מ"מ NaCl, 5 מ"מ EDTA וNP40 1%. שים לב שהחיץ לשטוף מלח הגבוה אינו מכיל nem.
- הכן פתרון מניות של 2 M N-ethylmaleimide (Nem) על ידי שקילת הסכום של nem ופירוקה באתנול המוחלט. הכן את פתרון מניות nem הטרי לפני השימוש.
- הכנת lysates תא.
- הסר את המדיום ולשטוף את התאים עם 2 מיליליטר של תמיסת מלח שנאגרו פוספט הקר כקרח (PBS). מאוד בעדינות להוסיף את החיץ לשטוף, כמו תאי HEK293T לנתק בקלות.
- הסר את PBS ולהוסיף 600 μl של חיץ נמוך קר כקרח תמוגה מלח ל9 סנטימטר צלחת פטרי.
- דגירה הצלחות במשך 20 דקות על קרח. לוודא כי הצלחות נשמרות אופקית, כדי להבטיח כיסוי של פני השטח הצלחת עם חיץ תמוגה מלא. נער בעדינות את הצלחות כל 5 דקות.
- לאסוף את lysate התא בmicrocentrifuge 1.5 מיליליטרצינור ו צנטריפוגות במשך 3 דקות ב 4 ° C ו16,000 XG כדי גלולה חלק בלתי הפתיר.
- העברת החלק המסיס, כלומר lysate לתא צינור microcentrifuge טרי 1.5 מ"ל ולשמור על קרח. מייד להמשיך בפרוטוקול שיתוף immunoprecipitation, כדי למנוע ניתוק של חלבוני האינטראקציה. לבצע את כל השלבים עד כמה שניתן על קרח או על 4 מעלות צלזיוס הבאות כדי להגביל את פעילות מפרקי חלבונים בlysates.
- דור של חיסון-מתחמים.
הערה: בשלב זה, החלבון של עניין קשור בנוגדן המתאים. כדי לחקור את האינטראקציה NP-MX1, להשתמש נוגדן חד שבטי עכבר אנטי-NP.- עבור כל דגימה, לערבב 135 μl של lysate עם 2 μl של נוגדנים חד שבטיים אנטי-NP וμl 113 של חיץ הנמוך תמוגה מלח (נפח כולל של 250 μl). אחסן את lysate שנותר ב -20 ° C לניתוח נוסף כגון מערבי סופג, כדי לתעד את רמות הביטוי של Intera ניחששותפי ction בתאי transfected.
הערה: לחלופין, למדוד את ריכוז החלבון של lysate (למשל עם מגיב ברדפורד) ולהשתמש בסכום קבוע של חלבון כולל, למשל, 400 מיקרוגרם, עבור כל lysate. - דגירה תמהיל הנוגדנים lysate במשך 3 שעות על גלגל מסתובב ב 4 מעלות צלזיוס. צעד זה יכול להתארך עד דגירה לילה.
- עבור כל דגימה, לערבב 135 μl של lysate עם 2 μl של נוגדנים חד שבטיים אנטי-NP וμl 113 של חיץ הנמוך תמוגה מלח (נפח כולל של 250 μl). אחסן את lysate שנותר ב -20 ° C לניתוח נוסף כגון מערבי סופג, כדי לתעד את רמות הביטוי של Intera ניחששותפי ction בתאי transfected.
- הכנת חרוזים חלבון G.
הערה: חרוזים החלבון G נשלחים ומאוחסנים ב -20% אתנול לשימור. חרוז-slurry בדרך כלל מורכב מחרוזי 50% וחרוזים האלה צריכים לשטוף לפני שהם משמשים לimmunoprecipitate חיסוניים-מתחמים.- השתמש 50 μl של חרוזים, כלומר, של חרוז-slurry 100 μl, עבור כל דגימה. שטוף את הסכום של חרוזים הנדרשים לכל הדגימות בassay שיתוף immunoprecipitation בצינור אחד. חותך את הקצה של קצה פיפטה 1 מיליליטר כדי להקל pipetting של חרוז-התרחיף.
- צנטריפוגה חרוז-slurry החלבון G ב 8000 xg ו- 4 מעלות צלזיוס למשך 30 שניות. הסר את פתרון אתנול ולהוסיף נפח שווה של חיץ תמוגה מלח נמוך. צנטריפוגה חלבון חרוז-slurry G ב 8000 XG ו -4 מעלות צלזיוס למשך 30 שניות ולהסיר את supernatant בעדינות. חזור על שלב זה לשטוף 3 פעמים.
הערה: מאגר תמוגה מלח הנמוך המשמש ללשטוף את החרוזים לא צריך לכלול מעכבי פרוטאז או nem. - לאמוד את היקף חרוזים חלבון G ולהוסיף נפח שווה של חיץ תמוגה מלח נמוך כדי להפוך 50% חרוז-זבל חדש במאגר תמוגה מלח נמוך.
- עבור כל דגימה, העברת חרוז-slurry 100 μl בצינור microcentrifuge טרי 1.5 מיליליטר ולאחסן על קרח עד לשימוש. להיות זהיר כדי resuspend חרוז-slurry לפני החלוקה, כחרוזים אלה משקעים במהירות לחלק התחתון של הצינור.
- Immunoprecipitation של חיסון-המתחמים ידי חלבון G חרוזים וelution.
- לפני השימוש בחרוזי החלבון G לimmunoprecipitation, צנטריפוגה כל הצינורות 30 שניות ב 8000 XG ו -4 ° C ולוודא על ידי בדיקה ויזואלית שיש כמות שווה של חרוזים נוכחת בכל הדגימות. אם יש צורך להתאים את כמות חרוזים בחלק מהדגימות ו צנטריפוגות שוב. מחק את supernatants. היזהר שלא להפריע את חרוזים חלבון G pelleted.
- בקצרה צנטריפוגות חיסוניים-המתחמים (כלומר., Lysates עם נוגדן, 250 μl) למשך 30 שניות ב 8000 XG ו4 ° C כדי לאסוף את המדגם המלא בחלק התחתון של הצינור. העבר את החיסון-הקומפלקסים לחרוזי חלבון G (50 μl).
- דגירה 60 דקות על גלגל מסתובב ב 4 מעלות צלזיוס. אל דגירה מתחמים חיסוניים אלה דקות ארוכות מ -75 עם חרוזים כדי להפחית מחייב ספציפי של חלבונים לחרוזי חלבון G.
- צנטריפוגה חרוזים חלבון G (עם חיסון מתחמים מאוגדים) למשך 30 שניות ב 8000 XG ו4 ° C ולהסיר supernatants. היזהר שלא להפריע את חרוזים חלבון G pelleted. אופציונאלי: לאחסן זה supernatants על 4 מעלות צלזיוס או -20 ° C לניתוח מאוחר יותר,לדוגמא, כדי לאמוד את כמות החלבון מאוגד.
- שטוף את חרוזי חלבון G לכ 5 דקות עם 900 μl של חיץ תמוגה מלח גבוה. ודא שהחרוזים הם resuspended לחלוטין בחיץ לשטוף שטיפה אופטימלית. צנטריפוגה חלבון G חרוזים למשך 30 שניות ב 8000 XG ו4 ° C וזורקים את supernatants. חזור על שלב זה לשטוף 4 פעמים. היזהר שלא להפריע את חרוזים החלבון G pelleted כדי למנוע אובדן של חומר immunoprecipitated.
- לאחר השלב לשטוף האחרון, להוסיף 50 μl של חיץ מדגם Laemmli 2x לחרוזים ולחמם את ההשעיה למשך 10 דקות ב 95 מעלות צלזיוס לelute חלבונים (במשותף) immunoprecipitated.
- הכן 10 מיליליטר של חיץ 6x Laemmli עם 1 גרם של סולפט dodecyl נתרן, 3.5 מיליליטר של גליצרול, 3.5 מיליליטר של 1 M טריס- HCl pH 6.8 ו 420 μl של β-mercaptoethanol. להסתגל להיקף כולל של 10 מיליליטר על ידי הוספת מים מזוקקים. לדלל 3 פעמים במים מזוקקים כדי להשיג חיץ 2x Laemmli.
זהירות: &# 946; -mercaptoethanol הוא רעיל, להכין ולהשתמש חיץ Laemmli במנדף.
- הכן 10 מיליליטר של חיץ 6x Laemmli עם 1 גרם של סולפט dodecyl נתרן, 3.5 מיליליטר של גליצרול, 3.5 מיליליטר של 1 M טריס- HCl pH 6.8 ו 420 μl של β-mercaptoethanol. להסתגל להיקף כולל של 10 מיליליטר על ידי הוספת מים מזוקקים. לדלל 3 פעמים במים מזוקקים כדי להשיג חיץ 2x Laemmli.
- לאחר חימום, צנטריפוגות חלבון G חרוזים למשך 30 שניות ב 8000 XG ולאחסן הדגימות ב 4 ° C (לטווח קצר) או -20 ° C (לטווח ארוך).
4. ניתוח (שיתוף) החלבונים immunoprecipitated
- דמיינו את החלבונים המצויים בlysate התא וeluate של שיתוף immunoprecipitation על ידי SDS-PAGE 20 ומערביים סופג 21,22. בדרך כלל נטען במחצית eluate Laemmli על ג'ל. היזהר שלא להפריע את חרוזים חלבון G pelleted כאשר לוקחים דגימות לטעינת ג'ל. MX1 וביטוי NP נחשפו עם אנטי-MX1 ונוגדן אנטי-NP, בהתאמה 14. הלהקות התגלו עם chemiluminescence מבוססת HRP ומפתחי סרט X-ray.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
N-ethylmaleimide היא תרכובת אורגנית שיכול לשמש כדי לשנות באופן בלתי הפיך קבוצות תיאול חופשיות, למשל לעכב פרוטאזות ציסטאין (איור 1).
החלבון אנטי MX1 מעכב שפעת שכפול נגיף על ידי אינטראקציה עם nucleoprotein ויראלי. פרוטוקול שיתוף immunoprecipitation מותאם המתואר כאן מאפשר ללמוד אינטראקציה NP-MX1 זה. תאי HEK293T היו transfected עם וקטורי ביטוי לחלבון MX1 אנטי בהעדר או הנוכחות של חלבון NP שפעת. בשלב הבא, חלבון NP היה משך למטה מסך lysates תא עם נוגדנים חד שבטיים NP-ספציפיים. איור 2 מראה כי חלבון MX1 הוא רק בנוכחות של NP-הביע שיתוף immunoprecipitated שיתוף. שיתוף immunoprecipitation ספציפי האפשרי של MX1 בהעדר NP נגרמים על ידי שני נפתחים ספציפי של חלבון MX1 על ידי הנוגדן אנטי-NP או על ידי קשירה ספציפיות של MX1 לחלבון G חרוזים. לכן, תמיד כולל שליטה שלילית להעריך שיתוף immunoprecipitation ספציפי זה. איור 3 מראה כי האינטראקציה NP-MX1 יכולה להתגלות רק בנוכחות של nem. בניסוי זה, מחייב ספציפי של MX1 לחרוזי חלבון G הוערך עם תגובת שיתוף immunoprecipitation שליטה בהעדר הנוגדנים נגד NP.
גם פרוטוקול זה יכול לשמש כדי לחקור את האינטראקציה בין MX1 וחלבון NP השפעת מבודד מהתאים נגועים או מvirions. עבור יישום זה, הפרוטוקול הנ"ל עובד מעט על ידי שילוב של lysates MX1 לבטא בתאים עם lysates המכיל את החלבון הנגיפי NP לפני תחילת פרוטוקול שיתוף immunoprecipitation. איור 4 מראה את שיתוף immunoprecipitation של MX1 עם NP מבודד מתאי transfected, תאים נגועים או virions.
לסיכום, תוצאות אלו מראות כי prot שיתוף immunoprecipitation זהocol יכול לשמש כדי לחקור את האינטראקציה בין חלבון אנטי הנגיפי והיעד שלה.
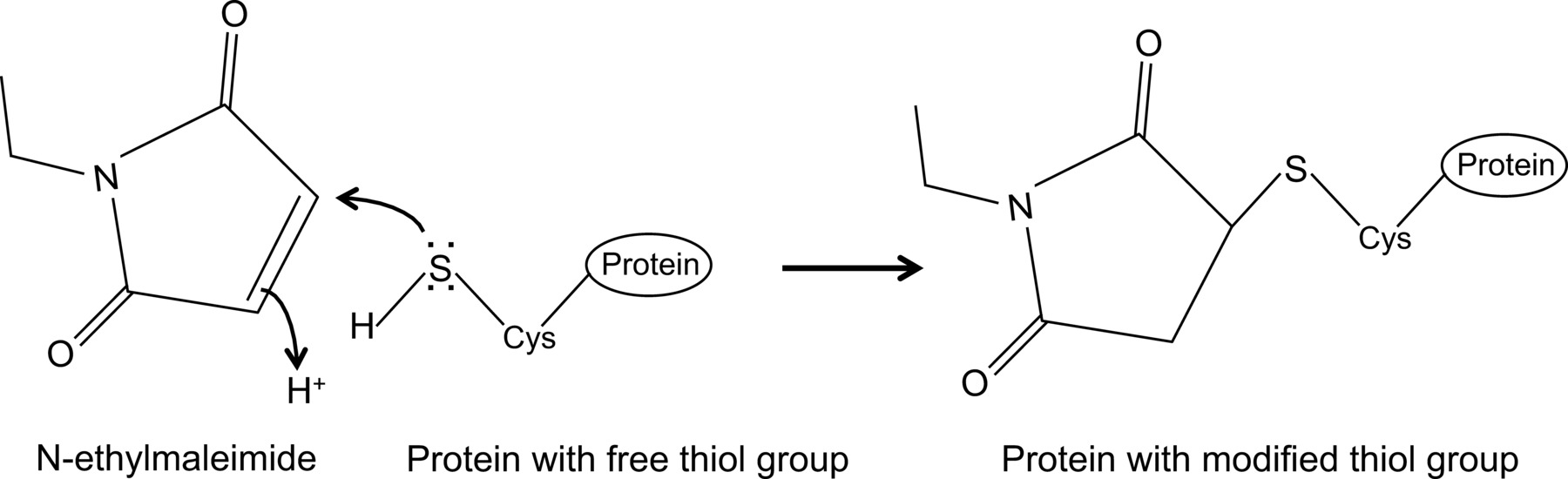
איור 1:. שינוי בלתי הפיך של קבוצות תיאול בחינם על ידי N-ethylmaleimide אנא לחץ כאן כדי לצפות בגרסה גדולה יותר של דמות זו.

איור 2:. MX1 אינטראקציה עם NP ניתוח מערבי כתם של ניסוי שיתוף immunoprecipitation עם שתי דוגמאות: אחד שבו שניהם MX1 וNP נוכחים והתקנת שליטה אחד שבו חלבון NP נעדר. NP היה immunoprecipitated עם אנטי-NP וNP וMX1 היו דמיין ידי מערבי סופג. נתון זה כבר שונה from 14.

איור 3: N-ethylmaleimide חשוב לזהות את NP - אינטראקציה MX1 ניתוח כתם מערבי של ניסוי שיתוף immunoprecipitation בוצע בנוכחותו או היעדריו של N-ethylmaleimide.. NP היה immunoprecipitated עם אנטי-NP וMX1 וNP היו דמיין ידי מערבי סופג.

איור 4:. MX1 אינטראקציה עם NP מבודד מהתאים נגועים או מvirions Lysates מכילה MX1 הייתה בשילוב עם lysates מכיל NP ממקורות שונים: lysate ביקורת (ללא vRNPs), transfected vRNPs, vRNPs מהתאים נגועים או vRNPs המבודדים מvirions שפעת . לאחר ערבוב lysates שיתוף immunopre,cipitation עם אנטי-NP בוצע וMX1 וNP היו דמיינו ידי מערבי סופג.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
לומד את האינטראקציה בין חלבונים אנטי ויראלי והמטרות שלהם הוא מאוד חשוב להבין את פרטי המנגנון אנטי של החלבונים האלה. זה יכול לתת לי תובנות חדשות על איך וירוסים ומארחיהם התפתחו יחד ולהיות הבסיס לפיתוח אסטרטגיות אנטי חדשות. פרוטוקול שיתוף immunoprecipitation מותאם המתואר כאן מאפשר לחקור את האינטראקציה בין חלבוני MX1 העכבר והיעד הנגיפי שלה, חלבון NP שפעת. ההיבט החשוב ביותר של פרוטוקול זה הוא התוספת של nem במאגר תמוגה, כאינטראקצית NP-MX1 היא בלתי ניתנת לגילוי בהעדר nem (איור 3). עד כה, לא ידוע למה הנוכחות של nem היא חיונית כדי לזהות אינטראקציה זו. עם זאת, פרוטוקול זה יכול להיות שימושי כדי לחקור אינטראקציות חלשות ו / או זמניות אחרות אשר תלוי בייצוב של תצורות חלבון מסוימות, במיוחד אם cysteines מעורב.
מגבלה חשובה של מבחני שיתוף immunoprecipitation בכלל היא הזמינות של נוגדנים ספציפיים ואיכות גבוהות שיכירו epitopes קונפורמציה באחד מבני זוג האינטראקציה עם זיקה גבוהה. האינטראקציה NP-MX1 לא יכולה להיות הפגינה עם בבית שלנו מיוצר antiserum polyclonal אנטי-MX1. antiserum זה גם immunoprecipitates חלבון NP שפעת, גם בהיעדרו של MX1. יתר על כן, הנוגדן חד שבטי אנטי-NP ששימש, מזהה את חלבון NP של זן השפעת / 8/34 / פורטו ריקו, אבל למרבה הצער זה לא מתאים לנפתח NP של זני וירוס שפעת עופות. מגבלה נוספת של פרוטוקול שיתוף immunoprecipitation זה לא ספציפי מחייב של MX1 לחרוזי חלבון G. אחרון כריכה ניתן להתגבר על ידי הגדלת ריכוז המלח במאגר לשטוף וצמצום זמן המגע בין lysate והחלבון G חרוזים. בנוסף, הפחתת הכמות של חרוזים המשמשת לכל immunoprecipitationתגובה של 50 μl 25 μl, יכולה להקטין עוד יותר ספציפי מחייב של MX1 לחרוזים האלה. באופן כללי, נפתחים לא מכוון של חלבונים מזהמים, הנגרמים על ידי ספציפי מחייב את חרוזים חלבון G, יכול גם להיות מופחת על ידי אסטרטגיות אחרות. לדוגמא, ניתן להסיר את החלבונים האלה בשלב טרום-ברור, שבו חלבונים אלה יוסרו על ידי דוגרים lysate עם חרוזים חלבון G בהעדר הנוגדנים. לאחר מכן חלבוני זיהום יוסרו יחד עם חרוזים וlysate-פינה מראש משמש לשיתוף immunoprecipitation. אסטרטגיה זו היא רק יתרון אם החלבונים מזהמים שונים מהחלבון (ים) תחת מחקר. לחלופין, אתרי מחייב נוקבים בחלבון G חרוזים יכולים להיות חסומים בBSA. עם זאת, אסטרטגיה זו מומלצת רק אם חרוזים הם מצופים ראשון עם הנוגדן, כמו BSA יכול גם להפחית את המשקעים של חיסון-מתחמים (כלומר, נוגדנים מופחתים כריכה במצופים חרוזים). לקחתייחד, זה מאוד חשוב לכלול בקרות נאותות להוציא ספציפי מחייב של החלבונים המעניינים את חרוזים חלבון G או לנוגדנים המשמשים.
פרוטוקול שיתוף immunoprecipitation תאר יכול להיות שונה כדי לחקור את האינטראקציה של MX1 עם חלבון NP נוכח בסביבה שונה, למשל, בתאים נגועים או בvRNPs המטוהר. MX1 מעכב את הביטוי של חלבונים נגיפיים, כולל NP, במהלך זיהום בנגיף שפעת 23. לכן, מבחינה טכנית קשה מאוד ללמוד את האינטראקציה NP-MX1 בתאי MX1 transfected שנגועים לאחר מכן. ובכל זאת, פרוטוקול שיתוף immunoprecipitation זה יכול גם להתבצע לאחר שילוב lysates של MX1 לבטא בתאים ותאים נגועים, המאפשר זיהוי מוצלח של האינטראקציה NP-MX1 (איור 4). כיעד החיוני של nem אינו ידוע, nem נוספו במהלך תמוגה של שני אוכלוסיות התאים. אם תרצה, את ה- pH שלניתן לשנות מאגר תמוגה. הניסויים שתוארו כאן מבוצעים ב- pH 8 (כמו בטורעאן et al. 10), אבל שיתוף immunoprecipitation NP-MX1 בוצע בהצלחה גם עם מאגר תמוגה pH 7.2. למעשה pH של 7.2 עדיף, כי בnem pH זה מגיב אך ורק עם קבוצות תיאול חופשיות וpH זה גם מגדיל את תשואת המיצוי של חלבון MX1. בנוסף, ניתן יהיה להחליף את חרוזים חלבון G על ידי חרוזים חלבון, תלוי במארח-המינים שממנו הנוגדנים המשמשים נגזרים. עם זאת, תוצאות נקיות מתקבלות עם חרוזים החלבון G. לבסוף, פרוטוקול זה יכול לשמש גם כדי לחקור את האינטראקציה בין MX1 וחלבוני שפעת אחרים, למשל, 14 PB2. במקרה זה epitope V5 מתויג PB2 שימש, אשר יכול, בעיקרון, בשילוב עם ג'ל agarose אנטי-V5 זמין מסחרי זיקה.
בניסויים עתידיים, פרוטוקול זה יכול להיות בעל ערך כדי לזהות את האזורים בMX1 וNP שחשובים לאינטראקצית NP-MX1. כגון אזור אחד בMX1 יכול להיות L4 לולאה, כמו לולאה זה הוכח להיות קריטי לאינטראקציה בין MXA ווירוס Thogoto NP 8,9. אם נוגדני NP-ספציפיים מתאימים הופכים לזמינים, פרוטוקול זה יאפשר גם כדי לקבוע אם הרגישות המוגברת של זני שפעת עופות לMX1 בקורלציה עם אינטראקציה חזקה NP-MX1 או לא, מה שיכול לעזור להבין את המנגנון של רגישות Mx. בנוסף, האינטראקציה בין MX1 ורכיבים של וירוסים השייכים למשפחות אחרות מאשר Orthomyxoviridae, יכולה גם להיות מטופל על ידי פרוטוקול שיתוף immunoprecipitation מותאם זה. לבסוף, מחקרים נוספים על מנת לפענח את ההשפעה של nem על NP-MX1 יהיה יקר מאוד להבין אינטראקציה ספציפית זה טוב יותר, אלא גם כדי לקבל תובנה ביישומים רחבים יותר של התוספת של תרכובת זו במהלך ניסויי תמוגה תא ושיתוף immunoprecipitation.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
המחברים מצהירים שאין להם אינטרסים כלכליים מתחרים.
Acknowledgments
עבודה זו נתמכה על ידי FWO-Vlaanderen, פרויקט צבא IOF10 / StarTT / 027 ואוניברסיטת גנט מיוחדת מענק מחקר BOF12 / גואה / 014.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM high glucose | Gibco | 52100-047 | |
| N-Ethylmaleimide | Sigma | E-3876 | Toxic |
| Igepal CA-630 | Sigma | I-30212 | also known as NP40 |
| Protease inhibitor cocktail | Roche | 11 873 580 001 | |
| anti-NP monoclonal antibody | NIH Biodefense and Emerging Infections Research Resources Repository | NR-4282 | ascites blend of clones A1 and A3 |
| anti-RNP polyclonal serum | NIH Biodefense and Emerging Infections Research Resources Repository | NR-3133 | directed against A/Scotland/840/74 (H3N2) |
| Protein G Sepharose 4FF | GE Healthcare | 17-0618-01 | |
| Hyperfilm ECL 18 x 24 cm | GE Healthcare | 28-9068-36 | |
| ECL western blotting substrate | Pierce | 32106 |
References
- Verhelst, J., Hulpiau, P., Saelens, X. Mx proteins: antiviral gatekeepers that restrain the uninvited. Microbiol Mol Biol Rev. 77 (4), 551-566 (2013).
- Goujon, C., et al. Human MX2 is an interferon-induced post-entry inhibitor of HIV-1 infection. Nature. 502 (7472), 559-562 (2013).
- Kane, M., et al. MX2 is an interferon-induced inhibitor of HIV-1 infection. Nature. 502 (7472), 563-566 (2013).
- Liu, Z., et al. The interferon-inducible MxB protein inhibits HIV-1 infection. Cell Host Microbe. 14 (4), 398-410 (2013).
- Kochs, G., Haller, O. Interferon-induced human MxA GTPase blocks nuclear import of Thogoto virus nucleocapsids. Proc Natl Acad Sci U S A. 96 (5), 2082-2086 (1999).
- Flohr, F., Schneider-Schaulies, S., Haller, O., Kochs, G. The central interactive region of human MxA GTPase is involved in GTPase activation and interaction with viral target structures. FEBS Lett. 463 (1-2), 24-28 (1999).
- Kochs, G., Haller, O. GTP-bound human MxA protein interacts with the nucleocapsids of Thogoto virus (Orthomyxoviridae). J Biol Chem. 274 (7), 4370-4376 (1999).
- Mitchell, P. S., et al. Evolution-guided identification of antiviral specificity determinants in the broadly acting interferon-induced innate immunity factor MxA. Cell Host Microbe. 12 (4), 598-604 (2012).
- Patzina, C., Haller, O., Kochs, G. Structural requirements for the antiviral activity of the human MxA protein against Thogoto and influenza A virus. J Biol Chem. 289 (9), 6020-6027 (2014).
- Turan, K., et al. Nuclear MxA proteins form a complex with influenza virus NP and inhibit the transcription of the engineered influenza virus genome. Nucleic Acids Res. 32 (2), 643-652 (2004).
- Dittmann, J., et al. Influenza A virus strains differ in sensitivity to the antiviral action of Mx-GTPase. J Virol. 82 (7), 3624-3631 (2008).
- Zimmermann, P., Manz, B., Haller, O., Schwemmle, M., Kochs, G. The viral nucleoprotein determines Mx sensitivity of influenza A viruses. J Virol. 85 (16), 8133-8140 (2011).
- Manz, B., et al. Pandemic influenza A viruses escape from restriction by human MxA through adaptive mutations in the nucleoprotein. PLoS Pathog. 9 (3), e1003279 (2013).
- Verhelst, J., Parthoens, E., Schepens, B., Fiers, W., Saelens, X. Interferon-inducible protein Mx1 inhibits influenza virus by interfering with functional viral ribonucleoprotein complex assembly. J Virol. 86 (24), 13445-13455 (2012).
- Brewer, C. F., Riehm, J. P. Evidence for possible nonspecific reactions between N-ethylmaleimide and proteins. Anal Biochem. 18 (2), 248-255 (1967).
- Wu, C. Y., Jeng, K. S., Lai, M. M. The SUMOylation of matrix protein M1 modulates the assembly and morphogenesis of influenza A virus. J Virol. 85 (13), 6618-6628 (2011).
- Chen, Z., Zhou, J., Zhang, Y., Bepler, G. Modulation of the ribonucleotide reductase M1-gemcitabine interaction in vivo by N-ethylmaleimide. Biochem Biophys Res Commun. 413 (2), 383-388 (2011).
- Rennie, M. L., McKelvie, S. A., Bulloch, E. M., Kingston, R. L. Transient dimerization of human MxA promotes GTP hydrolysis, resulting in a mechanical power stroke. Structure. 22 (10), 1433-1445 (2014).
- Gifford, J. L., Walsh, M. P., Vogel, H. J. Structures and metal-ion-binding properties of the Ca2+-binding helix-loop-helix EF-hand motifs. Biochem J. 405 (2), 199-221 (2007).
- Separating Protein with SDS-PAGE. , JoVE. Available from: http://www.jove.com/science-education/5058/separating-protein-with-sds-page (2014).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Pavlovic, J., Haller, O., Staeheli, P. Human and mouse Mx proteins inhibit different steps of the influenza virus multiplication cycle. J Virol. 66 (4), 2564-2569 (1992).



