Introduction
Myxovirus сопротивление (Mx) белки являются важной частью врожденной иммунной защиты против вирусных патогенов. Эти белки являются крупные динамин, как GTPases, индуцированные типа I и типа III интерфероны. Соответствующие гены Mx присутствуют почти во всех позвоночных, в одной или нескольких копий и их генные продукты ингибируют широкий спектр вирусов, включая Orthomyxoviridae (например., Вируса гриппа), Rhabdoviridae (например., Вируса везикулярного стоматита), буньявирусов (например. Ла вирус Кросс) и Retroviridae (например, вирус иммунодефицита человека-1) 1-4. Неясно, как эти белки признать такой широкий спектр вирусов, без всякой видимой поделился первичная последовательность мотивов в этих вирусов. Анализируя взаимодействие МХ белков с вирусной целей, потенциально с участием высшего порядка комплексы с другими факторами клеток хозяина, поможет понять молекулярные механизмы тшляпа развивались в гонке вооружений между вирусами и их хозяев.
Взаимодействие между млекопитающих белков Мх и вирусных целей была изучена наиболее широко для человека МхА. Человека MxA могут ингибировать репликацию многих вирусов, в том числе ортомиксовирусы гриппа А и вируса Thogoto. MxA связывает Thogoto вируса рибонуклеопротеидных комплексы (vRNPs), тем самым предотвращая их проникновение в ядро, что приводит к блоку инфекции 5. Это взаимодействие между МхА и Thogoto вирусных vRNPs было продемонстрировано совместное отстаивание и со-иммунопреципитации экспериментов 6-9. Как Mx белки препятствуют вирусов гриппа менее ясна. Одна из основных проблем является то, что это не просто продемонстрировать взаимодействие между белком Mx и гена гриппа продукта. Один доклад показал, взаимодействие человеческого МхА и белка НП в вирус гриппа А инфицированных клеток 10. Это взаимодействие может быть показано только путем совместного immunoprecipitation если клетки были обработаны сшивающего реагента дитиобис (сукцинимидилпропионат) до лизиса, предполагая, что взаимодействие является временным и / или слабым. Более поздние исследования показали, что дифференциальный Mx чувствительность различных штаммов гриппа А определяется по происхождению белка NP 11,12. В соответствии с этим, вирусы гриппа А, может частично уйти от Control MX путем мутации конкретных остатков в белке НП 13. Это говорит о том, что основной мишенью вирусов гриппа для принимающей Мх белок NP, скорее всего, NP собраны в vRNP комплексов. Тем не менее, ни один из этих более поздних исследованиях не было выявлено взаимодействия между гриппа НП или vRNPs и либо человека МхА или мыши MX1.
Недавно мы показали, впервые, взаимодействие между гриппом НП и MX1 белка мыши с оптимизированным протокол о сотрудничестве иммунопреципитации 14, который описан здесь подробно. В общем, со-Immunoprecipitation является одним из наиболее часто используемых биохимических методов, чтобы исследовать белок-белковых взаимодействий. Этот метод часто предпочтительнее, чем альтернативные методы, например дрожжи две гибридные, так как он позволяет исследовать белок-белковых взаимодействий в их естественной среде обитания. Со-иммунопреципитации можно проводить на эндогенно экспрессируемых белков, если антитела против белков, представляющих интерес доступны. Кроме того, белки интерес может быть выражен в клетке через трансфекции или инфекции, и аффинная метка может быть использована. В дополнение к вышеупомянутым преимуществам, описанным протоколом совместно иммунопреципитации позволяет детектировать слабые и / или переходных белковых взаимодействий. Основным компонентом в этом оптимизированного протокола является добавление N-этилмалеимида (NEM) в буфере для лизиса клеток. NEM представляет собой алкилирующий реагент, который реагирует с свободных тиоловых групп, таких как, присутствующего в цистеинов, при рН 6,5-7,5, с образованием стабильной тио-эфир(Фигура 1). При более высоких рН, NEM может также реагировать с аминогруппами или подвергаются гидролизу 15. NEM, как правило, используется, чтобы блокировать свободные тиольные группы, для того, чтобы предотвратить образование дисульфидной связью или ингибировать ферментативную активность. Например, NEM часто используется, чтобы блокировать desumoylating ферменты, которые цистеиновых протеаз. В описываемом протокола совместно иммунопреципитации, NEM был изначально включен в буфере для лизиса, потому что было сообщено, что SUMOylation белков гриппа может влиять на взаимодействие между вирусными белками 16. Неожиданно добавление NEM оказалась ключом к документу взаимодействие гриппа NP и мыши MX1 путем совместного иммунопреципитации. Непонятно, почему добавление NEM имеет решающее значение для выявления взаимодействия NP-MX1. Возможно взаимодействие слишком скоротечна и / или слабый. NEM может стабилизировать взаимодействие, например, путем сохранения специфической конформации MX1 и, вирусный белок или даже неизвестное третье компонента. Такое стабилизирующее действие NEM наблюдалось раньше, например, для взаимодействия рибонуклеотидредуктазы M1 и его ингибитора гемцитабина (F2dC) 17. MX1 и NP оба содержат несколько остатков цистеина, которые могут быть изменены NEM. Например, недавнее исследование Ренни и др. Продемонстрировали, что stalkless MxA-вариант содержит три растворителя подвергаются остатки цистеина, которые могут быть изменены иодацетамидом. Мутирует эти остатки серинов не влияет на ферментативную активность МхА, но предотвратить дисульфида-опосредованной агрегации 18. Поскольку эти цистеина сохраняется в классе MX1, это говорит о том, что аналогичные цистеина в классе MX1 могут быть изменены NEM и, таким образом повлиять на его конформации или растворимости. Кроме того, NEM также может влиять на активность ГТФ в MX1, что очень важно для борьбы с гриппом активности MX1, и тем самым стабилизировать взаимодействие между MX1 и NP. Тем не менее, прямое воздействие NEM на ГТФ ACTiVity MX1 и маловероятно, так как NEM также необходимо определить взаимодействие между гриппа НП и GTPase неактивные мутанты белка MX1 14. Очевидно, что необходимы дополнительные исследования, чтобы разгадать эффект NEM о взаимодействии NP-MX1.
Таким образом, описанные протокол о сотрудничестве иммунопреципитацию позволяет изучать взаимодействие между противовирусного белка MX1 и его вирусной цели, гриппа НП белка. Этот протокол также может быть использован для изучения других слабых или переходные взаимодействия, которые зависят от стабилизации конкретных конформации белков. Белок-белкового взаимодействия, что зависит от конкретных конформаций были описаны ранее, например, в кальций-связывающих белков, таких как кальмодулин 19. Наконец, полезно роль NEM также могут быть использованы в других способах, которые обнаруживают белок-белковых взаимодействий, такие как со-осаждения анализов.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Примечание: Следующий протокол трансфекции и со-иммунопреципитации создается на 9 см Петри формате блюдо. Другие форматы также возможны после масштабирования протокол.
1. Посев в почках человеческого эмбриона (НЕК) 293Т
- Семени клетки HEK293T один день до трансфекции в 1,2 × 10 6 клеток на 9 см чашки Петри в 12 мл среды Дульбекко, модифицированной Игла (DMEM) с добавлением 10% фетальной телячьей сыворотки, 2 мМ L-глутамина, 0,4 мМ Na-пируват, 0,1 мМ заменимых аминокислот, 100 ед / мл пенициллина и 0,1 мг / мл стрептомицина.
- Растут ячеек 16 ч при 37 ° С и 5% СО 2.
- Осмотрите морфологию и жизнеспособность клеток с перевернутой оптического микроскопа до трансфекции. Клетки должны быть суб-сливающийся для оптимальной эффективности трансфекции.
2. кальций-фосфатных Трансфекцию HEK293T клеток
Заметка: Использование 0,5-1 мкг pCAXL-NP или пустым pCAXL плазмиды в сочетании с 1-3 мкг pCAXL-MX1 в 9 см чашку. Использование равное количество общей плазмидной ДНК во всех пробах; наладить с пустой плазмидой, если это необходимо.
- Подготовьте следующие трансфекции буферы:
- Подготовка Трис-ЭДТА (ТЭ) с концентрацией 1,0 мМ Tris-HCl рН 8,0 и 0,1 мМ ЭДТА, рН 8,0.
- Подготовка BS / HEPES с концентрацией 25 мМ HEPES (5,96 г / л, 4- (2-гидроксиэтил) -1-пиперазинэтансульфонова кислота), 274 мМ NaCl (16 г / л), 10 мМ КСl (0,74 г / л), 1,5 мМ NaHPO 4 · 12H 2 O (0,5 г / л) и 11,1 мМ декстрозы (2 г / л). Отрегулируйте рН до 7,05.
- Подготовка CaCl 2 / HEPES с концентрацией 1,25 М CaCl 2 · 2H 2 O (183,8 г / л) и 125 мМ HEPES (29,79 г / л). Регулировка рН до 7,05 с помощью NaOH.
- Теплый трансфекции буферов при 37 ° С перед использованием.
- Подготовка образцов плазмиды путем разбавления плазмидной ДНК в 600 мкл ТЕ.Подготовка этих смесей в лунки 6-луночного планшета с.
- Добавить 150 мкл CaCl 2 / HEPES в каплям способом образцов плазмиды и перемешать с помощью пипетки 3 раза вверх и вниз.
- Подготовка трансфекции решение по каплям добавлением плазмиды раствора (TE + ДНК + CaCl 2 / HEPES; 750 мкл) в 750 мкл БС / HEPES буфере, предусмотренных в свежем 6-луночный планшет. Распределите раствора плазмиды, равномерно в течение полного лунку, содержащую BS / HEPES буфера.
- Встряхнуть трансфекции решение на шейкере в течение 90 секунд при 1000 оборотов в минуту.
- Выдержите смесь в течение 5 мин при комнатной температуре.
- Добавьте трансфекции раствор (1,5 мл) по каплям к клеткам. Используйте P1000 micropipet капать трансфекции решение на клетки. Дисперсные смесь по полной 9 см чашки Петри и встряхните планшет очень осторожно.
- Инкубируйте клетки при 37 ° С и 5% CO 2 в течение 6 ч. Затем снимите среды путем аспирации и сразу же заменить Wiго 12 мл свежего, предварительно нагретой среды. Осторожно добавьте свежую среду к клеткам, чтобы предотвратить открепления клеток. Для этого, удерживая кончик пипетки к стенке скважины и аккуратно вытолкнуть среду.
- Инкубируйте клетки в течение дополнительных 16 ч при 37 ° С и 5% СО 2.
3. Сотрудничество иммунопреципитацию
Примечание: Выполнение CO-Иммунопреципитация 24 ч после трансфекции.
- Получение низкой буфера для лизиса соли и высоким содержанием соли промывочного буфера.
- Подготовка исходного раствора 2 М раствора н-этилмалеимида (NEM) путем взвешивания количества NEM и растворения его в абсолютном этаноле. Подготовка исходного раствора NEM свежий перед использованием.
ВНИМАНИЕ: NEM является очень токсичным, подготовить и использовать эту маточного раствора в вытяжном шкафу. - Подготовка низким содержанием соли в буфере для лизиса при концентрациях рН 50 мМ трис-HCl, 8 150 мМ NaCl, 5 мМ этилендиаминтетрауксусной кислоты (ЭДТА), 1% NP40 и коктейль ингибитора протеазы (растворить 1 таблицут в 50 мл буфера для лизиса). Добавить NEM до конечной концентрации 25 мМ (например, разбавленной 1:80). Держите на льду после добавления ингибиторов протеазы и NEM.
Примечание: перед использованием Всегда добавляйте ингибиторы протеазы и NEM недавно. - Подготовка высококонцентрированный солевой промывной раствор буфера в концентрации 50 мМ Трис-HCl рН 8, 500 мМ NaCl, 5 мМ ЭДТА и 1% NP40. Обратите внимание, что промывочный буфер высокая соль не содержит NEM.
- Подготовка исходного раствора 2 М раствора н-этилмалеимида (NEM) путем взвешивания количества NEM и растворения его в абсолютном этаноле. Подготовка исходного раствора NEM свежий перед использованием.
- Подготовка клеточных лизатов.
- Извлеките носитель и промыть клетки с 2 мл ледяной фосфатным буферным раствором (PBS). Очень осторожно добавить промывочный буфер, а клетки HEK293T снять легко.
- Снимите PBS и добавить 600 мкл ледяной низкой буферной соли лизиса за 9 см чашки Петри.
- Инкубируйте пластин в течение 20 мин на льду. Убедитесь в том, что пластины хранятся горизонтально, чтобы обеспечить полный охват поверхности пластины с буфером для лизиса. Слегка встряхните пластин каждые 5 минут.
- Сбор клеточный лизат в 1,5 мл микроцентрифужныхтрубки и центрифуги в течение 3 мин при 4 ° С и 16000 мкг для осаждения нерастворимой фракции.
- Передача растворимой фракции, т.е. клеточного лизата к новому 1,5 мл микроцентрифужных трубки и держать на льду. Сразу продолжить протокол о сотрудничестве иммунопреципитации, чтобы предотвратить диссоциацию взаимодействующих белков. Выполнить все следующие шаги как можно больше на льду или при 4 ° С для ограничения протеолитической активности в лизатах.
- Генерация иммунными комплексами.
Примечание: На этом этапе, представляющий интерес белок связывается с соответствующим антителом. Для изучения взаимодействия NP-MX1, использовать мышь анти-NP моноклональное антитело.- Для каждого образца, смешать 135 мкл лизата с 2 мкл анти-NP моноклонального антитела и 113 мкл буфера низкой соли лизиса (общий объем 250 мкл). Храните оставшиеся лизат при температуре -20 ° С для дальнейшего анализа, такие как вестерн-блоттинга, документировать уровни экспрессии предположил Интераие партнеры в трансфекции клеток.
Примечание: Кроме того, измерения концентрации белка лизата (например, с Брэдфорд реагента) и использовать фиксированную сумму общего белка, например, 400 мкг, для каждого лизата. - Инкубируйте антитело-лизата перемешивают в течение 3 ч на колеса поворота при 4 ° С. Этот этап может быть продлен до инкубации в течение ночи.
- Для каждого образца, смешать 135 мкл лизата с 2 мкл анти-NP моноклонального антитела и 113 мкл буфера низкой соли лизиса (общий объем 250 мкл). Храните оставшиеся лизат при температуре -20 ° С для дальнейшего анализа, такие как вестерн-блоттинга, документировать уровни экспрессии предположил Интераие партнеры в трансфекции клеток.
- Получение белковых шариков G.
Примечание: белок G бисер транспортироваться и храниться в 20% -ном этаноле для сохранения. Шарик-суспензия обычно состоит из 50% шариков и эти шарики должны быть вымыты, прежде чем они будут использованы для иммунопреципитации с иммунными комплексами.- Используйте 50 мкл из бисера, т.е. 100 мкл бисером суспензии для каждого образца. Промыть количество шариков, необходимых для всех образцов в со-иммунопреципитации в одной пробирке. Отрежьте кончик пипетки 1 мл, чтобы облегчить пипетирование борта суспензией.
- Центрифуга белок G бисером суспензии при 8000 хг и 4 ° С в течение 30 сек. Удалить этанольного раствора и добавить равный объем буфера низкой соли лизиса. Центрифуга белок G-шарик суспензии при 8000 х г и 4 ° С в течение 30 сек и удалить супернатант осторожно. Повторите эту стадию промывки 3 раза.
Примечание: низкий буферной соли лизиса используется для мытья шариков не должен содержать ингибиторы протеаз или NEM. - Оцените объем белковых шариков G и добавить равный объем низкой буферной соли лизиса, чтобы сделать новую 50% бисером суспензии в буфере с низким соль лизиса.
- Для каждого образца, передачи 100 мкл шарик-суспензии в свежем 1,5 мл микроцентрифужных трубки и не хранить на льду до использования. Быть осторожным, чтобы ресуспендируют шарик-суспензии перед делением, так как эти шарики быстро оседают на дно пробирки.
- Иммунопреципитация иммунных комплексов белком бисером G и их вымывания.
- Перед использованием белка шарики G для иммунопреципитации, все пробирки центрифуги 30 сек при 8000 х г и 4 ° С ипроверить путем визуального осмотра, что существует равное количество шариков присутствует во всех образцах. При необходимости регулировать количество шариков в некоторых из образцов и центрифуги снова. Откажитесь от супернатантов. Будьте осторожны, чтобы не беспокоить осаждали белок бусы G.
- Кратко центрифуги иммунными комплексами (т.е.., Лизаты с антителом, 250 мкл) в течение 30 сек при 8000 х г и 4 ° С для сбора полной выборки на дне пробирки. Передача иммунными комплексами, чтобы белковых шариков G (50 мкл).
- Выдержите 60 минут на поворотном колесе при 4 ° С. Не инкубировать эти иммунные комплексы более 75 мин с гранул, чтобы уменьшить неспецифическое связывание белков с белковыми шариков G.
- Центрифуга белка бусы г (с связанных иммунных комплексов) в течение 30 сек при 8000 мкг и 4 ° C и удалить супернатанты. Будьте осторожны, чтобы не беспокоить осаждали белок бусы G. Дополнительно: магазин Этот супернатантами при 4 ° С или -20 ° С для последующего анализа,например, чтобы оценить количество несвязанного белка.
- Вымойте белка бусы G в течение примерно 5 мин с 900 мкл с высоким содержанием соли буфера для лизиса. Убедитесь в том, что шарики полностью ресуспендировали в буфере для стирки для оптимального мытья. Центрифуга белка шарики г в течение 30 сек при 8000 х г и 4 ° С и отбросить супернатанты. Повторите эту стадию промывки 4 раза. Будьте осторожны, чтобы не беспокоить осаждали белок G бисер, чтобы избежать потери Иммунопреципитированные материала.
- После последней стадии промывки, добавить 50 мкл 2x буфера Лэммли образца на шарики и суспензию нагревают в течение 10 мин при 95 ° С для элюирования (со) иммунопреципитации белков.
- Подготовка 10 мл 6x буфера Лэммли с 1 г додецилсульфата натрия, 3,5 мл глицерина, 3,5 мл 1 М Трис-HCl рН 6,8 и 420 мкл β-меркаптоэтанола. Регулировка до общего объема 10 мл добавлением дистиллированной воды. Развести 3 раза в дистиллированной воде, чтобы получить 2x буфере Лэммли.
ВНИМАНИЕ: &# 946; -mercaptoethanol является токсичным, приготовить и использовать Лэммли буфер в вытяжном шкафу.
- Подготовка 10 мл 6x буфера Лэммли с 1 г додецилсульфата натрия, 3,5 мл глицерина, 3,5 мл 1 М Трис-HCl рН 6,8 и 420 мкл β-меркаптоэтанола. Регулировка до общего объема 10 мл добавлением дистиллированной воды. Развести 3 раза в дистиллированной воде, чтобы получить 2x буфере Лэммли.
- После нагревания центрифуги белка бусы г для 30 сек при 8000 мкг и хранить образцы при температуре 4 ° С (краткосрочная) или -20 ° C (долгосрочные).
4. Анализ (со) Иммунопреципитированные Белки
- Визуализация белков, присутствующих в клеточном лизате и элюата сотрудничества иммунопреципитацией по SDS-PAGE 20 и Вестерн-блоттинга 21,22. Обычно загрузка половину элюата Laemmli на геле. Будьте осторожны, чтобы не беспокоить осаждали протеин G-бусинки при отборе проб для геля нагрузки. MX1 и выражение NP были выявлены с анти-MX1 и анти-NP антител, соответственно 14. Полосы детектировали с пероксидазой хрена на основе хемилюминесценции и разработчик рентгеновской пленки.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
N-этилмалеимид является органическое соединение, которое может быть использовано для необратимо изменить свободных тиоловых групп, например, для ингибирования цистеинпротеаз (рис 1).
Белок противовирусный Mx1 ингибирует вирус гриппа А репликацию, взаимодействуя с нуклеопротеина. Оптимизирован протокол о сотрудничестве иммунопреципитацию описано здесь позволяет изучать это взаимодействие NP-MX1. HEK293T клетки трансфицировали векторами экспрессии для противовирусного белка MX1 в отсутствие или в присутствии гриппа NP белка. Далее, белок NP был остановлен вниз от общего объема клеточных лизатов с НП-специфического моноклонального антитела. Рисунок 2 показывает, что белок Mx1 только совместно иммунопреципитации в присутствии со-выражается НП. Возможно неспецифического совместно иммунопреципитация MX1 в отсутствие NP вызвано либо неспецифического спуском белка MX1 антителом анти-NP или путем неспецифического связывания с MX1белковые шарики G. Таким образом, всегда включают отрицательный контроль, чтобы оценить эту неспецифическую сотрудничество иммунопреципитацию. Рисунок 3 показывает, что взаимодействие NP-Mx1 могут быть обнаружены только в присутствии NEM. В этом эксперименте неспецифического связывания MX1 в белковых шариков G оценивали с контрольной реакции со-иммунопреципитации в отсутствие анти-NP антител.
Этот протокол также может быть использован для изучения взаимодействия между MX1 и гриппа NP белка, выделенного из инфицированных клеток или из вирионов. Для этого приложения, указанное протокол был слегка адаптированы путем объединения лизаты клеток, экспрессирующих Mx1 с лизатов, содержащих вирусный белок NP перед началом протокола совместно иммунопреципитации. На рисунке 4 показаны совместно иммунопреципитация MX1 с НП изолированы от трансфицированных клеток, инфицированных клетках или вирионы.
В заключение, эти результаты показывают, что это совместное иммунопреципитации протocol могут быть использованы для изучения взаимодействия между противовирусного белка и его вирусной цели.
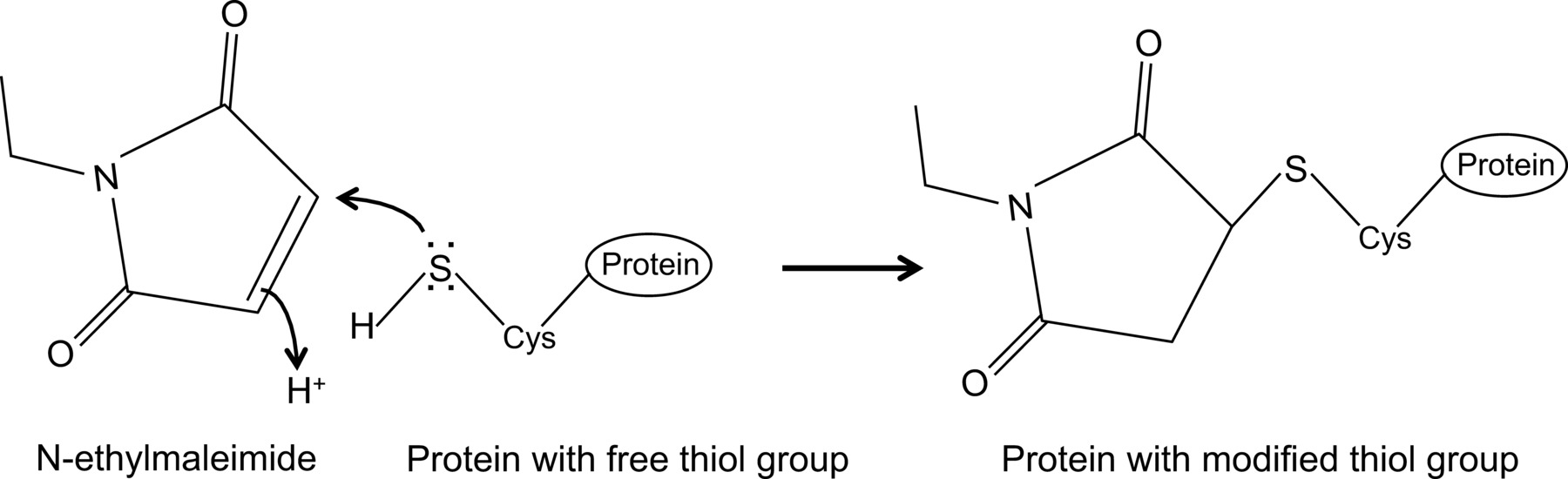
Рисунок 1:. Необратимые изменения свободных тиоловых групп N-этилмалеимида Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этой цифры.

Рисунок 2:. Mx1 взаимодействует с НП Вестерн-блот анализ эксперимента со-иммунопреципитации с двух образцов: одна, в которой и MX1 и NP присутствуют и одной настройке управления, в котором белок NP отсутствует. NP подвергают иммунопреципитации с анти-NP и NP и MX1 визуализировали с помощью вестерн-блоттинга. Эта цифра была изменена FROM 14.

Рисунок 3: N-этилмалеимид важно обнаружить NP - MX1 взаимодействие Вестерн-блот анализ со-иммунопреципитации эксперимента, выполненного в присутствии или в отсутствие N-этилмалеимида.. NP подвергают иммунопреципитации с анти-NP и MX1 и NP визуализировали с помощью вестерн-блоттинга.

Рисунок 4:. Mx1 взаимодействует с NP изолированы из инфицированных клеток или из вирионов лизаты, содержащие MX1 были объединены с лизатов, содержащих NP из разных источников: контрольный лизат (без vRNPs), трансфицированную vRNPs, vRNPs из инфицированных клеток или vRNPs изолированных от гриппа A вирионов , После смешивания лизатов, со-immunopreколичество осадков с анти-NP проводили и MX1 и НП визуализировали с помощью вестерн-блоттинга.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Изучение взаимодействия между противовирусных белков и их вирусных целей очень важно, чтобы понять детали противовирусного механизма этих белков. Это может дать новые знания о том, вирусы и их хозяева совместно эволюционировали и быть основой для разработки новых противовирусных стратегий. Оптимизирован протокол о сотрудничестве иммунопреципитацию описано здесь позволяет изучать взаимодействие между белком мыши MX1 и его вирусной цели, гриппа НП белка. Наиболее важным аспектом этого протокола является добавление NEM в буфере для лизиса, как взаимодействие NP-Mx1 не обнаруживается в отсутствие NEM (рисунок 3). На сегодняшний день не известно, почему присутствие NEM важно, чтобы обнаружить это взаимодействие. Тем не менее, этот протокол может быть полезен для изучения других слабых и / или переходные взаимодействия, которые зависят от стабилизации конкретных конформации белков, особенно если цистеина участвуют.
Важное ограничение совместно иммунопреципитации в целом является наличие специфических и качественных антител, которые распознают конформационные эпитопы в одном из партнеров по взаимодействию с высоким сродством. Взаимодействие NP-Mx1 не может быть продемонстрировано с в доме производится анти-Mx1 поликлональные антисыворотки. Это сыворотка также Иммунопреципитаты гриппу NP белка, даже в отсутствие MX1. Кроме того, моноклональное антитело против NP, который был использован, признает белок NP в / Пуэрто-Рико / 8/34 штамма вируса гриппа А, но, к сожалению, не подходит, чтобы вытащить вниз NP птичьего штаммов вируса гриппа. Еще одно ограничение этого протокола совместно иммунопреципитации является неспецифическое связывание MX1 и к белковым бисером G. Последнее связывание может быть преодолена путем увеличения концентрации соли в буфере для стирки и уменьшая время контакта между лизата и белка G бусин. Кроме того, уменьшение количества шариков для каждого иммунопреципитацииРеакция 50 мкл до 25 мкл, может дополнительно снизить неспецифическое связывание MX1 этих шариков. В общем, непреднамеренное выпадающее из загрязняющих белков, вызванные неспецифического связывания с белковыми шариков G, также может быть уменьшена на другие стратегии. Например, эти белки могут быть удалены в ходе предварительного этапа прозрачного, в котором эти белки удаляются путем инкубации лизата с протеином G шариков в отсутствие антитела. В примесные белки удаляют вместе с бусинами и предварительно очищенного лизата используют для совместного иммунопреципитации. Эта стратегия только выгодно, если эти примесные белки отличаются от белка (ов) в исследовании. С другой стороны, неспецифические сайты связывания на белке G шарики могут быть блокированы с BSA. Тем не менее, эта стратегия рекомендуется только если шарики сначала покрыты антителами, как BSA может также уменьшить осаждение иммунных комплексов (например, пониженная связывания антител с помощью шариков, бус). Взятыйвместе, очень важно, чтобы включать в себя соответствующие элементы управления, чтобы исключить неспецифическое связывание белков, представляющих интерес для белковых шариков G или антител, используемых.
Описанный протокол совместного иммунопреципитацию может быть изменен, чтобы изучить взаимодействие MX1 с белком NP, присутствующих в различных условиях, например, в инфицированных клетках или в очищенной vRNPs. Mx1 ингибирует экспрессию вирусных белков, в том числе НП, при вирусной инфекции гриппа 23. Таким образом, это технически чрезвычайно трудно изучить взаимодействие NP-MX1 в Mx1 трансфицированных клеток, которые впоследствии инфицированных. Тем не менее, этот протокол совместного иммунопреципитацию также может быть выполнена после объединения лизаты Mx1 клеток, экспрессирующих и инфицированных клеток, что позволяет успешно обнаруживать взаимодействия NP-MX1 (рисунок 4). Как важно мишенью NEM не известно, NEM при лизисе обеих клеточных популяций был добавлен. При желании рНбуфера для лизиса могут быть изменены. Эксперименты, описанные ниже, выполняются при рН 8 (как в Туранской и др. 10), но NP-Mx1 совместно иммунопреципитации была также успешно выполнены с помощью рН 7,2 буфере для лизиса. На самом деле рН 7,2 предпочтителен, так как при этом значении рН NEM реагирует исключительно свободных тиоловых групп, и это также увеличивает рН выход при экстракции белка MX1. Кроме того, белковые гранулы G может быть заменен белок А шариков, в зависимости от хост-видов, из которых используются антитела, полученные. Тем не менее, очиститель результаты получены с белком G шариков. Наконец, этот протокол также может быть использован для изучения взаимодействия между MX1 и других белков гриппа, например, PB2 14. В этом случае эпитоп V5 меченой использовали PB2, который в принципе может быть в сочетании с коммерчески доступным анти-V5 агарозном геле аффинной.
В будущих экспериментов, этот протокол может быть полезен для выявления областей, в классе MX1 иNP, которые важны для взаимодействия NP-MX1. Один из таких регионов в классе MX1 может быть петля L4, как этот цикл был показан иметь решающее значение для взаимодействия между МхА и вирус Thogoto НП 8,9. Если подходящие NP-специфические антитела становятся доступными, этот протокол также позволит определить, если повышенная чувствительность штаммов птичьего гриппа А для MX1 коррелирует с более сильным взаимодействием NP-MX1 или нет, которые могли бы помочь понять механизм чувствительности Мх. Кроме того, взаимодействие между MX1 и компонентов вирусов, принадлежащих к другим, чем Orthomyxoviridae семей, также могут быть рассмотрены этой адаптированной протокола совместно иммунопреципитации. Наконец, дальнейшие исследования, чтобы разгадать эффект NEM на NP-MX1 будет очень ценной, чтобы лучше понять эту специфическое взаимодействие, но и получить представление в более широких применений добавлением этого соединения во время лизиса клеток и со-иммунопреципитации экспериментов.
Subscription Required. Please recommend JoVE to your librarian.
Disclosures
Авторы заявляют, что они не имеют конкурирующие финансовые интересы.
Acknowledgments
Эта работа была поддержана FWO Фландрии, проект ИОФ IOF10 / Startt / 027 и Гентский университет Специальный научно-исследовательский Грант BOF12 / ГОА / 014.
Materials
| Name | Company | Catalog Number | Comments |
| DMEM high glucose | Gibco | 52100-047 | |
| N-Ethylmaleimide | Sigma | E-3876 | Toxic |
| Igepal CA-630 | Sigma | I-30212 | also known as NP40 |
| Protease inhibitor cocktail | Roche | 11 873 580 001 | |
| anti-NP monoclonal antibody | NIH Biodefense and Emerging Infections Research Resources Repository | NR-4282 | ascites blend of clones A1 and A3 |
| anti-RNP polyclonal serum | NIH Biodefense and Emerging Infections Research Resources Repository | NR-3133 | directed against A/Scotland/840/74 (H3N2) |
| Protein G Sepharose 4FF | GE Healthcare | 17-0618-01 | |
| Hyperfilm ECL 18 x 24 cm | GE Healthcare | 28-9068-36 | |
| ECL western blotting substrate | Pierce | 32106 |
References
- Verhelst, J., Hulpiau, P., Saelens, X. Mx proteins: antiviral gatekeepers that restrain the uninvited. Microbiol Mol Biol Rev. 77 (4), 551-566 (2013).
- Goujon, C., et al. Human MX2 is an interferon-induced post-entry inhibitor of HIV-1 infection. Nature. 502 (7472), 559-562 (2013).
- Kane, M., et al. MX2 is an interferon-induced inhibitor of HIV-1 infection. Nature. 502 (7472), 563-566 (2013).
- Liu, Z., et al. The interferon-inducible MxB protein inhibits HIV-1 infection. Cell Host Microbe. 14 (4), 398-410 (2013).
- Kochs, G., Haller, O. Interferon-induced human MxA GTPase blocks nuclear import of Thogoto virus nucleocapsids. Proc Natl Acad Sci U S A. 96 (5), 2082-2086 (1999).
- Flohr, F., Schneider-Schaulies, S., Haller, O., Kochs, G. The central interactive region of human MxA GTPase is involved in GTPase activation and interaction with viral target structures. FEBS Lett. 463 (1-2), 24-28 (1999).
- Kochs, G., Haller, O. GTP-bound human MxA protein interacts with the nucleocapsids of Thogoto virus (Orthomyxoviridae). J Biol Chem. 274 (7), 4370-4376 (1999).
- Mitchell, P. S., et al. Evolution-guided identification of antiviral specificity determinants in the broadly acting interferon-induced innate immunity factor MxA. Cell Host Microbe. 12 (4), 598-604 (2012).
- Patzina, C., Haller, O., Kochs, G. Structural requirements for the antiviral activity of the human MxA protein against Thogoto and influenza A virus. J Biol Chem. 289 (9), 6020-6027 (2014).
- Turan, K., et al. Nuclear MxA proteins form a complex with influenza virus NP and inhibit the transcription of the engineered influenza virus genome. Nucleic Acids Res. 32 (2), 643-652 (2004).
- Dittmann, J., et al. Influenza A virus strains differ in sensitivity to the antiviral action of Mx-GTPase. J Virol. 82 (7), 3624-3631 (2008).
- Zimmermann, P., Manz, B., Haller, O., Schwemmle, M., Kochs, G. The viral nucleoprotein determines Mx sensitivity of influenza A viruses. J Virol. 85 (16), 8133-8140 (2011).
- Manz, B., et al. Pandemic influenza A viruses escape from restriction by human MxA through adaptive mutations in the nucleoprotein. PLoS Pathog. 9 (3), e1003279 (2013).
- Verhelst, J., Parthoens, E., Schepens, B., Fiers, W., Saelens, X. Interferon-inducible protein Mx1 inhibits influenza virus by interfering with functional viral ribonucleoprotein complex assembly. J Virol. 86 (24), 13445-13455 (2012).
- Brewer, C. F., Riehm, J. P. Evidence for possible nonspecific reactions between N-ethylmaleimide and proteins. Anal Biochem. 18 (2), 248-255 (1967).
- Wu, C. Y., Jeng, K. S., Lai, M. M. The SUMOylation of matrix protein M1 modulates the assembly and morphogenesis of influenza A virus. J Virol. 85 (13), 6618-6628 (2011).
- Chen, Z., Zhou, J., Zhang, Y., Bepler, G. Modulation of the ribonucleotide reductase M1-gemcitabine interaction in vivo by N-ethylmaleimide. Biochem Biophys Res Commun. 413 (2), 383-388 (2011).
- Rennie, M. L., McKelvie, S. A., Bulloch, E. M., Kingston, R. L. Transient dimerization of human MxA promotes GTP hydrolysis, resulting in a mechanical power stroke. Structure. 22 (10), 1433-1445 (2014).
- Gifford, J. L., Walsh, M. P., Vogel, H. J. Structures and metal-ion-binding properties of the Ca2+-binding helix-loop-helix EF-hand motifs. Biochem J. 405 (2), 199-221 (2007).
- Separating Protein with SDS-PAGE. , JoVE. Available from: http://www.jove.com/science-education/5058/separating-protein-with-sds-page (2014).
- Gallagher, S., Chakavarti, D. Immunoblot analysis. J Vis Exp. (16), (2008).
- Eslami, A., Lujan, J. Western blotting: sample preparation to detection. J Vis Exp. (44), (2010).
- Pavlovic, J., Haller, O., Staeheli, P. Human and mouse Mx proteins inhibit different steps of the influenza virus multiplication cycle. J Virol. 66 (4), 2564-2569 (1992).



