Abstract
بجانب خلايا الكبد متني، والكبد يتكون من خلايا غير متني (مجلس الشعب) وهي خلايا كوبفر (KC)، الكبد الخلايا البطانية (كرا) والخلايا النجمية الكبدية (شهادة الثانوية العامة). لا تزال تعتبر ثنائي الأبعاد (2D) ثقافة الكبدية الإنسان الأساسية (PHH) باسم "المعيار الذهبي" لفي التجارب المختبرية من استقلاب الدواء وتسمم الكبد. ومن المعروف جيدا أن الأحادية 2D من PHH يعاني من فقد التمايز وفقدان الوظيفة. في الآونة الأخيرة تبين أن الكبد مجلس الشعب لعب دورا مركزيا في الكبد (patho-) علم وظائف الأعضاء والحفاظ على وظائف PHH. وتركز أبحاث الحالي على إعادة البناء في الجسم الحي العمارة الأنسجة عن طريق 3D- وثقافة مشتركة نماذج للتغلب على القيود المفروضة على الزراعات الأحادية 2D. سبق أن نشرت طريقة لعزل خلايا الكبد البشرية والتحقيق في مدى ملاءمة هذه الخلايا لاستخدامها في مزارع الخلايا في البيولوجيا التجريبية والطب 1. وبناء على اهتمام واسع في هذه الشركة المصرية للاتصالاتchnique الهدف من هذه المادة هو توفير بروتوكول أكثر تفصيلا لعملية عزل خلايا الكبد بما في ذلك الفيديو، والتي سوف تسمح للاستنساخ من السهل لهذه التقنية.
تم عزل خلايا الكبد البشرية من عينات أنسجة الكبد الإنسان من التدخلات الجراحية التي من خطوتين EGTA / كولاجيناز تقنية P الارواء. تم فصل PHH من مجلس الشعب قبل الطرد المركزي الأولي في 50 ز س. واستخدمت كثافة خطوات الطرد المركزي التدرج لإزالة الخلايا الميتة. تم عزل السكان خلية الكبد الفردية من الكسر مجلس الشعب المخصب باستخدام خصائص خلية معينة وإجراءات الفرز الخلية. إلى جانب العزلة PHH تمكنا من فصل KC، كرا وشهادة الثانوية العامة للحصول على مزيد زراعة.
مجتمعة، بما يسمح للبروتوكول المعروضة عزل PHH ومجلس الشعب في ذات جودة عالية وكمية من عينة الأنسجة المانحة واحد. الوصول إلى السكان خلية الكبد تنقية قد يسمح بإنشاء في الجسم الحي مثل لى البشرينماذج الاصدار.
Introduction
أنسجة الكبد الإنسان هي معقدة للغاية، ويتألف من كيانين مختلفين الخلايا، والخلايا متني والخلايا غير متني (مجلس الشعب). وتشمل خلايا الكبد متني خلايا الكبد وcholangiocytes. وتمثل خلايا الكبد 60-70٪ من مجموع خلايا الكبد، وتمثل أكثر من وظائف الكبد الأيضية، على سبيل المثال، الحامض المراري وتكمل تصنيع العامل، أحيائي والطاقة والتمثيل الغذائي 2،3.
يشكل جزءا مجلس الشعب أصغر 30-40٪ من مجموع خلايا الكبد. تشمل مجلس الشعب السكان مختلفة من الخلايا، وهي خلايا كوبفر (KC)، وخلايا الكبد البطانية (كرا) والخلايا النجمية الكبدية (شهادة الثانوية العامة). هذا جزء الخلية غيروي المنشأ يلعب دورا رئيسيا في العمليات الفسيولوجية للكبد. بالإضافة إلى ذلك، مجلس الشعب المشاركة في التوسط تلف الكبد الحاد، على سبيل المثال، إصابة المخدرات التي يسببها الكبد (ديلي)، فضلا عن وقوع إصابات الكبد المزمنة، مثل تليف الكبد 4.
في السنوات الأخيرة، حأصبحت خلايا الكبد أومان المزيد والمزيد من الضروري في البحث والتطوير لاختبار المخدرات، تطوير العقاقير وتحديد المسارات البيوكيميائية جديدة في أمراض الكبد. لفي التجارب المختبرية لا تزال تعتبر الزراعات الأحادية PHH باسم "المعيار الذهبي" 5. القيد الرئيسي من نماذج الكبد مثلي النمط الحالي هو فقد التمايز وفقدان وظيفة خلايا الكبد في غضون بضعة أيام 4. وقد أظهرت إنشاء تقنيات 3 الأبعاد (3D) الثقافة أن هذه القيود يمكن تعويض 4،6. ومع ذلك، وحتى تقنيات زراعة 3D الحديثة ليست قادرة على عرض جميع وسائط كبدية من الإجراءات 7. وتناقش في عداد المفقودين السكان مجلس الشعب في المختبر في النماذج القائمة كسبب محتمل لهذا التفاوت إلى الوضع في الجسم الحي. فقد تبين أن البلاغ خلية خلية بين مختلف مجموعات خلايا الكبد يلعب دورا محوريا في التوازن الفسيولوجي ولكن أيضا في pathophysiologic العمليات 8. وبالتالي فإن الاهتمام العلمي يركز أكثر فأكثر على مجلس الشعب والتفاعلات خلية خلية بهم. استعمالها هادفة في ثقافة مشتركة وأنظمة الأنسجة المهندسة ويمكن أن يكون حلا لارتفاع الطلب في المختبر نماذج الكبد 8،9 والتي هي أقرب إلى الوضع في الجسم الحي وقت ممكن.
حاليا التحدي الرئيسي هو تطوير نموذج الكبد شارك في ثقافة الإنسان موحد، والذي يحتوي على أجزاء محددة بوضوح من PHH ومجلس الشعب. ونتيجة لذلك، هناك حاجة إلى تقنيات العزل للخلايا الكبد غيروي المنشأ جدا وأولئك يجب أن يكون الأمثل للحصول على السكان الخلية نقية. في حين بروتوكولات موحدة لPHH العزلة وجود 10، وعزل موحدة للمجلس الوطنى البشري لا يزال قيد التطوير. وتستند معظم نشرت البروتوكولات العزلة مجلس الشعب على التجارب مع الخلايا غير البشرية 11،12. تصف سوى عدد قليل من المنشورات عملية عزل مجلس الشعب البشري والأكثر تغطية فقططرق لعزل خلية واحدة نوع 11-16. خصائص الخلية الأكثر أهمية التي تم تسخيرها لفصل الخلايا هي الحجم والكثافة، والسلوك المرفق، والتعبير عن البروتينات السطحية. على أساس هذه الخصائص قمنا بتطوير بروتوكول مبسط لعزل PHH، KC، كرا وشهادة الثانوية العامة، والتي نشرت سابقا في البيولوجيا التجريبية والطب 1. ونظرا لاهتمام واسع في هذه التقنية، وكان الهدف من هذه المقالة لتوفير بروتوكول أكثر تفصيلا لعملية عزل خلايا الكبد بما في ذلك الفيديو، والتي سوف تسمح للاستنساخ هذه التقنية بشكل أكثر سهولة. ويشمل البروتوكول أيضا أساليب مراقبة الجودة لتقييم العائد والجدوى فضلا عن تحديد ونقاء تقييم استخدام immunostainings محددة.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
ملاحظة: تم عزل جميع الخلايا من مقطوعة غير ورمي أنسجة الكبد الإنسان، التي بقيت بعد استئصال الكبد الجزئي مع أورام الكبد الأولية أو الثانوية. تم الحصول على الموافقة المسبقة من المرضى وفقا للمبادئ التوجيهية الأخلاقية للشاريتيه - Universitätsmedizin برلين.
1. إعداد مواد وحلول
- تعقيم جميع الأدوات والمواد في وقت مبكر لتفادي التلوث البكتيري أثناء عملية العزل.
- إعداد الحلول اللازمة لنضح من عينة أنسجة الكبد، عملية عزل خلايا الكبد وخلايا الكبد غير متني وزراعة خلايا الكبد البشرية الأساسية وفقا لالجدولين 1 و 2، مع استثناء من الهضم، الحل الذي الطازجة قبل استخدامها. ويمكن تخزين كل الحلول عند 4 درجات مئوية، وينصح لاستخدامها في غضون 4 أسابيع بعد الإعداد.
- عقمجميع الحلول باستخدام فلتر كبار 0،22 ميكرون زجاجة.
2. إعداد المعدات الإرواء
- إعداد المعدات اللازمة لنضح والهضم من عينة أنسجة الكبد كما هو مبين في الشكل 1A.
- ضبط درجة حرارة حمام الماء إلى 39 درجة مئوية لضمان النشاط P كولاجيناز المثلى خلال نضح والهضم.
3. الإرواء والهضم من عينة الكبد الأنسجة (1.5 ساعة)
- اختيار عينة الأنسجة مع كبسولة وغليسون سليمة من أنسجة الكبد مقطوعة. عندما قطع عينات الأنسجة، في محاولة للحصول على سطح قطع صغيرة مع السفن مرئية جيدة. تجنب الأوقات نقص التروية الدافئة من خلال نقل والتعامل مع عينة أنسجة الكبد على الجليد حتى نضح.
- تأخذ وزن الأنسجة تحت ظروف معقمة ووضع عينة أنسجة الكبد في طبق بتري في تدفق الهواء الصفحي. تنظيف سطح عينة الأنسجة مع ضغط العقيمة من إعادةاملتبقي الدم وطرد مجموعة قنية باستخدام 1X الإرواء، الحل الأول للتأكد من أن كل قنية كانت قابلة للاختراق.
- استخدام الغراء الأنسجة لإصلاح الزيتون للقنية في بعض الأوعية الدموية الكبيرة. اعتمادا على حجم العينة أنسجة الكبد وعدد من السفن على السطح، واستخدام قنية مع مجموعة 3-8 قنية. اختبار نضح والتحقق من وجود تسرب. إغلاق جميع الأوعية الدموية، مما تسرب واضح 1X الإرواء، الحل الأول، مع الغراء الأنسجة.
- ضع عينة أنسجة الكبد مقنى في قمع بوشنر عن دورتها مرشح القرص مثقب (الشكل 1A).
- ضبط معدل تدفق المضخة تحوي بين 7.5 مل / دقيقة و 14.6 مل / دقيقة اعتمادا على عدد من قنية المستخدمة وعلى المقاومة من أنسجة الكبد. ضبط معدل تدفق في كل مرة لضمان عدم وجود نضح الحالي ولكن ببطء. يروي الأنسجة حتى يتم مسح الدم الكامل بها ولكن لا يقل عن 20 دقيقة. مراقبة الأنسجة تصبح أكثر إشراقا في المناطق التي perfusi جيدعلى.
ملاحظة: في بعض الحالات، قد يكون من الضروري اتخاذ اجراءات واحدة من قنية مع المشابك البلاستيكية أو لزيادة الضغط الداخلي للمنطقة عن طريق دفع بهدوء مع ملعقة ضد كبسولة الكبد، لتحسين التروية. تغيير لون الكامل إلى أصفر الضوء على اللون البني الفاتح يشير إلى وجود نضح جيد. - تغيير السائل نضح على الهضم، الحل تحتوي على كولاجيناز P (الجدول 1).
- إعادة ترتيب الإعداد (الشكل 1A) للخطوة عملية الهضم. وبالتالي تؤدي إلى تدفق دائري الهضم-الحل وفقا ل1B الشكل لمدة تصل إلى 15 دقيقة.
ملاحظة: من المهم جدا لوقف نضح على الفور عندما يتم هضمها عينة أنسجة الكبد بما فيه الكفاية. والهضم الجيد ويمكن ملاحظة، عندما تظهر الأنسجة أي علامة على مرونة وفقا لتقييم صيانة التشوهات كبسولة، عندما يتم الضغط عليه مع ملعقة.
4. عزل خلايا الكبد (1 ساعة)
- تجرة مضخة تحوي قبالة ووضع عينة أنسجة الكبد في وعاء زجاجي. شطف خارج عينة الأنسجة مع الجليد الباردة توقف الحل (الجدول 1). إزالة قنية من عينة أنسجة الكبد. استخدام مشرط لفتح عينة أنسجة الكبد، عن طريق عمل قطع في منتصف المنطقة التي كانت تعلق قنية. حافظ على الرعاية التي الكبسولة Glisson's تبقى سليمة.
- شطف داخل عينات الأنسجة ومن ثم تغطية عينة النسيج كله مع الجليد الباردة توقف الحل. هزة الأنسجة بلطف للافراج عن الخلايا من الأنسجة.
- جمع تعليق خلية وتصفية عليه من خلال نظرة القمع (قمع البلاستيك واصطف مع ضغط الشاش) إلى 50 مل أنابيب البلاستيك. إضافة المزيد من توقف حل لعينة أنسجة الكبد حتى يتم استهلاك الحجم النهائي من 500 مل.
- الطرد المركزي تعليق خلية في 50 x ج، 5 دقائق، 4 درجات مئوية. جمع طاف لاحقة عزل الخلايا غير متني. غسل بيليه الخلية مع برنامج تلفزيوني (الشكل 2A).
- الطرد المركزي تعليق الخلية مرة أخرى في 50 x ج، 5 دقائق، 4 درجات مئوية. جمع طاف وإعادة تعليق بيليه في الكبدية الحضانة المتوسطة (الجدول 2، الشكل 2B).
- تحديد عدد الخلايا وقدرتها على البقاء في تعليق الخلية الناتجة باستخدام تلطيخ التريبان الأزرق. عدد الأحياء والخلايا الميتة في عد غرفة نويباور. حساب عدد الخلايا، والسلامة والعائد من PHH باستخدام الصيغ أدناه.
العائد (خلايا تحصى) = خلايا عدها س عامل تخفيف حجم العاشر من تعليق خلية (مل) × 10000
العائد (خلايا الكبد / (ز الكبد عينة الأنسجة)) = (الغلة (خلايا الكبد / (وسائل الإعلام مل)) X الحجم من تعليق خلية (مل)) / (وزن عينة أنسجة الكبد (ز))
الجدوى (٪) = 100٪ × (عدد الخلايا الحية) / (إجمالي عدد الخلايا)
5. تنقية خلايا الكبد (1 ساعة)
ملاحظة: هذه الخطوة مستحسن تنقية، إذا الجدوىأقل من 70٪.
- تنفيذ جميع الخطوات على الجليد. إعداد 25٪ التدرج الكثافة عن طريق خلط 5 مل من محلول كثافة التدرج و 15 مل برنامج تلفزيوني لمدة الطرد المركزي التدرج الكثافة.
- وضع حد أقصى قدره 50 خلية ميو في مجموعه من الكبدية تعليق خلية غنية بعناية وببطء على أعلى من 25٪ طبقة التدرج الكثافة لضمان فصل واضح من كل الطبقات ويتحقق (الشكل 2C). وضع أنابيب بعناية في أجهزة الطرد المركزي وأجهزة الطرد المركزي في 1250 x ج، 20 دقيقة، 4 درجات مئوية دون فرامل (الشكل 2D).
- نضح تعليق خلية المتبقية والخلايا الميتة في الطور البيني. تبعا للنوع المحتوى من الدهون ويمكن أيضا نضح كثافة التدرج حل.
ملاحظة: PHH مع محتوى الدهون منخفضة تشكيل بيليه كثيفة والتدرج الكثافة يمكن أن يستنشق تماما. PHH مع محتوى الدهون عالية تشكيل بيليه أكثر انتشارا والكثير من خلايا قابلة للحياة قد تبقى في حل التدرج الكثافة فوق بيليه. - اعادة تعليق الكريات الكبدية مع برنامج تلفزيوني وأجهزة الطرد المركزي مرة أخرى في 50 x ج، 5 دقائق، 4 درجات مئوية. تجمع الكريات، ويغسل مرة أخرى مع برنامج تلفزيوني واعادة تعليق النقي PHH في الكبدية الحضانة المتوسطة. أداء عد الخلايا كما هو موضح في الخطوة 4.6.
6. زراعة خلايا الكبد
- إعداد أطباق زراعة الخلايا لزرع البذور من PHH من طلائها مع المصفوفة خارج الخلية، على سبيل المثال ذيل فأر الكولاجين (نوع الكولاجين الأول). إعداد الكولاجين ذيل فأر وفقا للبروتوكول المعمول به من قبل راجان وآخرون. 17
- تمييع ذيل فأر حل الأسهم الكولاجين 1: 200 في برنامج تلفزيوني. نقل 100 ميكرولتر / سم 2 الفئران حل الذيل الكولاجين في أطباق الثقافة، مع الحرص على أن يتم تغطية السطح كله. احتضان البلاستيك زراعة الخلايا لمدة 20 دقيقة في درجة حرارة الغرفة. نضح في ذيل فأر حل الكولاجين المتبقية.
- البذور 15 × 10 4 خلايا الكبد / سم 2 في الكبدية الحضانة المتوسطة على dishe الثقافةق المغلفة مع الكولاجين ذيل فأر. زراعة الخلايا في حاضنة ترطيب عند 37 درجة مئوية، و 5٪ CO 2 لمدة 4 على الأقل ساعة. بعد 4 ساعات انضمت خلايا الكبد ويمكن تغيير المتوسطة.
- أداء التحقيقات اعتمادا على الإعداد التجريبية. ينصح الوقت ثقافة 48 ساعة للسماح للخلايا للتعافي من عملية العزلة.
7. عزل خلايا الكبد غير متني (1.5-2 ساعة)
- الطرد المركزي طاف جمعها (الخطوة 4.5 و 4.6) في 72 x ج، 5 دقائق، 4 درجات مئوية للقضاء على خلايا الدم الحمراء وخلايا الكبد المتبقية. تجميع supernatants وأجهزة الطرد المركزي لهم مرتين للحصول على اثنين من الكريات الخلايا: 300 x ج، 5 دقائق، 4 درجة مئوية لمدة الترسيب من شهادة الثانوية العامة، كرا وجزئيا KC و 650 x ج، 7 دقائق، 4 درجة مئوية لمدة الترسيب ما تبقى من KC.
- تجمع كل من الكريات وإعادة تعليق عليها في HBSS. إعداد 25٪ والتدرجات 50٪ الكثافة عن طريق خلط حل التدرج الكثافة وبرنامج تلفزيوني لمدة centrif كثافة التدرجugation (25٪ محلول كثافة التدرج: 5 مل كثافة حل التدرج و 15 مل في برنامج تلفزيوني، 50٪ محلول التدرج الكثافة: 10 مل كثافة حل التدرج و 10 مل في برنامج تلفزيوني، انظر الشكل 2). وضع 25٪ من محلول كثافة التدرج بعناية على أعلى من 50٪ كثافة التدرج طبقة فحل.
- ضع تعليق مجلس الشعب بعناية وببطء على أعلى من 25٪ كثافة التدرج طبقة فحل في الطريقة التي يتم بها تحقيق فصل واضح من كل الطبقات.
- الطرد المركزي تعليق خلية في التدرج الكثافة في 1800 x ج، 20 دقيقة، 4 درجات مئوية دون فرامل (الشكل 2.2).
- نضح الخلايا الميتة وبقايا الخلايا من الطبقة العليا. وتقع على مجلس الشعب في الطور البيني بين 25٪ و 50٪ التدرج الكثافة طبقة (الشكل 2). جمع مجلس الشعب، وغسلها مع HBSS وأجهزة الطرد المركزي تعليق خلية تطبيق وصف خطوة الطرد المركزي المزدوجة أعلاه (الخطوة 7.2).
8. فصل خلايا كوبفر (الالتزامالخطوة الانفصال) (1 ساعة)
- إجراء تعداد خلايا لKC في جزء مجلس الشعب كما هو موضح في الخطوة 4.6. (للحصول على مظهر KC في تعليق انظر الشكل 3B). الطرد المركزي الكسر مجلس الشعب مع مزدوجة الطرد المركزي خطوة المذكورة أعلاه (الخطوة 7.2) وإعادة تعليق مجلس الشعب في كوبفر خلية البذر المتوسطة (الجدول 2).
- البذور وKC تحتوي على جزء على السفن زراعة الخلايا البلاستيكية في مناطق ذات كثافة 5 × 10 5 KC / سم 2. احتضان الثقافات KC لمدة 20 دقيقة في حاضنة ترطيب عند 37 درجة مئوية، و 5٪ CO 2. KC الأساسي الالتزام على البلاستيك زراعة الخلايا في غضون فترة قصيرة من الزمن (الشكل 2.3).
- جمع طاف تحتوي لم تلتزم مجلس الشعب، التي تتألف أساسا من كرا وشهادة الثانوية العامة. تجميع supernatants لفصل لاحق من LEC (انظر القسم 9)، وشهادة الثانوية العامة (انظر المادة 10). غسل KC ملتصقة مع HBSS وزراعتها في كوبفر خلية ثقافة المتوسط (الجدول 2) عند 37 درجة مئوية، و 5٪ CO2 في حاضنة مرطب.
9. فصل الخلايا البطانية (1.5 ساعة)
- الطرد المركزي طاف جمعها (الخطوة 8.5) في 300 x ج، 5 دقائق، 4 درجات مئوية. غسل بيليه مع برنامج تلفزيوني. بعد الطرد المركزي في 300 x ج، 5 دقائق، 4 ° C اعادة تعليق الخلايا النجمية في خلية / البطانية المتوسطة الفصل الخلية وإجراء تعداد خلايا لجميع الخلايا المتبقية كما هو موضح في الخطوة 4.6.
- اعادة تعليق 1 × 10 7 خلايا ميو في 1 مل النجمية خلية / البطانية المتوسطة الفصل الخليوي، إضافة 20 ميكرولتر عرقلة الحل من أجهزة ماكينتوش-KIT و 20 ميكرولتر من الخرز CD31 مايكرو لimmunolabeling واحتضان تعليق مما أدى لمدة 15 دقيقة على 4 درجة مئوية درجة الحرارة (الشكل 2.4).
- كرا منفصل عن شهادة الثانوية العامة كما هو موضح في بروتوكول manufacturer's للخلية الفرز نظام تنشيط مغناطيسيا أجهزة ماكينتوش (الشكل 2.5). أزل احتفظ مغناطيسيا كرا-CD31 إيجابي وتعليق عليها في النجمية Cالذراع / البطانية مستنبت الخليوي (الجدول 2).
- أداء الخلية عد لكرا كما هو موضح في الخطوة 4.6. كرا البذور في كثافة 1.25 × 10 5 خلية / سم 2 في الأوعية زراعة الخلايا المغلفة مع الكولاجين ذيل فأر (راجع الخطوة 6.1). زراعة الخلايا عند 37 درجة مئوية، و 5٪ CO 2 في حاضنة مرطب.
10. فصل الخلايا النجمية (0.5 ساعة)
- غير المسماة شهادة الثانوية العامة اجتياز عمود الفصل أثناء إجراء بالاعمال. جمع جزء شهادة الثانوية العامة (راجع الخطوة 9.5، الشكل 2.5). أداء عد الخلايا كما هو موضح في الخطوة 4.6.
- شهادة الثانوية العامة البذور مع كثافة 5 × 10 4 خلية / سم 2 في الأوعية زراعة الخلايا المغلفة مع الكولاجين ذيل فأر (راجع الخطوة 6.1) في النجمية خلية / البطانية مستنبت الخليوي (الجدول 2) وزراعة لهم عند 37 درجة مئوية، و 5٪ CO 2 في حاضنة مرطب.
الجدول 1: الإرواء وحل العزلة.
الجدول 2: الثقافة والعزلة وسائل الإعلام.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
فصل في متني وغير متني جزء، وذلك باستخدام الكثافة الطرد المركزي التدرج كإجراء تنظيف جنبا إلى جنب مع استخدام خصائص الالتزام وأجهزة ماكينتوش يؤدي إلى نجاح PHH ومجلس الشعب العزلة. PHH ومجلس الشعب يمكن أن تكون معزولة في ذات جودة عالية وكمية ويبين الشكل 1 الإعداد تمثيلية من المعدات اللازمة لنضح الكبد والهضم. تم إضافة 10٪ FCS إلى كولاجيناز P تحتوي على الإرواء - الحل الثاني للحد من نشاط بروتين البروتياز والعمل على استقرار النشاط P كولاجيناز في المقابل. ونتيجة لذلك أوقات أطول الهضم المطلوبة لعزل مجلس الشعب يمكن تطبيقها دون تأثير سلبي على سلامة PHH.

. ويتم الإرواء والإعداد الهضم الخطوة نضح الأولى في أوردي: الشكل 1r لإزالة بقايا الدم، الاحماء الأنسجة وإزالة الكالسيوم 2+ بحل خلية خلية اتصالات باستخدام 1X تروية دموية الحل الأول (PI) (A). يتم تنفيذ إعادة تدوير الهضم-الحل (DG) لهضم أنسجة الكبد خلال نضح خطوة الثاني (B).

الشكل 2: المبسطة التمثيل التخطيطي لعملية عزلة تامة PHH ومجلس الشعب المعدلة من فايفر وآخرون 1، 2014 بإذن من البيولوجيا التجريبية والطب. أولا، يتم perfused عينة أنسجة الكبد وهضمها من قبل من خطوتين EGTA / كولاجيناز تقنية P نضح (A). يتم طرد تعليق الخلية اكتسبت في البداية في 50 x ج، 5 دقائق، 4 درجات مئوية (B)، للفصل بين أكبر PHH-جزء (بيليه) من مجلس الشعب-جزء أصغر (supernatant). في حالة وجود جدوى PHH أقل من 70٪، ونسبة PHH قابلة للحياة ويمكن أثرى الطرد المركزي كثافة التدرج في 1250 x ج، 20 دقيقة، 4 درجات مئوية (C) مما أدى إلى تسوية للPHH في أسفل الأنبوب، بينما القتلى تقع خلية / الحطام الخلية على الجزء العلوي من طبقة التدرج الكثافة (D). وطرد supernatants التي تم جمعها من الطرد المركزي الأولي (1) باستخدام اثنين من الخطوات التالية: 1) 300 x ج، 5 دقائق، 4 ° C و 2) 650 x ج، 7 دقيقة، 4 درجات مئوية. بعد الطرد المركزي الأول وتقع KC جزئيا في طاف. في هذا السياق ضروري وخطوة العزلة الثانية. يتم تجميع الكريات خلية المكتسبة وإعادة علقت في HBSS. وفي وقت لاحق، والطبقات تعليق الخلية بعناية على رأس اثنين من طبقة (25٪ / 50٪) درجة الكثافة. وطرد أنابيب التدرج الكثافة الطبقات في 1800 x ج، 20 دقيقة، 4 درجات مئوية (2). يتم تجاهل الخلايا الميتة على أعلى من 25٪ طبقة التدرج الكثافة. مجلس الشعب الواقعة بين الطور البيني من 25٪ و 50٪ ديتم جمع ensity طبقة التدرج وتجميع. والمصنف الكسر مجلس الشعب على البلاستيك زراعة الخلايا غير المصقول. باستخدام فترة حضانة 20 دقيقة يتم فصل (الالتزام خطوة الانفصال) KC من السكان خلية الكبد الأخرى (3). يتم فصل كرا وشهادة الثانوية العامة عن طريق استخدام أجهزة ماكينتوش-عدة. ولذلك طرد خلايا الكبد المتبقية التي تم جمعها في طاف في 300 x ج، 5 دقائق، 4 درجات مئوية، ووصفت مع ميكروبيدات-CD31 مترافق (4). فقط-CD31 سلبي على شهادة الثانوية العامة اجتياز العمود MACS الفصل (5). ، CD31 إيجابي كرا عصا إلى العمود. وأخيرا يتم إزالة عمود من الجهاز المغناطيسي وكرا-CD31 إيجابي ومزال من العمود (5). الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
أظهرت PHH معزولة العائد من 14.2 × 10 6 ± 6.6 × 10 6 قابلة للحياة PHH / ز أنسجة الكبد وبقاء حوالي 760.6 ± 4.2٪ (الجدول 3 1). مجهريا كانت ملامح واضحة لحجم نموذجي كبير حشوية في تركيبة مع قطرات الدهون وبين واحد وأربعة نوى، (الشكل 3A). حجم الخلية يتراوح بين 20 الى 30 ميكرون في تعليق.
كانت KC نوع من الخلايا الأكثر شيوعا في جزء مجلس الشعب. نحن عزل حوالي 1.9 × 10 6 ± 0.2 × 10 6 قابلة للحياة KC / ز أنسجة الكبد مع بقاء 92.8 ± 3.5٪ (الجدول 3 1). KC هي خلايا صغيرة جدا (حوالي 5 ميكرون) مع انخفاض نسبة السيتوبلازم / نواة والزغيبات الصغيرة نموذجية على السطح (الشكل 3B).
أخيرا استخدمنا تقنية بالاعمال فصل لفصل كرا-CD31 إيجابي من-CD31 سلبي على شهادة الثانوية العامة المتبقية. وكان العائد من كرا ما يقرب من 2.7 × 10 5 ± 0.1 × 10 5 قابلا للتطبيق كرا / ز ليفوكانت الأنسجة إيه والجدوى حققت 95.6 ± 2.8٪ (الجدول 3 1). معايير تحديد الهوية هي granulae متعددة وبحجم حوالي 10 ميكرون في تعليق خلية (الشكل 3C) وكذلك شكل مغزل مميزة بعد وقت قصير زراعة (الشكل 3G).
وأسفرت عملية عزل في العائد على شهادة الثانوية العامة حوالي 4.7 × 10 5 ± 0.2 × 10 5 قابلا للتطبيق شهادة الثانوية العامة / ز الكبد (N = 8) مع بقاء 89.6 ± 3.8٪ (الجدول 3 1). مجهريا كانت الخصائص القابلة للتحديد حجم حوالي 20 ميكرون وظهور حبيبات نموذجي مع كمية متفاوتة من قطرات الدهون (الشكل 3D).
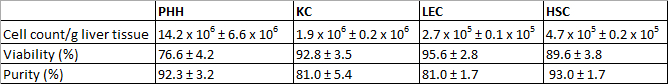
الجدول 3: العوائد، والسلامة ونقاء PHH معزولة وNPC. تم تقييم ثلاثة مختلف الجهات المانحة. فالبيانات معطاة كما يعني ± SD. وقد نشر هذا الجدول قبل في فايفر وآخرون. 1، 2014، وطبع بإذن من البيولوجيا التجريبية والطب.
لتحديد وتقرير من النقاء زراعة الخلايا، وتعامل كل جزء الخلية معزولة مع الأجسام المضادة ضد نوع من الخلايا مستضدات معينة. تم علاج الخلايا مع الأجسام المضادة الثانوية الفلورية والتحقيق بواسطة المجهر المناعي. تم تحديد النقاء عن طريق عد خلايا إيجابية الملون فلوري فيما يتعلق إجمالي عدد الخلايا التي تصور هويشت تلطيخ.
بعد 24 ساعة من PHH زراعة أظهرت شكل متعدد الأضلاع مميزة وغالبا ما تعدد الصيغ الصبغية (الشكل 3E). كانت PHH إيجابية لCK 18 (الشكل 3I) وأظهرت نقاء 92.3 ± 3.2٪(الجدول 3 1).
KC الالتزام في غضون 20 دقيقة على السطوح البلاستيكية زراعة الخلايا. بعد أن لاحظ ان فترة حضانة من 24 ساعة خلايا صغيرة مدورة مع بارزة نواة الخلية مستديرة الشكل (3F). تم استخدام البروتين CD68 السطح لتحديد KC (الشكل 3J). بلغ نقاء خلايا إيجابية CD68 إلى 81.0 ± 5.4٪ (الجدول 3 1).
وعلى الرغم من الانفصال MACS باستخدام CD31 وضع العلامات خلال فصل مجلس الشعب كان لا يزال من الممكن صمة عار كرا معزولة مع CD31. لذلك كانت ملطخة كرا معزولة وزراعتها مع CD31 لتحديد وتقرير من النقاء. بالإضافة إلى ذلك أظهرت كرا مناعية لفيمنتين خلية الوسيطة علامة (الشكل 3K). لاحظنا ما يقرب من 81.0 ± 1.7٪ من الخلايا الملون الايجابية (الجدول 3 1). وتميزت شهادة الثانوية العامة مع قطرات الدهون البارزة النموذجية الخاصة (الشكل 3H) من خلال تلطيخ المناعي للGFAP (الشكل 3L). كان شهادة الثانوية العامة نقاء 93.0 ± 1.7٪ (الجدول 3 1).
كان counterstained كل جزء الخلية مع علامات أخرى مجلس الشعب. تحتوي جميع أجزاء الخلية على عدد صغير من الكبد أنواع معينة من الخلايا الأخرى، ولكن كانت سلبية للعلامة الكبدية CK18 وCK19 cholangiocyte علامة.

. الشكل 3: مورفولوجيا متني البشري وخلايا الكبد غير متني في التعليق وبعد تمسك العمود الأيسر (A - D) يبين مختلف معزولة السكان خلية الكبد مباشرة بعد عملية العزلفي المرحلة الرأي النقيض المجهر: PHH (A)، KC (B)، كرا (C)، وشهادة الثانوية العامة (D). العمود الأوسط (E - H) يعرض صور معزولة وزراعتها PHH (E)، KC (F)، كرا (G) وشهادة الثانوية العامة (H) بعد 24 ساعة من زراعة (النقيض من المرحلة المجهري). ويرد وصف القائم المناعي للكسور مختلفة من الخلايا في العمود الأخير: أظهرت PHH اشارات ايجابية لCK18 الكبدية علامة (ط، 24 ساعة بعد العزلة)، كان KC إيجابية للCD68 علامة (J، 24 ساعة بعد العزلة)، أظهرت كرا اشارات ايجابية لفيمنتين (K، 72 ساعة بعد العزلة) وكانت شهادة الثانوية العامة إيجابية للGFAP (L، 72 ساعة بعد العزلة). كانت ملطخة نواة الخلية مع هويشت. التكبير: 400X. تعديل من فايفر وآخرون. 1، 2014 بإذن من EXPERعلم الأحياء imental والطب. الرجاء انقر هنا لعرض نسخة أكبر من هذا الرقم.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
يصف بروتوكول نشر تقنية لعزل النقي PHH ومجلس الشعب، وهي KC، شهادة الثانوية العامة وكرا، في وقت واحد في ذات جودة عالية ونقاء من نفس عينة من أنسجة الكبد الإنسان. غالبية المنشورات التعامل مع العزلة خلية الكبد وتغطي واحد من هؤلاء السكان الخلية 18-20 وإجراءات العزل يؤديها مع الأنسجة البشرية فقط نادرة (التي استعرضتها دام وآخرون.) 21. التكيف من أساليب أنشئت مع الأنسجة الحيوانية (على سبيل المثال، كبد الفئران) لكبد الإنسان وكشف العديد من الاختلافات في خصائص الخلية بين سكان الخلية البشرية الحيوانية و. كشفت إنشاء طريقة عزل خلايا الكبد التي تغطي مختلف مجموعات خلايا الكبد أن الجمع بين متني وغير متني والعزل الخلية هو خطوة حاسمة نظرا إلى اختلاف في الوقت الهضم المطلوبة من أجل تحقيق النتائج الأمثل. تواجه هذا التحدي الذي وضعت بروتوكول الكبد زنزانة انفرادية الجمع بين التقنيات المختلفة وتكييفحد ذاتها لدينا بروتوكول العزلة PHH 10.
من خلال إضافة 10٪ FCS إلى كولاجيناز P يحتوي الحل الثاني كنا قادرين على الحد من نشاط بروتين البروتياز. يسمح هذا التعديل الأوقات الهضم أطول، اللازمة لكسب أعداد كبيرة من مجلس الشعب. ونتيجة لذلك تمكنا من عزل PHH وكذلك مجلس الشعب من نوعية جيدة وبكميات عالية. نجاح العزلة خلية الكبد تعتمد بشدة على نوعية الأنسجة الأولية. البيانات المانحة وسوابق المريض يمكن أن تؤثر على نوعية الخلايا وكمية. من تجربتنا هناك أي ارتباط مع عوامل محددة المانحة وكذلك الموظفين ذوي الخبرة جدا يمكن أن تواجه عزلة خلية ناجحة. لأن نوعية الأنسجة المانحة هي النقطة الحرجة، عن مصادر خارجية، والتي قد تحد من كفاءة الأنسجة، ويجب أن يكون الحد الأدنى.
معظم العوامل الحاسمة هي الأوقات نقص التروية الدافئة بعد التدخل الجراحي وأوقات نقص التروية الباردة أثناء نقل ر الأنسجةس المختبر. وبالإضافة إلى ذلك ينبغي تجنب أية مصادر للعدوى البكتيرية. ومن الجدير بالملاحظة أنه في بعض الأحيان الجهاز نفسه يمكن أن تحتوي التلوث الجرثومي، على سبيل المثال، في حالة الأمراض القناة الصفراوية. خطوات حاسمة في إجراء العزل تغطي مرات نضح والخطوات الطرد المركزي التدرج الكثافة. الخطوة الأولى نضح يجب أن يستمر 20-30 دقيقة. قد يؤدي مرات نضح أقصر لمفرزة غير مكتملة من الاتصالات خلية خلية مما أدى إلى وقوع مجموعات الخلايا في تعليق خلية المكتسبة. ونضح الأول لفترة طويلة يقلل من بقاء الخلية ويدفع الضغط الخلية نتيجة لاستنزاف الكالسيوم 2+.
الخطوة الثانية نضح يؤديها للهضم أنسجة الأنزيمية يتطلب بعض الخبرة لتحديد درجة الهضم الأمثل لاتخاذ قرار حول وقف رد فعل بروتين في نقطة زمنية الصحيحة. مرات الهضم قصيرة تؤدي إلى عوائد منخفضة وأوقات الهضم طويلة إلى الخلية الضغط وتلف الخلايا.من تجربتنا الإطار الزمني بين الأنسجة عسر الهضم والأنسجة التالفة أثناء عملية الهضم كثيرا ما تقع ضمن إطار من 1-3 دقيقة. ونضح ناقصة يمكن مواجهته عن طريق تحويل الضغط داخل الأنسجة في منطقة أخرى باستخدام المشابك للمعسر قبالة قنية. ضغط لينة وبالإضافة إلى ذلك مع ملعقة نحو عينة الأنسجة يؤدي إلى تغيير في نضح الأنسجة. الأنسجة غير المضغوطة وتزيد من الضغوط الداخلية. وفي وقت لاحق، وأيضا ضغط الأوعية الدموية ويقلل دائرة نصف قطرها بهم. مع انخفاض في دائرة نصف قطرها، ويزيد من مقاومة (القانون هاجن-بوازوي) والحل نضح تفضل الطريق الأقل مقاومة وperfuses مناطق أخرى. وفقا Baccarani وزملاء العمل لاحظنا أن أنسجة متليفة أو تشمع يحتاج إلى فترة أطول الهضم مما أدى إلى انخفاض viabilities خلية 22. لهذا السبب فإننا ننصح لتجنب الأنسجة من المرضى الذين يعانون من تليف الكبد أو تليف الكبد.
إعداد والتعامل مع تدرجات الكثافة وكذلك خلايا الحصاد من التدرجات (راجع الخطوة 5 و 7) تغطي أيضا الخطوات الحاسمة. مختلف طبقات التدرج الكثافة وتعليق خلية لها على أن يتم تحويلها بطريقة بطيئة ومتأنية لإنشاء interphases حادة. بالإضافة إلى ذلك هناك دائما خطر الإضرار التدرج أثناء المناولة، وخاصة أثناء حصاد الخلايا. خلال فصل مجلس الشعب خطوة الانفصال التزام أمر حاسم للعوائد في وقت لاحق ونقاء كل كسور مجلس الشعب. لزيادة عدد الخلايا في مجلس الشعب لم تلتزم ونقاء KC خطوة غسيل إضافية يمكن أن تكون مفيدة. وتجمع الحل غسل هذه الخطوة مع supernatants لمزيد من الانفصال مجلس الشعب. لتجنب التلوث بالبكتيريا والفطريات أو الفيروسات ظروف معقمة صارمة يتعين ضمان 23.
في الاعتماد من السكان الخلية المطلوبة يمكن تغيير البروتوكول وتعديلها من خلال تخطي خطوات محددة. على سبيل المثال إذا KC فقط هيمطلوب ويمكن تخفيض خطوة الطرد المركزي المزدوجة للترسيب مجلس الشعب إلى الخطوة الثانية الطرد المركزي ويمكن إسقاط خطوات لشهادة الثانوية العامة وفصل LEC. ويمكن أيضا أن تختلف مرات نضح وز قوة لالطرد المركزي في اعتماد الأنسجة وجودة الخلية. الأنسجة التليفية يتطلب إطالة أمد الأوقات الهضم، لذلك هناك حاجة إلى السيطرة بعناية على مرونة الأنسجة. تراكم قطرات الدهون في خلايا الكبد الدهنية يقلل من كثافة الخلايا، وبالتالي يغير خصائص الترسيب. وفقا لملاحظات لدينا يمكن أن تكون مفيدة لضبط ز قوة خلال PHH العزلة اعتمادا على محتوى الدهون في PHH، عندما يطلب كميات عالية PHH. لا بد من الإشارة إلى أن أي تغيير في خطوة الطرد المركزي الأولية ستؤثر سلبا على عزل مجلس الشعب من حيث النوعية والكمية. وحتى الآن، ونحن نوصي ز القوات بين 50 x ج (خلايا الكبد مع نسبة منخفضة من الدهون) و 150 x ج (خلايا الكبد مع ارتفاع نسبة الدهون). HEPA الدهنية بالإضافة إلى ذلكtocytes تميل إلى تشكيل خلية بيليه أقل التعاقد بعد الطرد المركزي التدرج الكثافة والحصاد خلية مزيد من يجب أن يتغير كما هو موضح في الخطوة 5.5.
لتسريع إجراء العزل يمكن القيام ببعض الخطوات في وقت واحد. على سبيل المثال بالتوازي مع تنقية الخلايا الكبدية المعزولة يمكن للشخص الثاني يبدأ مع العزلة مجلس الشعب. وبالإضافة إلى حلول متدرجة الكثافة يمكن أن تكون معدة مسبقا. إذا كان هناك أكثر من شخصين حتى المزيد من الخطوات التي يمكن القيام بها في الوقت نفسه.
بالمقارنة مع بروتوكولات عزل خلايا الكبد البشرية الأخرى تظهر نتائجنا عوائد خلية مماثلة أو أعلى وviabilities كما نشرت سابقا في البيولوجيا التجريبية والطب 1. لKC العزلة Alabraba وزملاء العمل أظهرت النتائج العزلة بعائد 2.3 × 10 6 قابلة للحياة KC / ز أنسجة الكبد جنبا إلى جنب مع بقاء حوالي 98 13٪، وهي مماثلة للدينا KC (عدد الخلايا: 1.9 × 10 6 قابلة للحياة KC / ز أنسجة الكبد، والنمو حوالي 93٪) النتائج. غالبية البيانات العزلة LEC نشرت تصف العزلة من الأجهزة كلها 15،24. غيرلاخ وزملاء العمل وكذلك لالور وزملاء العمل عزل أعداد الخلايا بين 10 و 3 10 6 خلية / جهاز 15،24. لا يمكن مقارنة هذه البيانات مباشرة إلى الخلية العزلة من عينات الأنسجة. ومع ذلك، باستخدام بروتوكول لدينا أظهرنا العوائد لكرا من 2.7 × 10 5 قابلة للحياة كرا / ز أنسجة الكبد، والتي هي من أكبر بكثير عند استقراء على الجهاز كله. تم عزل شهادة الثانوية العامة مع العائد من حوالي 4.7 × 10 5 / ز أنسجة الكبد قابلة للحياة على شهادة الثانوية العامة وقدرتها على البقاء حوالي 90٪. وأظهرت النتائج القائمة التي نشرتها فريدمان وزملاء العمل نصف الدنيا غلة الخلية (2.3 × 10 5 شهادة الثانوية العامة / ز كبد)، ولكن نقاء مماثلة (91٪) (14). وفيما يتعلق بروتوكول لدينا، يمكن أن يكون سبب غلة خلية منخفضة من خلال نضح سيئة والهضم بسبب انخفاض أو أي تداول 1X الإرواء-محلولن الأول والهضم، الحل داخل الأنسجة. بالإضافة إلى ذلك فقاعات الغاز في الأنسجة يمكن أن تعكر صفو الدورة الدموية داخل أنسجة 1X الإرواء، الحل الأول والهضم-الحل. في هذه الحالات، ونضح يمكن تحسينها عن طريق زيادة ضغط التروية والقضاء على فقاعات الغاز تحامل قنية واحدة و / أو باستخدام ملعقة للدفع مقابل عينة الأنسجة. والجدوى السيئة هي في معظم الحالات نتيجة للإجهاد الخلية. ترتبط الأوقات نقص التروية لفترة طويلة، والضرر ب Ca 2+ استنزاف والتحلل البروتيني للبروتينات الغشاء إلى تلف الخلايا، واضح من الفقاعات من الغشاء الخلوي. من ملاحظاتنا هذه الخلايا وحساسة جدا للإجهاد القص وفي معظم الحالات يموت أثناء إجراء العزل. وباختصار، العزلة ناجحة وفصل متني وغير متني خلايا الكبد يتطلب أن يتم تنفيذ الخطوات الحاسمة في الإطار الزمني الصحيح، يتم تنفيذ الخطوات pipetting لبعناية وبشكل عام الوقت لعزل الخلايا وفصل الصورةأن تبقى hould معها قصيرة قدر الإمكان 21. عيوب بروتوكول صفها هو أن الظروف العزلة (على سبيل المثال، مرات نضح) لا يمكن أن يكون موحد تماما، ولكن إلى أن تتكيف بشكل فردي لنوعية الأنسجة. وبالإضافة إلى ذلك، يمكن للمحصول ونقاء السكان الخلية اكتسبت تختلف في الاعتماد على نوعية الأنسجة ونتائج الهضم.
نشرنا مؤخرا دراسة مما يدل على تأثير الظروف زراعة جنبا إلى جنب مع توصيف وظيفي من كل نوع من الخلايا مجلس الشعب معزولة بسبب هذه الطريقة 1. إمكانية عزل ومستقل السكان مختلفة من الخلايا في الكبد يسمح بإنشاء خلايا الكبد البشري المشترك الثقافات مبتكرة وفي المختبر نماذج الكبد الأنسجة المهندسة. ومن المعروف أن زراعة PHH في 2D أحادية الثقافات يؤدي إلى فقد التمايز وفقدان وظائف الخلية النموذجية 7. لهذا السبب من الضروري أن تحاكي في الجسم الحي آرشي الأنسجةtecture داخل في المختبر نماذج الكبد. كوستادينوفا وزملاء العمل (2013 8،9) وكذلك ميسنر وزملاء العمل (2013 8،9) أنشأت بنجاح نماذج التعاون ثقافة الكبد الوظيفية للكشف عن الآثار السمية الكبدية. ومع ذلك، كان مجلس الشعب لا تتميز ولم التحقيق وظائف محددة في هذه الأنظمة.
لذلك ينبغي أن تركز المزيد من البحوث حول التحقيقات على البقاء على قيد الحياة على المدى الطويل من مجلس الشعب وخصائصها المحددة والتفاعلات داخل المشترك الثقافات. لمثل هذه الدراسات، فإنه يمكن أيضا أن تكون ذات فائدة لوضع بروتوكول لعزل cholangiocytes. تحقيق في المختبر المشترك الثقافات وظيفية بما في ذلك جميع أنواع الخلايا الموجودة في الكبد الأصلي يمكن أن يكون خطوة أخرى في اتجاه الجسم الحي في مثل نماذج الكبد الإنسان.
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
ونود أن نشكر لى جيا ليو لدعمهم في إنشاء الشكل 1. وأيد هذه الدراسة من قبل الوزارة الاتحادية الألمانية للتعليم والبحوث مشروع (BMBF) الكبد الظاهري: 0315741.
Materials
| Name | Company | Catalog Number | Comments |
| General Equipment | |||
| PIPETBOY | Eppendorf | ||
| pipettes | Eppendorf | ||
| microscope | Carl Zeiss | ||
| microscope | Olympus | ||
| CO2-incubator | Binder | ||
| Lamin Air | Heraeus | ||
| Centrifuge Varifuge 3.0R | Heraeus | ||
| Urine Beaker | Sarstedt | 2041101 | |
| perfusor syringe 50 ml | B.Braun | 12F0482022 | |
| Bottle Top Filter | Nalgene | 1058787 | |
| Falcon 50 ml Polypropylene Conical Tube | BD Biosciences | 352070 | |
| Falcon 15 ml Polypropylene Conical Tube | BD Biosciences | 352096 | |
| Tissue Culture plate | BD Biosciences | 533047 | 24 well |
| serological pipettes | BD Biosciences | 357525, 357551, 357543 | 25 ml, 10 ml, 5 ml |
| pipette tips | SARSTEDT | 0220/2278014, 0005/2242011, 0817/2222011 | 100 µl, 200 µl, 1,000 µl |
| Name | Company | Catalog Number | Comments |
| Isolation Equipment | |||
| water bath | Lauda | ||
| peristaltic pump | Carl Roth | ||
| circulation thermostat | Lauda | ||
| pH meter | Schott | ||
| fine scales | Sartorius | ||
| stand | |||
| Büchner funnel | Haldenwanger | ||
| plastic funnel | |||
| silicone tube | |||
| cannulae with olive tips | |||
| glass dish | |||
| forceps | |||
| scalpel | Feather | 12068760 | |
| Neubauer counting chamber | Optic Labor | ||
| cell lifter | Costar | ||
| Surgical Drape | Charité Universitätsmedizin Berlin | A2013027 | |
| compress | Fuhrmann | 40013331 | |
| sterile surgical gloves | Gammex PF | 1203441104 | |
| Tissue glue | B. Braun | 1050052 | |
| glass bottle | VWR | ||
| Collagenase P | Roche | 13349524 | |
| Percoll Separating Solution | Biochrom | L6145 | Density 1.124 g/ml |
| Hank’s BSS | PAA | H00911-3938 | |
| Dulbecco’s PBS | PAA | H15 - 002 | without Mg/Ca |
| Ampuwa | Plastipur | 13CKP151 | |
| Albumin | Sigma-Aldrich | A7906 | |
| NaCl | Merck | 1,064,041,000 | |
| KCl | Merck | 49,361,000 | |
| Hepes Pufferan | Roth | 133196836 | |
| EDTA | Sigma | E-5134 | |
| Name | Company | Catalog Number | Comments |
| Media Equipment | |||
| DMEM | PAA | E15-005 | Low Glucose (1 g/L) (without L-Glutamine) |
| HEPES Buffer Solution 1 M | GIBCO | 1135546 | |
| L-Glutamine | GIBCO | 25030-024 | 200 mM |
| MEM NEAA | GIBCO | 11140-035 | |
| penicillin/streptomycin | GIBCO | 15140-122 | |
| RPMI 1640 | PAA | E15 - 039 | without L-Glutamine |
| Sodium Pyruvate | GIBCO | 1137663 | 100 mM |
| Trypan Blue Solution | Sigma-Aldrich | T8154 | 0.4% |
| William’s E | GIBCO | 32551-020 | |
| with GlutaMAX™ | |||
| EGTA | Sigma-Aldrich | 03780-50G | |
| Fortecortin | Merck | 49367 | 8 mg/2 ml |
| Human-Insulin | Lilly | HI0210 | 100 I.E./ml |
| N-Acetyl cysteine | Sigma-Aldrich | A9165-5G | |
| Fetal calf serum (FCS) | PAA | A15-101 | |
| Name | Company | Catalog Number | Comments |
| Equipment for Immunostainings | |||
| CD 68 | R&D Systems, USA | monoclonal | |
| CK 19 | Santa Cruz | D2309 | polyclonal |
| CK18 | Santa Cruz | K2105 | monoclonal |
| Vimentin | Santa Cruz | monoclonal | |
| GFAP | Sigma Aldrich | monoclonal | |
| Triton X-100 | Sigma Aldrich | 23.472-9 | |
| Goat anti-Mouse IgG1-PE | Santa Cruz | C0712 | |
| Goat anti-rabbit IgG-FITC | Santa Cruz | L0412 | |
| Methanol | J.T.Baker | 1104509006 | |
| Formaldehyde 4% | Herbeta Arzneimittel | 200-001-8 | |
| Bovine serum albumin (BSA) | Sigma Aldrich | A7906-100G |
References
- Pfeiffer, E., et al. Isolation, characterization, and cultivation of human hepatocytes and non-parenchymal liver cells. Exp Biol Med. , Maywood. (2014).
- Si-Tayeb, K., Lemaigre, F. P., Duncan, S. A. Organogenesis and development of the liver. Dev Cell. 18 (2), 175-189 (2010).
- Alpini, G., Phillips, J. O., Vroman, B., LaRusso, N. F. Recent advances in the isolation of liver cells. Hepatology. 20 (2), 494-514 (1994).
- Godoy, P., et al. Recent advances in 2D and 3D in vitro systems using primary hepatocytes, alternative hepatocyte sources and non-parenchymal liver cells and their use in investigating mechanisms of hepatotoxicity, cell signaling and ADME. Arch Toxicol. 87 (8), 1315-1530 (2013).
- Gómez-Lechón, M. J., Castell, J. V., Donato, M. T. Hepatocytes--the choice to investigate drug metabolism and toxicity in man: in vitro variability as a reflection of in vivo. Chem Biol Interact. 168 (1), 30-50 (2007).
- Ginai, M., et al. The use of bioreactors as in vitro models in pharmaceutical research. Drug Discov Today. 18 (19-20), 922-935 (2013).
- Schyschka, L., et al. Hepatic 3D cultures but not 2D cultures preserve specific transporter activity for acetaminophen-induced hepatotoxicity. Arch Toxicol. 87 (8), 1581-1593 (2013).
- Kostadinova, R., et al. A long-term three dimensional liver co-culture system for improved prediction of clinically relevant drug-induced hepatotoxicity. Toxicol Appl Pharmacol. 268 (1), 1-16 (2013).
- Messner, S., Agarkova, I., Moritz, W., Kelm, J. M. Multi-cell type human liver microtissues for hepatotoxicity testing. Arch Toxicol. 87 (1), 209-213 (2013).
- Nussler, A. K., Nussler, N. C., Merk, V., Brulport, M., Schormann, W., Yao, P., Hengstler, J. G. The Holy Grail of Hepatocyte Culturing and Therapeutic Use. Strategies in Regenerative Medicine. Santin, M. , Springer. New York. 1-38 (2009).
- Friedman, S. L., Roll, F. J. Isolation and culture of hepatic lipocytes, Kupffer cells, and sinusoidal endothelial cells by density gradient centrifugation with Stractan. Anal Biochem. 161 (1), 207-218 (1987).
- Knook, D. L., Blansjaar, N., Sleyster, E. C. Isolation and characterization of Kupffer and endothelial cells from the rat liver. Exp Cell Res. 109 (2), 317-329 (1977).
- Alabraba, E. B., et al. A new approach to isolation and culture of human Kupffer cells. J Immunol Methods. 326 (1-2), 139-144 (2007).
- Friedman, S. L., et al. Isolated hepatic lipocytes and Kupffer cells from normal human liver: morphological and functional characteristics in primary culture. Hepatology. 15 (2), 234-243 (1992).
- Lalor, P. F., Lai, W. K., Curbishley, S. M., Shetty, S., Adams, D. H. Human hepatic sinusoidal endothelial cells can be distinguished by expression of phenotypic markers related to their specialised functions in vivo. World J Gastroenterol. 12 (34), 5429-5439 (2006).
- Lee, S. M., Schelcher, C., Demmel, M., Hauner, M., Thasler, W. E. Isolation of human hepatocytes by a two-step collagenase perfusion procedure. J Vis Exp. (79), (2013).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nat Protoc. 1 (6), 2753-2758 (2006).
- Chang, W., et al. Isolation and culture of hepatic stellate cells from mouse liver. Acta Biochim Biophys Sin (Shanghai). 46 (4), 291-298 (2014).
- Zeng, W. Q., et al. A new method to isolate and culture rat kupffer cells. PLoS One. 8 (8), e70832 (2013).
- Tokairin, T., et al. A highly specific isolation of rat sinusoidal endothelial cells by the immunomagnetic bead method using SE-1 monoclonal antibody. J Hepatol. 36 (6), 725-733 (2002).
- Damm, G., et al. Human parenchymal and non-parenchymal liver cell isolation, culture and characterization. Hepatology International. 7, 915-958 (2013).
- Baccarani, U., et al. Isolation of human hepatocytes from livers rejected for liver transplantation on a national basis: results of a 2-year experience. Liver Transpl. 9 (5), 506-512 (2003).
- Shen, L., Hillebrand, A., Wang, D. Q., Liu, M. Isolation and primary culture of rat hepatic cells. J Vis Exp. (64), (2012).
- Gerlach, J. C., et al. Large-scale isolation of sinusoidal endothelial cells from pig and human liver. J Surg Res. 100 (1), 39-45 (2001).



