Abstract
parenchymal hepatocytes के अलावा, जिगर गैर parenchymal कोशिकाओं (एनपीसी) अर्थात् Kupffer कोशिकाओं (सी), जिगर endothelial कोशिकाओं (LEC) और यकृत तारामय कोशिकाओं (एचएससी) के होते हैं। दो आयामी (2 डी) प्राथमिक मानव hepatocyte (PHH) की संस्कृति अभी भी "सोने के मानक 'दवा चयापचय और हेपटोटोक्सिसिटी की इन विट्रो परीक्षण के लिए के रूप में माना जाता है। यह अच्छी तरह से मालूम है कि PHH के 2 डी मोनोकल्चर dedifferentiation और समारोह के नुकसान से ग्रस्त है। हाल ही में यह दिखाया गया है कि यकृत एनपीसी जिगर (patho-) शरीर क्रिया विज्ञान में एक केंद्रीय भूमिका और PHH कार्यों के रखरखाव खेलते हैं। वर्तमान शोध 3 डी और सह संस्कृति मॉडल द्वारा इन विवो ऊतक वास्तुकला के पुनर्निर्माण 2 डी मोनोकल्चर की सीमाओं को पार करने पर केंद्रित है। पहले हम मानव यकृत कोशिकाओं को अलग करने के लिए एक विधि प्रकाशित और प्रायोगिक जीव विज्ञान और चिकित्सा 1 में सेल संस्कृतियों में उनके उपयोग के लिए इन कोशिकाओं की उपयुक्तता की जांच की। इस ते में व्यापक हित के आधार परइस लेख का उद्देश्य chnique एक वीडियो है, जो इस तकनीक का एक आसान प्रजनन की अनुमति देगा सहित जिगर सेल अलगाव की प्रक्रिया के लिए एक अधिक विस्तृत प्रोटोकॉल प्रदान किया गया।
मानव यकृत कोशिकाओं एक दो कदम EGTA / कोलैजिनेज़ पी छिड़काव तकनीक द्वारा शल्य चिकित्सा हस्तक्षेप के मानव जिगर ऊतक के नमूने से अलग थे। PHH में 50 x जी एक प्रारंभिक centrifugation द्वारा एनपीसी से अलग हो गए थे। घनत्व ढाल centrifugation कदम मृत कोशिकाओं को हटाने के लिए इस्तेमाल किया गया। व्यक्तिगत जिगर सेल आबादी विशेष सेल गुण और सेल छँटाई प्रक्रियाओं का उपयोग समृद्ध एनपीसी अंश से अलग थे। PHH अलगाव के अलावा हम आगे की खेती के लिए के.सी., LEC और एचएससी को अलग करने में सक्षम थे।
साथ में ले ली, प्रस्तुत प्रोटोकॉल उच्च गुणवत्ता और एक दाता ऊतक के नमूने से मात्रा में PHH और एनपीसी के अलगाव की अनुमति देता है। शुद्ध जिगर सेल आबादी के लिए उपयोग मानव ली की तरह इन विवो के निर्माण के लिए अनुमति दे सकतादेखें मॉडल।
Introduction
मानव यकृत ऊतक अत्यधिक जटिल है और दो अलग अलग सेल संस्थाओं, parenchymal कोशिकाओं और गैर parenchymal कोशिकाओं (एनपीसी) के होते हैं। Parenchymal जिगर की कोशिकाओं hepatocytes और cholangiocytes शामिल हैं। Hepatocytes कुल जिगर की कोशिकाओं के 60 से 70% का प्रतिनिधित्व करते हैं और चयापचय जिगर कार्यों के अधिकांश के लिए खाते हैं, जैसे, पित्त अम्ल और कारक संश्लेषण, biotransformation और ऊर्जा चयापचय 2,3 के पूरक हैं।
छोटे एनपीसी अंश कुल जिगर की कोशिकाओं के 30-40% का गठन किया। एनपीसी अलग सेल आबादी, अर्थात् Kupffer कोशिकाओं (सी), जिगर endothelial कोशिकाओं (LEC) और यकृत तारामय कोशिकाओं (एचएससी) शामिल हैं। इस heterogenic सेल अंश जिगर की शारीरिक प्रक्रियाओं में एक केंद्रीय भूमिका निभाता है। इसके अतिरिक्त, एनपीसी जैसे, दवा प्रेरित जिगर चोट (दिली) और साथ ही में जीर्ण जिगर की चोट, ऐसे सिरोसिस 4 के रूप में तीव्र जिगर की क्षति, मध्यस्थता में भाग लेते हैं।
हाल के वर्षों में, जउमान जिगर की कोशिकाओं यकृत रोगों में अधिक से अधिक शोध और औषधि परीक्षण, दवा के विकास और नए जैव रासायनिक रास्ते की पहचान के विकास में आवश्यक हो गए हैं। इन विट्रो में परीक्षण के लिए PHH मोनोकल्चर अभी भी "सोने के मानक 'के रूप में माना जाता है 5। वर्तमान homotypic जिगर मॉडल की मुख्य सीमा dedifferentiation और hepatocytes के समारोह के नुकसान के कुछ ही दिनों के भीतर 4 है। 3-आयामी (3 डी) संस्कृति तकनीक की स्थापना से पता चला है कि इन सीमाओं 4,6 मुआवजा दिया जा सकता है। हालांकि, यहां तक कि आधुनिक 3 डी तकनीक संस्कृति कार्यों 7 के सभी यकृतविषकारी मोड प्रदर्शित करने के लिए सक्षम नहीं हैं। मौजूदा इन विट्रो मॉडल में गुम एनपीसी आबादी में विवो स्थिति के लिए इस विसंगति के लिए एक संभावित कारण के रूप में चर्चा कर रहे हैं। यह दिखाया गया है कि विभिन्न जिगर सेल आबादी के बीच सेल सेल संचार शारीरिक homeostasis में एक केंद्रीय भूमिका निभाता है, लेकिन यह भी pathophy मेंsiologic 8 प्रक्रियाओं। इसलिए वैज्ञानिक ध्यान एनपीसी और उनके सेल सेल बातचीत पर अधिक से अधिक जोर देता है। सह संस्कृति और ऊतक इंजीनियर प्रणालियों में उनकी उद्देश्यपूर्ण उपयोग में इन विट्रो जिगर मॉडल 8,9 जो संभव के रूप में विवो स्थिति के लिए करीब के रूप में कर रहे हैं की उच्च मांग के लिए एक समाधान हो सकता है।
वर्तमान में मुख्य चुनौती एक मानकीकृत मानव यकृत सह संस्कृति मॉडल है, जो PHH और एनपीसी की स्पष्ट रूप से परिभाषित भाग शामिल हैं का विकास है। परिणाम में, बहुत heterogenic जिगर की कोशिकाओं के लिए अलगाव तकनीक की जरूरत है और उन शुद्ध सेल आबादी हासिल करने के लिए अनुकूलित किया जाना है। जबकि PHH अलगाव के लिए मानकीकृत प्रोटोकॉल मौजूद 10, मानव एनपीसी के मानकीकृत अलगाव के विकास के अंतर्गत अभी भी है। सबसे प्रकाशित एनपीसी अलगाव प्रोटोकॉल गैर मानव कोशिकाओं 11,12 के साथ प्रयोगों के आधार पर कर रहे हैं। केवल कुछ प्रकाशनों मानव एनपीसी के अलगाव की प्रक्रिया का वर्णन है और सबसे केवल कवरएक एकल कोशिका के अलगाव के लिए तरीकों 11-16 टाइप करें। सबसे महत्वपूर्ण सेल विशेषताओं है कि सेल जुदाई के लिए इस्तेमाल किया गया है आकार, घनत्व, लगाव व्यवहार, और सतह प्रोटीन की अभिव्यक्ति कर रहे हैं। इन विशेषताओं के आधार पर हम एक सरल प्रोटोकॉल को अलग-थलग करने के लिए PHH, के.सी., LEC और एचएससी, जो प्रायोगिक जीवविज्ञान और चिकित्सा 1 में पहले से प्रकाशित किया गया था विकसित किया है। इस तकनीक में व्यापक हित की वजह से, इस लेख का उद्देश्य एक वीडियो है, जो और अधिक आसानी से तकनीक reproducing अनुमति देगा सहित जिगर सेल अलगाव की प्रक्रिया के लिए एक अधिक विस्तृत प्रोटोकॉल प्रदान किया गया। प्रोटोकॉल भी उपज और व्यवहार्यता के मूल्यांकन के लिए के रूप में अच्छी तरह से पहचान और पवित्रता मूल्यांकन विशिष्ट immunostainings प्रयोग करने के लिए गुणवत्ता नियंत्रण के तरीके शामिल हैं।
Subscription Required. Please recommend JoVE to your librarian.
Protocol
नोट: सभी कोशिकाओं resected गैर tumorous मानव जिगर ऊतक, जो प्राथमिक या माध्यमिक जिगर ट्यूमर के साथ आंशिक जिगर लकीर के बाद बने रहे से अलग थे। Universitätsmedizin बर्लिन - रोगियों के बारे में सूचित सहमति Charité के नैतिक दिशा निर्देशों के अनुसार प्राप्त हुई थी।
1. सामग्री और समाधान की तैयारी
- अग्रिम में सभी उपकरणों और सामग्री जीवाणुरहित अलगाव की प्रक्रिया के दौरान जीवाणु संक्रमण से बचने के लिए।
- पाचन-समाधान के अपवाद के जो हौसले से तैयार किया जाता है के साथ, जिगर ऊतक का नमूना, hepatocytes और गैर parenchymal जिगर की कोशिकाओं के अलगाव की प्रक्रिया और टेबल्स 1 और 2 के अनुसार प्राथमिक मानव यकृत कोशिकाओं की खेती के छिड़काव के लिए आवश्यक समाधान तैयार का उपयोग करने से पहले। सभी समाधान 4 डिग्री सेल्सियस पर संग्रहीत किया जा सकता है और इसे तैयार करने के बाद 4 सप्ताह के भीतर उन्हें इस्तेमाल करने की सिफारिश की है।
- बाँझ बनानासभी समाधान 0.22 सुक्ष्ममापी बोतल शीर्ष फिल्टर का उपयोग।
2. छिड़काव उपकरण की तैयारी
- के रूप में चित्रा 1 ए में दिखाया गया है छिड़काव और जिगर ऊतक के नमूने के पाचन के लिए उपकरण सेट करें।
- छिड़काव और पाचन के दौरान इष्टतम कोलैजिनेज़ पी गतिविधि सुनिश्चित करने के लिए 39 डिग्री सेल्सियस के लिए पानी के स्नान के तापमान को समायोजित करें।
3. छिड़काव और जिगर ऊतक के नमूने की पाचन (1.5 घंटे)
- उच्छेदन जिगर ऊतक से एक अक्षुण्ण Glisson कैप्सूल के साथ एक ऊतक का नमूना चयन करें। जब ऊतक का नमूना काटने, अच्छा दिखाई दे जहाजों के साथ एक छोटी सी काटने की सतह प्राप्त करने के लिए प्रयास करें। परिवहन और छिड़काव जब तक बर्फ पर जिगर ऊतक का नमूना से निपटने के द्वारा गर्म ischemia बार से बचें।
- बाँझ शर्तों के तहत ऊतक वजन ले लो और लामिना हवा का प्रवाह में एक पेट्री डिश में जिगर ऊतक का नमूना जगह है। फिर से एक बाँझ सेक के साथ ऊतक का नमूना की सतह को साफरक्त maining और 1x छिड़काव समाधान मैं का उपयोग सुनिश्चित करने के लिए कि सभी प्रवेशनी पारगम्य थे प्रवेशनी सेट फ्लश।
- ऊतक गोंद का प्रयोग कुछ बड़े रक्त वाहिकाओं में cannulas के जैतून ठीक करने के लिए। जिगर ऊतक नमूने का आकार और सतह पर जहाजों की संख्या पर निर्भर करता है, एक प्रवेशनी 3 से 8 cannulas के साथ सेट का उपयोग करें। छिड़काव का परीक्षण और लीकेज के लिए जाँच करें। सभी बंद रक्त वाहिकाओं है, जो लीक स्पष्ट 1x छिड़काव समाधान मैं, ऊतक गोंद के साथ।
- Cannulated जिगर ऊतक का नमूना अपने छिद्रित फिल्टर डिस्क (चित्रा 1 ए) पर Büchner कीप में रखें।
- 7.5 मिलीग्राम / मिनट और 14.6 मिलीग्राम / मिनट के लिए इस्तेमाल किया cannulas की संख्या पर और जिगर ऊतक के प्रतिरोध पर निर्भर करता है के बीच क्रमिक वृत्तों में सिकुड़नेवाला पंप के प्रवाह की दर निर्धारित करें। प्रवाह की दर हर बार समायोजित सुनिश्चित करने के लिए एक मौजूदा लेकिन धीमी गति से छिड़काव नहीं है। ऊतक छिड़कना जब तक पूरे रक्त बाहर प्लावित है, लेकिन कम से कम 20 मिनट। ऊतक अच्छा perfusi के साथ क्षेत्रों में उज्जवल बन निरीक्षणपर।
नोट: कुछ मामलों में, यह प्लास्टिक clamps के साथ cannulas में से एक को दबाना आवश्यक हो सकता है या जिगर कैप्सूल के खिलाफ एक रंग के साथ धीरे से आगे बढ़ाने के द्वारा एक क्षेत्र के भीतरी दबाव बढ़ाने के लिए, छिड़काव करने के लिए अनुकूलन। प्रकाश भूरे रंग के लिए एक हल्के पीले रंग के लिए एक पूरा का रंग बदलने के लिए एक अच्छा छिड़काव इंगित करता है। - पाचन-समाधान कोलैजिनेज़ पी (तालिका 1) से युक्त करने के लिए छिड़काव द्रव बदलें।
- पाचन कदम के लिए सेटअप (चित्रा 1 ए) पुनर्व्यवस्थित करें। इसलिए अप करने के लिए 15 मिनट के लिए चित्रा 1 बी के अनुसार पाचन-समाधान के एक परिपत्र प्रवाह प्रदर्शन करते हैं।
नोट: यह छिड़काव तुरंत रोकने के लिए महत्वपूर्ण है जब जिगर ऊतक का नमूना पर्याप्त रूप से पच जाता है। एक अच्छा पाचन मनाया जा सकता है, के रूप में, कैप्सूल विकृतियों के रखरखाव द्वारा मूल्यांकन जब यह एक रंग के साथ धक्का दिया है जब ऊतक लोच का कोई संकेत नहीं दिखाता है।
4. Hepatocytes के अलगाव (1 घंटा)
- टीक्रमिक वृत्तों में सिकुड़नेवाला पंप बंद कलश और एक गिलास पकवान में जिगर ऊतक का नमूना जगह है। बर्फ के ठंडे बंद करो-समाधान (तालिका 1) के साथ ऊतक के नमूने के बाहर कुल्ला। जिगर ऊतक के नमूने से cannulas निकालें। जिगर ऊतक का नमूना खोलने के लिए, ऐसा क्षेत्र है जहां cannulas जुड़े थे के बीच में incising द्वारा एक छुरी का प्रयोग करें। ध्यान रखना है कि Glisson's कैप्सूल बरकरार रहता रखें।
- ऊतक का नमूना के अंदर कुल्ला और फिर बर्फ के ठंडे बंद करो-समाधान के साथ पूरे ऊतक का नमूना कवर। ऊतक के बाहर की कोशिकाओं को रिहा करने के लिए धीरे ऊतक हिला।
- सेल निलंबन लीजिए और 50 मिलीलीटर की प्लास्टिक ट्यूबों में एक टकटकी कीप (प्लास्टिक कीप धुंध सेक के साथ लाइन में खड़ा) के माध्यम से फिल्टर। जिगर ऊतक का नमूना करने के लिए और अधिक रोकना-समाधान जोड़ने जब तक 500 मिलीलीटर की एक अंतिम मात्रा में सेवन किया जाता है।
- 50 XG, 5 मिनट, 4 डिग्री सेल्सियस पर सेल निलंबन अपकेंद्रित्र। बाद में गैर parenchymal सेल अलगाव के लिए सतह पर तैरनेवाला लीजिए। पीबीएस (चित्रा 2 के साथ सेल गोली धो लेंए)।
- 50 XG, 5 मिनट, 4 डिग्री सेल्सियस पर फिर से सेल निलंबन अपकेंद्रित्र। सतह पर तैरनेवाला लीजिए और Hepatocyte ऊष्मायन माध्यम में गोली (2 टेबल, चित्रा 2 बी) फिर से निलंबित।
- trypan नीले रंग धुंधला का उपयोग परिणामस्वरूप सेल निलंबन में सेल नंबर और व्यवहार्यता का निर्धारण। एक Neubauer गिनती चैम्बर में जीवित और मृत कोशिकाओं की गणना। नीचे सूत्रों का उपयोग सेल नंबर, व्यवहार्यता और PHH की उपज की गणना।
उपज (गिना कोशिकाओं) = गिना कोशिकाओं एक्स सेल निलंबन (एमएल) के कमजोर पड़ने कारक x मात्रा x 10,000
उपज (hepatocytes / (छ जिगर ऊतक का नमूना)) = (उपज (hepatocytes / (एमएल मीडिया)) सेल निलंबन (एमएल) के एक्स मात्रा) / (जिगर ऊतक के नमूने के वजन (छ))
व्यवहार्यता (%) = 100% एक्स (जीवित कोशिकाओं की संख्या) / (कुल सेल नंबर)
5. Hepatocytes का शोधन (1 घंटा)
नोट: यह शुद्धि कदम की सिफारिश की है, तो व्यवहार्यता70% से कम है।
- बर्फ पर सभी चरणों का प्रदर्शन। 5 मिलीलीटर घनत्व ढाल समाधान और घनत्व ढाल centrifugation के लिए 15 मिलीलीटर पीबीएस के मिश्रण से एक 25% घनत्व ढाल तैयार करें।
- 25% घनत्व ढाल परत के शीर्ष पर ध्यान से और धीरे धीरे hepatocyte अमीर सेल निलंबन के बाहर कुल 50 Mio कोशिकाओं की एक अधिकतम डाल सुनिश्चित करने के लिए कि दोनों परतों की एक स्पष्ट विभाजन से हासिल किया है (चित्रा -2)। 1250 XG, 20 मिनट, ब्रेक के बिना 4 डिग्री सेल्सियस (चित्रा 2 डी) में सेंट्रीफ्यूज और सेंट्रीफ्यूज में सावधानी नलियों रखो।
- शेष सेल निलंबन और अंतरावस्था में मृत कोशिकाओं aspirate। वसा की मात्रा पर निर्भर करता है एक भी घनत्व ढाल-समाधान निकालना हो सकता है।
नोट: PHH कम लिपिड सामग्री के साथ एक घने गोली और घनत्व ढाल पूरी तरह से aspirated जा सकता है के रूप में। उच्च लिपिड सामग्री के साथ एक PHH अधिक फैलाना गोली और व्यवहार्य कोशिकाओं का एक बहुत फार्म गोली ऊपर घनत्व ढाल समाधान में रह सकती है। - 50 XG, 5 मिनट, 4 डिग्री सेल्सियस पर फिर से पीबीएस और सेंट्रीफ्यूज के साथ hepatocyte छर्रों फिर से निलंबित। छर्रों पूल, पीबीएस के साथ फिर से धोने और Hepatocyte ऊष्मायन माध्यम में फिर से निलंबित शुद्ध PHH। 4.6 कदम के रूप में वर्णित सेल गिनती प्रदर्शन करना।
6. Hepatocytes की खेती
- , एक बाह्य मैट्रिक्स के साथ उन्हें कोटिंग उदाहरण चूहे की पूंछ कोलेजन (कोलेजन प्रकार मैं) के लिए द्वारा PHH के बोने के लिए सेल संस्कृति व्यंजन तैयार करें। प्रोटोकॉल राजन एट अल द्वारा स्थापित के अनुसार चूहे की पूंछ कोलेजन तैयार करें। 17
- पीबीएस में 200: पतला चूहे की पूंछ कोलेजन स्टॉक समाधान 1। स्थानांतरण 100 μl / 2 सेमी चूहे की पूंछ कोलेजन संस्कृति बर्तन में समाधान ख्याल रख रही है कि पूरी सतह कवर किया जाता है। कमरे के तापमान पर 20 मिनट के लिए सेल संस्कृति प्लास्टिक सेते हैं। शेष चूहे की पूंछ कोलेजन समाधान aspirate।
- संस्कृति dishe पर बीज 15 x 10 4 hepatocytes / 2 सेमी Hepatocyte ऊष्मायन माध्यम मेंचूहे की पूंछ कोलेजन के साथ लेपित रहा है। कम से कम 4 घंटे के लिए 37 डिग्री सेल्सियस, 5% सीओ 2 पर एक humidified इनक्यूबेटर में कोशिकाओं खेती। 4 घंटे के बाद hepatocytes पालन किया है और मध्यम बदला जा सकता है।
- प्रयोगात्मक सेटअप के आधार पर जांच को पूरा करें। 48 घंटा की एक संस्कृति समय कोशिकाओं अलगाव की प्रक्रिया से उबरने के लिए अनुमति देने के लिए सिफारिश की है।
7. गैर parenchymal जिगर की कोशिकाओं के अलगाव (1.5-2 एचआर)
- अपकेंद्रित्र एकत्र सतह पर तैरनेवाला (4.5 कदम और 4.6) 72 XG, 5 मिनट, 4 डिग्री सेल्सियस पर शेष एरिथ्रोसाइट्स और hepatocytes समाप्त करने के लिए। supernatants पूल और उन्हें दो बार अपकेंद्रित्र दो सेल छर्रों हासिल करने के लिए: 300 XG, 5 मिनट, एचएससी, LEC और आंशिक रूप से के.सी. और 650 XG, 7 मिनट, शेष के.सी. के अवसादन के लिए 4 डिग्री सेल्सियस के अवसादन के लिए 4 डिग्री सेल्सियस।
- पूल दोनों छर्रों और उन्हें HBSS में फिर से निलंबित। एक 25% और मिश्रण घनत्व ढाल समाधान और पीबीएस घनत्व ढाल centrif के लिए द्वारा एक 50% घनत्व ढ़ाल तैयारugation (25% घनत्व ढाल समाधान: 5 मिलीलीटर घनत्व ढाल समाधान और 15 मिलीलीटर पीबीएस, 50% घनत्व ढाल समाधान: 10 मिलीलीटर घनत्व ढाल समाधान और 10 मिलीलीटर पीबीएस, चित्रा 2 देखें)। 50% घनत्व ढाल समाधान परत के शीर्ष पर सावधानी से 25% घनत्व ढाल समाधान रखें।
- एक तरीका है कि दोनों परतों की एक स्पष्ट विभाजन हासिल की है में 25% घनत्व ढाल समाधान परत के शीर्ष पर ध्यान से और धीरे धीरे एनपीसी निलंबन रखो।
- अपकेंद्रित्र 1,800 XG, 20 मिनट, ब्रेक के बिना 4 डिग्री सेल्सियस (चित्रा 2.2) पर घनत्व ढाल पर सेल निलंबन।
- महाप्राण मृत कोशिकाओं और ऊपरवाला परत से सेल मलबे। एनपीसी 25% और 50% घनत्व ढाल परत (चित्रा 2) के बीच interphase में स्थित हैं। एनपीसी लीजिए, उन्हें HBSS और सेंट्रीफ्यूज के साथ सेल निलंबन ऊपर वर्णित दोहरी centrifugation कदम को लागू करने धोने (कदम 7.2।)।
8. Kupffer कोशिकाओं के पृथक्करण (पालनजुदाई कदम) (1 घंटा)
- 4.6 कदम के रूप में वर्णित एनपीसी अंश में के.सी. के लिए एक सेल गिनती प्रदर्शन। (निलंबन में के.सी. की उपस्थिति के लिए देखें चित्र 3 बी)। अपकेंद्रित्र ऊपर वर्णित दोहरी centrifugation कदम (कदम 7.2) और फिर से निलंबित एनपीसी Kupffer में सेल बोने मध्यम (तालिका 2) के साथ एनपीसी अंश।
- 5 एक्स 10 5 के.सी. / 2 सेमी के घनत्व पर प्लास्टिक सेल संस्कृति जहाजों पर के.सी. युक्त अंश बीज। 37 डिग्री सेल्सियस पर एक humidified इनक्यूबेटर में 20 मिनट के लिए सी संस्कृतियों सेते हैं, 5% सीओ 2। प्राथमिक के.सी. (चित्रा 2.3) समय की एक छोटी अवधि के भीतर सेल संस्कृति प्लास्टिक पर कायम रहें।
- नहीं पालन एनपीसी युक्त सतह पर तैरनेवाला लीजिए, LEC और एचएससी की मुख्य रूप से शामिल है। LEC के बाद के अलग होने के लिए supernatants पूल (धारा 9 देखें) और एचएससी (धारा 10 देखें)। HBSS के साथ पक्षपाती के.सी. धो और 37 डिग्री सेल्सियस, 5% सीओ पर Kupffer सेल संस्कृति माध्यम (तालिका 2) में उन्हें खेतीएक humidified इनक्यूबेटर में 2।
9. endothelial कोशिकाओं के पृथक्करण (1.5 घंटे)
- अपकेंद्रित्र 300 XG, 5 मिनट, 4 डिग्री सेल्सियस पर एकत्र सतह पर तैरनेवाला (कदम 8.5।)। पीबीएस के साथ गोली धो लें। 300 XG, 5 मिनट, 4 डिग्री सेल्सियस तारामय सेल / Endothelial सेल जुदाई माध्यम से कोशिकाओं को फिर से निलंबित और 4.6 कदम के रूप में वर्णित सभी शेष कोशिकाओं के लिए एक सेल गिनती प्रदर्शन पर centrifugation के बाद।
- 1 मिलीलीटर तारामय सेल / Endothelial सेल जुदाई माध्यम में 1 10 x 7 Mio कोशिकाओं को फिर से निलंबित immunolabeling के लिए 20 μl एमएसीएस-किट से अवरुद्ध समाधान और CD31 माइक्रो मोती के 20 μl जोड़ें और 4 पर 15 मिनट के लिए जिसके परिणामस्वरूप निलंबन सेते डिग्री सेल्सियस तापमान (चित्रा 2.4)।
- एचएससी से अलग LEC चुंबकीय सक्रिय सेल छँटाई प्रणाली एमएसीएस (चित्रा 2.5) के लिए manufacturer's प्रोटोकॉल में वर्णित है। चुंबकीय बरकरार रखा CD31 पॉजिटिव LEC Elute और उन्हें तारामय सी में निलंबितपक्ष / Endothelial सेल संस्कृति के माध्यम से (तालिका 2)।
- 4.6 कदम के रूप में वर्णित सेल LEC के लिए गिनती प्रदर्शन करना। 1.25 x 10 5 कोशिकाओं सेल संस्कृति वाहिकाओं चूहे की पूंछ कोलेजन के साथ लेपित में / 2 सेमी की एक घनत्व में बीज LEC (कदम 6.1 देखें)। एक humidified इनक्यूबेटर में 37 डिग्री सेल्सियस, 5% सीओ 2 कोशिकाओं खेती।
10 तारामय कोशिकाओं के पृथक्करण (0.5 घंटा)
- लेबल हटाया गया एचएससी एमएसीएस प्रक्रिया के दौरान जुदाई स्तंभ गुजरती हैं। एचएससी अंश (, कदम 9.5 देखें चित्र 2.5) ले लीजिए। 4.6 कदम के रूप में वर्णित सेल गिनती प्रदर्शन करना।
- चूहे की पूंछ कोलेजन के साथ लेपित 5 एक्स 10 4 कोशिकाओं / 2 सेमी सेल संस्कृति वाहिकाओं में से एक घनत्व के साथ बीज एचएससी तारामय सेल / Endothelial सेल संस्कृति के माध्यम से (तालिका 2) में (कदम 6.1 देखें) और उन्हें 37 डिग्री सेल्सियस, 5% पर खेती एक humidified इनक्यूबेटर में सीओ 2।
तालिका 1: छिड़काव और अलगाव समाधान।
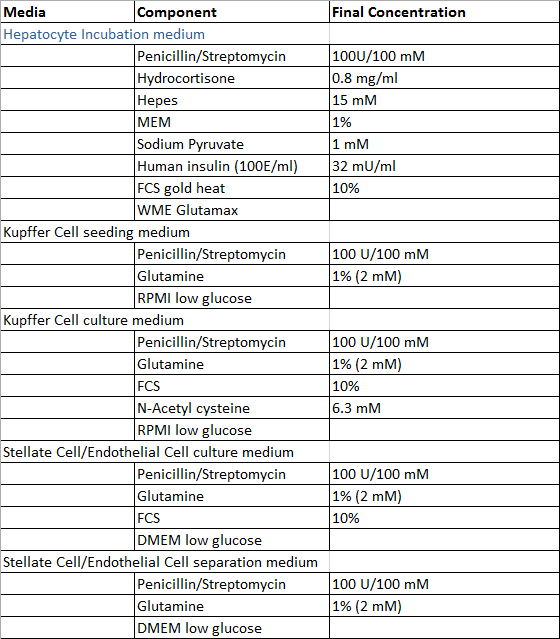
तालिका 2: संस्कृति और अलगाव मीडिया।
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
एक parenchymal और गैर parenchymal अंश में जुदाई, पालन गुण और एमएसीएस के उपयोग के साथ संयुक्त एक साफ-अप प्रक्रिया के रूप में घनत्व ढाल centrifugation का प्रयोग सफल PHH और एनपीसी अलगाव की ओर जाता है। PHH और एनपीसी उच्च गुणवत्ता और मात्रा में अलग किया जा सकता है। चित्रा 1 जिगर छिड़काव और पाचन के लिए उपकरणों के प्रतिनिधि सेटअप पता चलता है। 10% एफसीएस कोलैजिनेज़ छिड़काव युक्त पी को जोड़ा गया है - समाधान द्वितीय proteases की प्रोटिओलिटिक गतिविधि को कम करने के लिए और बदले में कोलैजिनेज़ पी गतिविधि को स्थिर करने के लिए। परिणाम अब पाचन एनपीसी अलगाव के लिए आवश्यक समय में PHH की व्यवहार्यता पर एक नकारात्मक प्रभाव के बिना लागू किया जा सकता है।

चित्रा 1:। छिड़काव और पाचन सेटअप पहला छिड़काव कदम orde में किया जाता हैआर अवशिष्ट रक्त को हटाने, ऊतक को गर्म और 1x perfusions समाधान मैं (पीआई) (ए) का उपयोग करके सेल सेल-कनेक्शन भंग करने के लिए सीए 2 हटा दें। पाचन-समाधान (डीजी) के रिसर्कुलेशन छिड़काव द्वितीय चरण (बी) के दौरान जिगर ऊतक के पाचन के लिए किया जाता है।

चित्रा 2:।। सरलीकृत पूरा PHH और एनपीसी अलगाव की प्रक्रिया की योजनाबद्ध प्रतिनिधित्व प्रायोगिक जीवविज्ञान और चिकित्सा की अनुमति के साथ फीफर एट अल 1, 2014 से संशोधित। सबसे पहले, जिगर ऊतक का नमूना भरकर रखा जाता है और एक दो कदम EGTA / कोलैजिनेज़ पी छिड़काव तकनीक (ए) से पच जाता है। प्राप्त की सेल निलंबन 50 XG, 5 मिनट, 4 डिग्री सेल्सियस (बी), छोटे एनपीसी-अंश से बड़ा PHH-अंश (गोली) को अलग करने के लिए (supern पर शुरू में centrifuged हैatant)। 70% के नीचे एक PHH व्यवहार्यता के मामले में, व्यवहार्य PHH अंश 1,250 XG, 20 मिनट, 4 डिग्री सेल्सियस (सी) ट्यूब के नीचे PHH के निपटाने में जिसके परिणामस्वरूप में एक घनत्व ढाल centrifugation द्वारा समृद्ध बनाया जा सकता है, जबकि मृत कोशिकाओं / सेल मलबे घनत्व ढाल परत (डी) के शीर्ष पर स्थित हैं। 1) 300 XG, 5 मिनट, 4 डिग्री सेल्सियस और 2) 650 XG, 7 मिनट, 4 डिग्री सेल्सियस: प्रारंभिक centrifugation (1) के एकत्र supernatants दो चरणों का उपयोग centrifuged हैं। पहले centrifugation के बाद के.सी. आंशिक रूप से सतह पर तैरनेवाला में स्थित हैं। इस संदर्भ में दूसरी अलगाव कदम आवश्यक है। प्राप्त की सेल छर्रों जमा कर रहे हैं और HBSS में फिर से निलंबित कर दिया। बाद में, सेल निलंबन ध्यान से एक दो परत (25% / 50%) घनत्व ढाल के शीर्ष पर स्तरित हैं। बहुस्तरीय घनत्व ढाल नलियों 1,800 XG, 20 मिनट, 4 डिग्री सेल्सियस पर centrifuged हैं (2)। 25% घनत्व ढाल परत के शीर्ष पर मृत कोशिकाओं को खारिज कर रहे हैं। एनपीसी 25% की अंतरावस्था और 50% के बीच स्थित डीensity ढाल परत एकत्र की है और जमा कर रहे हैं। एनपीसी अंश uncoated सेल संस्कृति प्लास्टिक पर वरीयता दी गई है। एक 20 मिनट ऊष्मायन समय का उपयोग (पालन जुदाई कदम) के.सी. अन्य जिगर सेल आबादी से अलग हो रहे हैं (3)। LEC और एचएससी एमएसीएस-किट का उपयोग कर से अलग होती है। इसलिए एकत्र सतह पर तैरनेवाला में शेष जिगर की कोशिकाओं 300 XG, 5 मिनट, 4 डिग्री सेल्सियस पर centrifuged हैं, और CD31 संयुग्मित microbeads के (4) के साथ लेबल रहे हैं। केवल CD31 नकारात्मक एचएससी एमएसीएस जुदाई स्तंभ (5) से गुजरती हैं। CD31 पॉजिटिव LEC स्तंभ के लिए छड़ी। अंत में स्तंभ चुंबकीय उपकरण और CD31 पॉजिटिव LEC से निकाल दिया जाता स्तंभ (5) से बाहर eluted हैं। यह आंकड़ा का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
पृथक PHH 14.2 x 10 6 ± 6.6 x 10 6 व्यवहार्य PHH / जी जिगर ऊतक की उपज है और एक व्यवहार्यता के बारे में पता चला है 76.6 ± 4.2% (3 टेबल 1)। Microscopically दिखाई सुविधाओं लिपिड बूंदों के साथ संयोजन में एक ठेठ बड़े cytoplasmic मात्रा और एक और चार के बीच नाभिक, (चित्रा 3 ए) थे। सेल आकार निलंबन में 20 से 30 माइक्रोन के बीच होती है।
के.सी. एनपीसी अंश में सबसे आम प्रकार की कोशिका थे। हम लगभग 1.9 पृथक एक्स 10 6 ± 0.2 x 10 92.8 ± 3.5% (3 टेबल 1) के एक व्यवहार्यता के साथ 6 व्यवहार्य के.सी. / जी जिगर ऊतक। के.सी. एक कम कोशिका द्रव्य / नाभिक अनुपात और सतह (चित्रा 3 बी) पर ठेठ microvilli के साथ बहुत छोटे कोशिकाओं (लगभग 5 माइक्रोन) कर रहे हैं।
अंत में हम शेष CD31 नकारात्मक एचएससी से CD31 पॉजिटिव LEC अलग करने के लिए एमएसीएस जुदाई तकनीक का इस्तेमाल किया। LEC की उपज लगभग 2.7 x 10 5 ± 0.1 x 10 5 व्यवहार्य LEC / जी लिव थाएर ऊतक और हासिल की व्यवहार्यता 95.6 ± 2.8% (3 टेबल 1) था। मानदंड पहचान granulae है कई और लघु समय खेती (चित्रा 3G) बारे 10 सुक्ष्ममापी बाद सेल निलंबन (चित्रा 3C) रूप साथ ही विशेषता की धुरी आकार पर एक आकार के है।
अलगाव की प्रक्रिया 89.6 ± 3.8% (3 टेबल 1) के एक व्यवहार्यता के साथ एक एचएससी उपज के बारे में 4.7 x 10 5 ± 0.2 x 10 5 व्यवहार्य एचएससी / जी जिगर (एन = 8) में हुई। सूक्ष्म रूप से पहचान विशेषताओं के बारे में 20 माइक्रोन का एक आकार और लिपिड बूंदों (चित्रा 3 डी) की एक अलग राशि के साथ एक ठेठ दानेदार उपस्थिति थे।
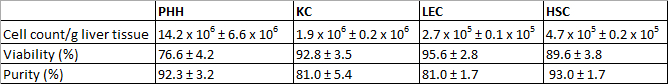
तालिका 3: पैदावार, व्यवहार्यता और पृथक PHH और एन की शुद्धतापीसी। तीन अलग अलग दाताओं का मूल्यांकन किया गया। डेटा के रूप में मतलब ± एसडी दिया जाता है। इस टेबल फीफर एट अल। 1, 2014 में पहले प्रकाशित किया गया था और प्रायोगिक जीव विज्ञान और चिकित्सा से अनुमति के साथ reprinted है।
पहचान और सेल संस्कृति पवित्रता के निर्धारण के लिए, हर पृथक सेल अंश सेल प्रकार विशिष्ट एंटीजन के खिलाफ एंटीबॉडी के साथ इलाज किया गया था। कोशिकाओं फ्लोरोसेंट माध्यमिक एंटीबॉडी के साथ इलाज किया और immunofluorescence माइक्रोस्कोपी द्वारा जांच की गई। पवित्रता Hoechst धुंधला द्वारा कल्पना की कुल सेल नंबर के संबंध में सकारात्मक फ्लोरोसेंट दाग कोशिकाओं की गणना के द्वारा निर्धारित किया गया था।
बाद खेती PHH के 24 घंटा एक विशेषता बहुभुज की आकृति और अक्सर polyploidy (3E चित्रा) से पता चला। PHH सी.के. 18 (चित्रा 3I) के लिए सकारात्मक थे और 92.3 ± 3.2% की एक पवित्रता से पता चला(3 टेबल 1)।
के.सी. सेल संस्कृति प्लास्टिक की सतहों पर 20 मिनट के भीतर पालन किया। बाद एक प्रमुख दौर सेल नाभिक के साथ 24 घंटा छोटे गोल कोशिकाओं के एक ऊष्मायन समय मनाया गया (चित्रा 3F)। सतह प्रोटीन CD68 के.सी. (चित्रा 3J) की पहचान करने के लिए इस्तेमाल किया गया था। CD68 सकारात्मक कोशिकाओं की शुद्धता 81.0 ± 5.4% (3 टेबल 1) की राशि।
एमएसीएस एनपीसी जुदाई के दौरान CD31 लेबलिंग का उपयोग अलगाव के बावजूद यह अभी भी CD31 के साथ अलग LEC दाग के लिए संभव था। इसलिए अलग-थलग और खेती LEC पहचान और पवित्रता के निर्धारण के लिए CD31 के साथ दाग रहे थे। इसके अतिरिक्त LEC mesenchymal सेल मार्कर vimentin (चित्रा 3K) के लिए immunoreactivity दिखाया। हम लगभग सकारात्मक दाग कोशिकाओं (3 टेबल 1) के 81.0 ± 1.7% मनाया। अपने ठेठ प्रमुख लिपिड बूंदों के साथ एचएससी (चित्रा 3H) GFAP (चित्रा 3 एल) के लिए immunofluorescence धुंधला द्वारा चिह्नित किया गया। एचएससी शुद्धता 93.0 ± 1.7% (3 टेबल 1) था।
हर सेल अंश अन्य एनपीसी मार्कर के साथ counterstained गया था। सभी सेल अंशों अन्य जिगर विशिष्ट प्रकार की कोशिकाओं की एक छोटी संख्या निहित है, लेकिन hepatocyte मार्कर CK18 और cholangiocyte मार्कर CK19 के लिए नकारात्मक रहे थे।

। चित्रा 3: मानव parenchymal और निलंबन में और पालन करने के बाद गैर parenchymal जिगर की कोशिकाओं की आकृति विज्ञान बाएँ कॉलम (ए - डी) अलगाव की प्रक्रिया के बाद सीधे अलग अलग जिगर सेल आबादी से पता चलता हैचरण विपरीत माइक्रोस्कोपी दृश्य में: PHH (ए), केसी (बी), LEC (सी), और एचएससी (डी)। मध्य स्तम्भ (ई - एच) की खेती (चरण विपरीत माइक्रोस्कोपी) के 24 घंटे के बाद अलग-थलग और खेती PHH (ई), केसी (एफ), LEC (जी) और एचएससी (एच) की छवियों को प्रस्तुत करता है। अलग सेल अंशों की इम्यूनोफ्लोरेसेंस आधारित लक्षण वर्णन पिछले कॉलम में दिखाया गया है: PHH hepatocyte मार्कर CK18 के लिए सकारात्मक संकेत है (मैं, अलगाव के बाद 24 घंटे), के.सी. मार्कर CD68 के लिए सकारात्मक थे दिखाया (जम्मू, 24 घंटा अलगाव के बाद), LEC vimentin (कश्मीर, अलगाव के बाद 72 घंटा) के लिए सकारात्मक संकेतों से पता चला है और एचएससी GFAP (एल, अलगाव के बाद 72 घंटा) के लिए सकारात्मक थे। सेल नाभिक Hoechst के साथ दाग रहे थे; बढ़ाई: 400X। अनुभव के अनुमति के साथ फीफर एट अल। 1, 2014 से संशोधितimental जीव विज्ञान और चिकित्सा। यह आंकड़ा का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें।
Subscription Required. Please recommend JoVE to your librarian.
Discussion
प्रकाशित प्रोटोकॉल शुद्ध PHH और एनपीसी, अर्थात् के.सी., एचएससी और LEC को अलग-थलग करने के लिए, एक साथ उच्च गुणवत्ता और मानव यकृत ऊतक का एक ही नमूना से पवित्रता में एक तकनीक का वर्णन है। जिगर सेल isolations के साथ काम कर प्रकाशनों के बहुमत को कवर केवल उन सेल आबादी 18-20 और अलगाव प्रक्रियाओं मानव ऊतक के साथ प्रदर्शन में से एक दुर्लभ 21 (डैम एट अल। द्वारा समीक्षा) कर रहे हैं। मानव यकृत के लिए पशु ऊतक (जैसे, चूहा जिगर) के साथ स्थापित तरीकों के adaption जानवर और मानव सेल आबादी के बीच सेल गुणों में कई मतभेद का पता चला। एक जिगर सेल अलगाव अलग जिगर सेल आबादी को कवर विधि की स्थापना से पता चला है कि parenchymal और गैर parenchymal सेल अलगाव के संयोजन पाचन समय अनुकूलित परिणाम के लिए आवश्यक में अंतर के कारण एक महत्वपूर्ण कदम है। इस चुनौती का सामना करना पड़ रहा है कि हम एक जिगर सेल अलगाव विभिन्न तकनीकों के संयोजन प्रोटोकॉल विकसित और अनुकूलितएसई हमारे PHH अलगाव प्रोटोकॉल 10।
द्वारा collagenase समाधान द्वितीय युक्त पी करने के लिए 10% एफसीएस के अलावा हम proteases की प्रोटिओलिटिक गतिविधि को कम करने में सक्षम थे। इस संशोधन अब पाचन बार, एनपीसी की उच्च संख्या पाने के लिए आवश्यक अनुमति दी। परिणाम में हम PHH अलग करने के लिए अच्छी गुणवत्ता के रूप में एनपीसी और उच्च मात्रा में और साथ में सक्षम थे। सफल जिगर सेल अलगाव प्रारंभिक ऊतक गुणवत्ता पर दृढ़ता से निर्भर करता है। दाता डेटा और anamnesis सेल की गुणवत्ता और मात्रा को प्रभावित कर सकते हैं। हमारे अनुभव से दाता विशिष्ट कारकों के साथ कोई संबंध नहीं है और भी बहुत अनुभवी स्टाफ असफल सेल अलगाव को सामना किया जा सकता है। क्योंकि दाता ऊतक की गुणवत्ता में एक महत्वपूर्ण बिंदु है, सभी बाहरी स्रोतों, जो ऊतकों की गुणवत्ता ख़राब हो सकता है, कम से कम किया जाना है।
सबसे महत्वपूर्ण कारकों में ऊतक टी के परिवहन के दौरान शल्य चिकित्सा हस्तक्षेप और ठंड ischemia समय के बाद गर्म ischemia बार कर रहे हैंओ प्रयोगशाला। इसके अतिरिक्त जीवाणु संक्रमण के लिए किसी भी स्रोत से बचा जाना चाहिए। उल्लेखनीय यह है कि कभी कभी अंग ही है, जीवाणु संक्रमण, जैसे शामिल कर सकते हैं पित्त नलिका के रोगों के मामले में है। अलगाव की प्रक्रिया के भीतर महत्वपूर्ण कदम छिड़काव बार और घनत्व ढाल centrifugation कदम को कवर किया। पहला छिड़काव कदम 20-30 मिनट पिछले चाहिए। छोटे छिड़काव बार प्राप्त की सेल निलंबन में सेल समूहों की घटना में जिसके परिणामस्वरूप सेल सेल संपर्कों की अधूरी टुकड़ी को जन्म दे सकती। एक लंबे समय तक पहला छिड़काव सेल व्यवहार्यता कम कर देता है और सीए 2 कमी के कारण सेल तनाव लाती है।
दूसरी छिड़काव एंजाइमी ऊतक पाचन के लिए प्रदर्शन कदम सही समय बिंदु पर प्रोटिओलिटिक प्रतिक्रिया को रोकने के बारे निर्णय लेने के लिए इष्टतम पाचन डिग्री का निर्धारण करने के लिए कुछ अनुभव की आवश्यकता है। कम पाचन बार कम पैदावार और लंबे समय तक पाचन बार नेतृत्व करने के लिए तनाव और कोशिका क्षति सेल।हमारे अनुभव से पाचन के दौरान पचाया नहीं ऊतक और क्षतिग्रस्त ऊतकों के बीच समय सीमा अक्सर 1-3 मिनट की एक खिड़की के भीतर निहित है। एक अधूरी छिड़काव cannulas बंद बन्द रखो के लिए clamps का उपयोग कर एक और क्षेत्र में ऊतक के भीतर दबाव के स्थानांतरण से मुकाबला किया जा सकता है। ऊतक का नमूना की दिशा में एक रंग के साथ इसके अतिरिक्त नरम ऊतक दबाव छिड़काव में एक परिवर्तन की ओर जाता है। ऊतक संकुचित और भीतरी दबाव बढ़ जाती है। बाद में, रक्त वाहिकाओं को भी संकुचित कर रहे हैं और उनके त्रिज्या कम हो जाती है। त्रिज्या में कमी के साथ, प्रतिरोध बढ़ जाती है (हेगन-Poiseuille कानून) और छिड़काव समाधान कम से कम प्रतिरोध और perfuses अन्य क्षेत्रों की तरह से पसंद करते हैं। Baccarani और सह कार्यकर्ताओं के अनुसार हमने देखा कि fibrotic या cirrhotic ऊतक एक लंबी अवधि पाचन सेल viabilities 22 कम करने के लिए अग्रणी की जरूरत है। इस कारण से हम जिगर फाइब्रोसिस या सिरोसिस के साथ रोगियों के ऊतक से बचने के लिए सलाह देते हैं।
तैयारी औरघनत्व ढ़ाल की हैंडलिंग के साथ ही ढ़ाल से बाहर कटाई कोशिकाओं (देखें चरण 5 और 7) भी महत्वपूर्ण कदम को कवर किया। विभिन्न घनत्व ढाल परतों और सेल निलंबन तेज interphases के निर्माण के लिए एक धीमी और सावधान रास्ते में स्थानांतरित किया जाना है। इसके अलावा वहाँ हमेशा जोखिम कोशिकाओं कटाई खासकर जब से निपटने के दौरान ढाल को नुकसान पहुंचा रहा है। एनपीसी जुदाई के दौरान पालन जुदाई कदम बाद में पैदावार और सभी एनपीसी अंशों की शुद्धता के लिए महत्वपूर्ण है। नहीं पालन एनपीसी की सेल नंबर और के.सी. की शुद्धता को बढ़ाने के लिए एक अतिरिक्त धोने कदम सहायक हो सकता है। इस कदम का धोने के समाधान के लिए आगे एनपीसी अलग होने के लिए supernatants के साथ जमा किया जाता है। बैक्टीरिया से संक्रमण से बचने के लिए, कवक या वायरस सख्त सड़न रोकनेवाला शर्तों 23 यह सुनिश्चित किया जाना है।
आवश्यक सेल आबादी की निर्भरता में प्रोटोकॉल बदला जा सकता है और समायोजित विशेष कदम लंघन द्वारा। उदाहरण के लिए यदि केवल के.सी. हैंआवश्यक एनपीसी अवसादन के लिए दोहरी centrifugation कदम दूसरे centrifugation कदम को कम किया जा सकता है और एचएससी और LEC अलग होने के लिए कदम गिरा दिया जा सकता है। छिड़काव बार और centrifugation के लिए जी-फोर्स भी ऊतक और सेल गुणवत्ता की निर्भरता में अलग किया जा सकता है। Fibrotic ऊतक पाचन बार लंबे समय तक की आवश्यकता है, इसलिए सावधानी से ऊतक लोच को नियंत्रित करने की जरूरत है। फैटी hepatocytes में लिपिड बूंदों का संचय सेल घनत्व कम हो जाती है और इसलिए अवसादन गुण बदल जाता है। हमारी टिप्पणियों के अनुसार यह PHH, जब उच्च PHH मात्रा में आवश्यक हैं के लिपिड सामग्री के आधार पर PHH अलगाव के दौरान जी-फोर्स को समायोजित करने के लिए उपयोगी हो सकता है। उल्लेखनीय यह है कि प्रारंभिक centrifugation कदम के किसी भी परिवर्तन की गुणवत्ता और मात्रा के संदर्भ में एनपीसी अलगाव को प्रभावित नकारात्मक होगा है। अब तक हम 50 XG (कम वसा सामग्री के साथ hepatocytes) और 150 XG (उच्च वसा सामग्री के साथ hepatocytes) के बीच जी बलों सलाह देते हैं। इसके अतिरिक्त फैटी HEPAtocytes घनत्व ढाल centrifugation के बाद एक कम कॉम्पैक्ट सेल गोली और आगे सेल कटाई कदम 5.5 में वर्णित के रूप में परिवर्तित हो गया है रूप में करते हैं।
अलगाव की प्रक्रिया के लिए कुछ कदम एक साथ किया जा सकता है की गति। पृथक hepatocytes की शुद्धि के साथ समानांतर में उदाहरण के लिए एक दूसरे व्यक्ति एनपीसी अलगाव के साथ शुरू कर सकते हैं। इसके अतिरिक्त घनत्व ढाल समाधान अग्रिम में तैयार किया जा सकता है। दो से अधिक व्यक्तियों देखते हैं तो और भी अधिक कदम एक ही समय में किया जा सकता है।
के रूप में प्रायोगिक जीवविज्ञान और चिकित्सा 1 में पहले से प्रकाशित अन्य मानव यकृत सेल अलगाव प्रोटोकॉल की तुलना में हमारे परिणाम समान या उच्च सेल पैदावार और viabilities दिखा। के.सी. अलगाव Alabraba और सहकर्मियों 2.3 x 10 6 व्यवहार्य के.सी. / जी जिगर के बारे में 98% 13 वर्ष की एक व्यवहार्यता, जो करने के लिए तुलना कर रहे हैं के साथ संयुक्त ऊतक की उपज के साथ अलगाव के परिणाम प्रदर्शन के लिएहमारे के.सी. परिणाम (सेल नंबर: 1.9 x 10 6 व्यवहार्य के.सी. / जी जिगर ऊतक, व्यवहार्यता के बारे में 93%)। प्रकाशित LEC अलगाव डेटा के बहुमत पूरे अंगों 15,24 से isolations का वर्णन है। Gerlach और सहकर्मियों के साथ ही Lalor और सहकर्मियों 10 3 और 10 6 कोशिकाओं / अंग 15,24 के बीच सेल नंबर को अलग किया। इन आंकड़ों के ऊतकों के नमूनों से isolations सेल सीधे तुलना नहीं की जा सकती है। हालांकि, हमारे प्रोटोकॉल का उपयोग हम 2.7 x 10 5 व्यवहार्य LEC / जी जिगर के ऊतकों, जो जब एक पूरे अंग पर extrapolated अब तक बड़े से कर रहे हैं के लिए LEC पैदावार दिखाया। एचएससी के बारे में 4.7 x 10 5 व्यवहार्य एचएससी / जी जिगर के ऊतकों की एक उपज और 90% के बारे में व्यवहार्यता के साथ अलग थे। फ्राइडमैन और सहकर्मियों द्वारा प्रकाशित मौजूदा परिणामों आधे कम सेल पैदावार (2.3 x 10 5 एचएससी / जी यकृत), लेकिन एक समान पवित्रता (91%) 14 दिखाया। हमारे प्रोटोकॉल के बारे में, कम सेल पैदावार 1x छिड़काव-समाधान के कम या कोई प्रचलन के कारण बुरा छिड़काव और पाचन की वजह से हो सकता हैn मैं और ऊतक के भीतर पाचन-समाधान। इसके अतिरिक्त ऊतक में गैस के बुलबुले 1x छिड़काव समाधान मैं और पाचन-समाधान का इंट्रा-ऊतक परिसंचरण को परेशान कर सकते हैं। इन मामलों में, छिड़काव एकल cannulas clamping और / या ऊतक का नमूना के खिलाफ धकेलने के लिए एक रंग का उपयोग करके छिड़काव दबाव और गैस के बुलबुले के उन्मूलन में वृद्धि से सुधार किया जा सकता है। एक बुरा व्यवहार्यता ज्यादातर मामलों में सेल तनाव का परिणाम है। लम्बे समय तक ischemia बार, सीए 2 कमी और झिल्ली प्रोटीन की प्रोटियोलिसिस द्वारा क्षति क्षति, सेलुलर झिल्ली की blebs द्वारा दिखाई सेल से जुड़े होते हैं। हमारी टिप्पणियों से इन कोशिकाओं को एक बहुत ही संवेदनशील तनाव कतरनी और ज्यादातर मामलों में अलगाव की प्रक्रिया के दौरान मर जाते हैं। सारांश में, सफल अलगाव और parenchymal और गैर parenchymal जिगर की कोशिकाओं की जुदाई की आवश्यकता है कि महत्वपूर्ण कदम सही समय सीमा में प्रदर्शन कर रहे हैं, pipetting कदम सावधानी से और सामान्य में सेल अलगाव और जुदाई एस के लिए समय प्रदर्शन कर रहे हैंHould संभव 21 के रूप में के रूप में कम रखा जाए। वर्णित प्रोटोकॉल का एक नुकसान यह अलगाव की स्थिति (जैसे, छिड़काव बार) पूरी तरह से मानकीकृत नहीं किया जा सकता है, लेकिन ऊतक गुणवत्ता के लिए व्यक्तिगत रूप से अनुकूलित किया जाना है। इसके अलावा, उपज और प्राप्त की सेल आबादी की शुद्धता के ऊतकों की गुणवत्ता और पाचन परिणाम की निर्भरता में भिन्न हो सकते हैं।
हमने हाल ही में खेती की स्थिति प्रत्येक एनपीसी सेल इस विधि 1 से अलग प्रकार के कार्यात्मक विशेषताओं के साथ संयुक्त के प्रभाव का प्रदर्शन एक अध्ययन प्रकाशित किया। संभावना को अलग-थलग करने के लिए और जिगर के अलग अलग सेल आबादी अभिनव मानव यकृत सेल सह संस्कृतियों और ऊतक इंजीनियर इन विट्रो जिगर मॉडल के निर्माण की अनुमति देता है। यह सर्वविदित है कि 2 डी मोनो संस्कृतियों में PHH खेती dedifferentiation और ठेठ सेल कार्यों 7 का नुकसान होता है। इस कारण से यह इन विवो ऊतक Archi नकल करने के लिए आवश्यक हैइन विट्रो जिगर मॉडल के भीतर tecture। Kostadinova और सहकर्मियों (2013 8,9) के साथ ही मेसनर और सहकर्मियों (2013 8,9) सफलतापूर्वक यकृतविषकारी प्रभाव का पता लगाने के लिए कार्यात्मक सह संस्कृति जिगर मॉडल की स्थापना की। हालांकि, एनपीसी की विशेषता नहीं कर रहे थे और विशिष्ट कार्यों के इन पद्धतियों में जांच नहीं कर रहे थे।
इसलिए आगे के शोध के सह-संस्कृतियों के भीतर एनपीसी के लंबे समय तक जीवित रहने पर जांच, उनकी विशिष्ट विशेषताओं और बातचीत पर ध्यान केंद्रित करना चाहिए। इस तरह के अध्ययन के लिए, यह भी cholangiocytes के अलगाव के लिए एक प्रोटोकॉल स्थापित करने के लिए ब्याज की हो सकती है। सभी प्रकार की कोशिकाओं मूल निवासी जिगर में निहित सहित कार्यात्मक इन विट्रो सह संस्कृतियों का बोध मानव यकृत मॉडल की तरह इन विवो की दिशा में एक और कदम हो सकता है।
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
0315741: हम निर्माण में उनके समर्थन चित्रा 1 के इस अध्ययन एजुकेशन एंड रिसर्च (BMBF) परियोजना आभासी जिगर के जर्मन संघीय मंत्रालय द्वारा समर्थित किया गया था के लिए जिया ली लियू को धन्यवाद देना चाहूंगा।
Materials
| Name | Company | Catalog Number | Comments |
| General Equipment | |||
| PIPETBOY | Eppendorf | ||
| pipettes | Eppendorf | ||
| microscope | Carl Zeiss | ||
| microscope | Olympus | ||
| CO2-incubator | Binder | ||
| Lamin Air | Heraeus | ||
| Centrifuge Varifuge 3.0R | Heraeus | ||
| Urine Beaker | Sarstedt | 2041101 | |
| perfusor syringe 50 ml | B.Braun | 12F0482022 | |
| Bottle Top Filter | Nalgene | 1058787 | |
| Falcon 50 ml Polypropylene Conical Tube | BD Biosciences | 352070 | |
| Falcon 15 ml Polypropylene Conical Tube | BD Biosciences | 352096 | |
| Tissue Culture plate | BD Biosciences | 533047 | 24 well |
| serological pipettes | BD Biosciences | 357525, 357551, 357543 | 25 ml, 10 ml, 5 ml |
| pipette tips | SARSTEDT | 0220/2278014, 0005/2242011, 0817/2222011 | 100 µl, 200 µl, 1,000 µl |
| Name | Company | Catalog Number | Comments |
| Isolation Equipment | |||
| water bath | Lauda | ||
| peristaltic pump | Carl Roth | ||
| circulation thermostat | Lauda | ||
| pH meter | Schott | ||
| fine scales | Sartorius | ||
| stand | |||
| Büchner funnel | Haldenwanger | ||
| plastic funnel | |||
| silicone tube | |||
| cannulae with olive tips | |||
| glass dish | |||
| forceps | |||
| scalpel | Feather | 12068760 | |
| Neubauer counting chamber | Optic Labor | ||
| cell lifter | Costar | ||
| Surgical Drape | Charité Universitätsmedizin Berlin | A2013027 | |
| compress | Fuhrmann | 40013331 | |
| sterile surgical gloves | Gammex PF | 1203441104 | |
| Tissue glue | B. Braun | 1050052 | |
| glass bottle | VWR | ||
| Collagenase P | Roche | 13349524 | |
| Percoll Separating Solution | Biochrom | L6145 | Density 1.124 g/ml |
| Hank’s BSS | PAA | H00911-3938 | |
| Dulbecco’s PBS | PAA | H15 - 002 | without Mg/Ca |
| Ampuwa | Plastipur | 13CKP151 | |
| Albumin | Sigma-Aldrich | A7906 | |
| NaCl | Merck | 1,064,041,000 | |
| KCl | Merck | 49,361,000 | |
| Hepes Pufferan | Roth | 133196836 | |
| EDTA | Sigma | E-5134 | |
| Name | Company | Catalog Number | Comments |
| Media Equipment | |||
| DMEM | PAA | E15-005 | Low Glucose (1 g/L) (without L-Glutamine) |
| HEPES Buffer Solution 1 M | GIBCO | 1135546 | |
| L-Glutamine | GIBCO | 25030-024 | 200 mM |
| MEM NEAA | GIBCO | 11140-035 | |
| penicillin/streptomycin | GIBCO | 15140-122 | |
| RPMI 1640 | PAA | E15 - 039 | without L-Glutamine |
| Sodium Pyruvate | GIBCO | 1137663 | 100 mM |
| Trypan Blue Solution | Sigma-Aldrich | T8154 | 0.4% |
| William’s E | GIBCO | 32551-020 | |
| with GlutaMAX™ | |||
| EGTA | Sigma-Aldrich | 03780-50G | |
| Fortecortin | Merck | 49367 | 8 mg/2 ml |
| Human-Insulin | Lilly | HI0210 | 100 I.E./ml |
| N-Acetyl cysteine | Sigma-Aldrich | A9165-5G | |
| Fetal calf serum (FCS) | PAA | A15-101 | |
| Name | Company | Catalog Number | Comments |
| Equipment for Immunostainings | |||
| CD 68 | R&D Systems, USA | monoclonal | |
| CK 19 | Santa Cruz | D2309 | polyclonal |
| CK18 | Santa Cruz | K2105 | monoclonal |
| Vimentin | Santa Cruz | monoclonal | |
| GFAP | Sigma Aldrich | monoclonal | |
| Triton X-100 | Sigma Aldrich | 23.472-9 | |
| Goat anti-Mouse IgG1-PE | Santa Cruz | C0712 | |
| Goat anti-rabbit IgG-FITC | Santa Cruz | L0412 | |
| Methanol | J.T.Baker | 1104509006 | |
| Formaldehyde 4% | Herbeta Arzneimittel | 200-001-8 | |
| Bovine serum albumin (BSA) | Sigma Aldrich | A7906-100G |
References
- Pfeiffer, E., et al. Isolation, characterization, and cultivation of human hepatocytes and non-parenchymal liver cells. Exp Biol Med. , Maywood. (2014).
- Si-Tayeb, K., Lemaigre, F. P., Duncan, S. A. Organogenesis and development of the liver. Dev Cell. 18 (2), 175-189 (2010).
- Alpini, G., Phillips, J. O., Vroman, B., LaRusso, N. F. Recent advances in the isolation of liver cells. Hepatology. 20 (2), 494-514 (1994).
- Godoy, P., et al. Recent advances in 2D and 3D in vitro systems using primary hepatocytes, alternative hepatocyte sources and non-parenchymal liver cells and their use in investigating mechanisms of hepatotoxicity, cell signaling and ADME. Arch Toxicol. 87 (8), 1315-1530 (2013).
- Gómez-Lechón, M. J., Castell, J. V., Donato, M. T. Hepatocytes--the choice to investigate drug metabolism and toxicity in man: in vitro variability as a reflection of in vivo. Chem Biol Interact. 168 (1), 30-50 (2007).
- Ginai, M., et al. The use of bioreactors as in vitro models in pharmaceutical research. Drug Discov Today. 18 (19-20), 922-935 (2013).
- Schyschka, L., et al. Hepatic 3D cultures but not 2D cultures preserve specific transporter activity for acetaminophen-induced hepatotoxicity. Arch Toxicol. 87 (8), 1581-1593 (2013).
- Kostadinova, R., et al. A long-term three dimensional liver co-culture system for improved prediction of clinically relevant drug-induced hepatotoxicity. Toxicol Appl Pharmacol. 268 (1), 1-16 (2013).
- Messner, S., Agarkova, I., Moritz, W., Kelm, J. M. Multi-cell type human liver microtissues for hepatotoxicity testing. Arch Toxicol. 87 (1), 209-213 (2013).
- Nussler, A. K., Nussler, N. C., Merk, V., Brulport, M., Schormann, W., Yao, P., Hengstler, J. G. The Holy Grail of Hepatocyte Culturing and Therapeutic Use. Strategies in Regenerative Medicine. Santin, M. , Springer. New York. 1-38 (2009).
- Friedman, S. L., Roll, F. J. Isolation and culture of hepatic lipocytes, Kupffer cells, and sinusoidal endothelial cells by density gradient centrifugation with Stractan. Anal Biochem. 161 (1), 207-218 (1987).
- Knook, D. L., Blansjaar, N., Sleyster, E. C. Isolation and characterization of Kupffer and endothelial cells from the rat liver. Exp Cell Res. 109 (2), 317-329 (1977).
- Alabraba, E. B., et al. A new approach to isolation and culture of human Kupffer cells. J Immunol Methods. 326 (1-2), 139-144 (2007).
- Friedman, S. L., et al. Isolated hepatic lipocytes and Kupffer cells from normal human liver: morphological and functional characteristics in primary culture. Hepatology. 15 (2), 234-243 (1992).
- Lalor, P. F., Lai, W. K., Curbishley, S. M., Shetty, S., Adams, D. H. Human hepatic sinusoidal endothelial cells can be distinguished by expression of phenotypic markers related to their specialised functions in vivo. World J Gastroenterol. 12 (34), 5429-5439 (2006).
- Lee, S. M., Schelcher, C., Demmel, M., Hauner, M., Thasler, W. E. Isolation of human hepatocytes by a two-step collagenase perfusion procedure. J Vis Exp. (79), (2013).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nat Protoc. 1 (6), 2753-2758 (2006).
- Chang, W., et al. Isolation and culture of hepatic stellate cells from mouse liver. Acta Biochim Biophys Sin (Shanghai). 46 (4), 291-298 (2014).
- Zeng, W. Q., et al. A new method to isolate and culture rat kupffer cells. PLoS One. 8 (8), e70832 (2013).
- Tokairin, T., et al. A highly specific isolation of rat sinusoidal endothelial cells by the immunomagnetic bead method using SE-1 monoclonal antibody. J Hepatol. 36 (6), 725-733 (2002).
- Damm, G., et al. Human parenchymal and non-parenchymal liver cell isolation, culture and characterization. Hepatology International. 7, 915-958 (2013).
- Baccarani, U., et al. Isolation of human hepatocytes from livers rejected for liver transplantation on a national basis: results of a 2-year experience. Liver Transpl. 9 (5), 506-512 (2003).
- Shen, L., Hillebrand, A., Wang, D. Q., Liu, M. Isolation and primary culture of rat hepatic cells. J Vis Exp. (64), (2012).
- Gerlach, J. C., et al. Large-scale isolation of sinusoidal endothelial cells from pig and human liver. J Surg Res. 100 (1), 39-45 (2001).



