Abstract
Foruten parenkymatøs hepatocytter, leveren består av ikke-parenkymceller (NPC) nemlig Kupffer celler (KC), lever endotelceller (LMU) og leverstellate celler (HSC). To-dimensjonale (2D) kultur primære humane hepatocytter (PHH) er fortsatt betraktet som "gullstandard" for in vitro testing av legemiddelmetabolisme og levertoksisitet. Det er velkjent at 2D monokultur av PHH lider dedifferentiation og tap av funksjon. Nylig ble det vist at lever NPC spille en sentral rolle i leveren (patho-) fysiologi og vedlikehold av PHH funksjoner. Aktuell forskning fokuserer på rekonstruksjon av in vivo vevsarkitektur av 3D- og co-kultur modeller for å overvinne begrensninger av 2D monokulturer. Tidligere publiserte vi en fremgangsmåte for å isolere humane leverceller og undersøkt egnetheten av disse cellene for deres anvendelse i cellekulturer i Experimental Biology and Medicine 1. Basert på den brede interessen for denne technique målet med denne artikkelen var å tilveiebringe en mer detaljert protokoll for levercelleisolasjon fremgangsmåte som omfatter en video, noe som vil tillate en enkel gjengivelse av denne teknikken.
Humane leverceller ble isolert fra humane levervev prøver av kirurgiske inngrep ved en to-trinns EGTA / kollagenase P perfusjon teknikk. PHH ble skilt fra NPC ved en innledende sentrifugering ved 50 x g. Tetthetsgradient-sentrifugering fremgangsmåten ble anvendt for å fjerne døde celler. Individuell levercellepopulasjoner ble isolert fra den anrikede NPC brøk med spesifikke celleegenskaper og celle sortering prosedyrer. Ved siden av PHH isolasjon vi var i stand til å skille KC, LEC og HSC for videre dyrking.
Til sammen gir det fremlagte protokollen isolering av PHH og NPC i høy kvalitet og kvantitet fra en donor vevsprøve. Tilgangen til rensede leveren celle populasjoner kunne tillate etablering av in vivo som menneskelig liver modeller.
Introduction
Menneskelig levervev er svært sammensatt og består av to forskjellige celle enheter, parenkymceller og ikke-parenkymceller (NPC). Parenkymatøs leverceller inkluderer hepatocytter og cholangiocytes. Hepatocytter representerer 60-70% av totale leverceller og står for det meste av de metabolske leverfunksjoner, for eksempel gallesyre og utfylle faktor syntese, biotransformasjon og energiomsetningen 2,3.
Den mindre NPC fraksjon utgjør 30-40% av totale leverceller. NPC omfatter ulike cellepopulasjoner, nemlig Kupffer celler (KC), lever endotelceller (LMU) og leverstel celler (HSC). Denne heterogen cellefraksjon spiller en sentral rolle i fysiologiske prosesser i leveren. I tillegg, NPC delta i mediering av akutt leverskade, for eksempel medikament-indusert leverskade (Tai) så vel som i kronisk leverskade, slik som cirrhose 4.
I de senere år, hUman leverceller har blitt mer og mer viktig i forskning og utvikling av narkotika testing, narkotika utvikling og identifisering av nye biokjemiske mekanismer i leversykdommer. For in vitro testing PHH monokulturer er fortsatt anses som "gullstandard" 5. Den største begrensningen av dagens homotypisk lever modeller er dedifferentiation og tap av funksjon av hepatocytter i løpet av få dager 4. Etableringen av tre-dimensjonale (3D) kulturteknikker har vist at disse begrensningene kan kompenseres 4,6. Men selv moderne 3D kultur teknikker ikke er i stand til å vise alle hepatotoksiske moduser av handlinger 7. Manglende NPC populasjoner i de eksisterende in vitro modeller er diskutert som en mulig årsak til dette avviket til in vivo situasjonen. Det er blitt vist at celle-celle-kommunikasjon mellom de forskjellige levercellepopulasjoner spiller en sentral rolle i fysiologisk homeostase, men også i pathophysiologic behandler åtte. Derfor vitenskapelig oppmerksomhet fokuserer mer og mer på NPC og deres celle-celle interaksjoner. Deres målrettet anvendelse i ko-kultur og vev konstruerte systemer kan være en løsning for den store etterspørselen av in vitro-modeller lever 8,9 som er så nær opp til in vivo-situasjonen som mulig.
Dag den viktigste utfordringen er å utvikle en standardisert human lever ko-kulturmodell, som inneholder klart definerte partier av PHH og NPC. Som følge herav blir isoleringsteknikker for å få de heterogene leverceller er nødvendig, og de må være optimalisert for å oppnå rene cellepopulasjoner. Mens standardiserte protokoller for PHH isolasjon eksistere 10, er den standardiserte isolering av humant NPC fremdeles under utvikling. De fleste publiserte NPC isolasjon protokoller er basert på eksperimenter med ikke-humane celler 11,12. Bare noen få publikasjoner beskriver isolasjonsprosess av menneskelig NPC og mest dekker barefremgangsmåter for isolering av en enkelt celletype 11-16. De mest viktige cellekarakteristikker som er blitt utnyttet for celleseparasjon er størrelse, tetthet, tilknytning oppførsel, og ekspresjon av overflateproteiner. På grunnlag av disse egenskapene vi utviklet en forenklet protokoll for å isolere PHH, KC, LEC og HSC, som ble publisert tidligere i Experimental Biology og Medicine 1. På grunn av stor interesse i denne teknikk, er formålet med denne artikkelen var å tilveiebringe en mer detaljert protokoll for levercelleisolasjon fremgangsmåte som omfatter en video, som vil tillate kopiering av teknikken lettere. Protokollen omfatter også kvalitetskontroll metoder for evaluering av utbytte og levedyktighet, så vel som for identifisering og renhet evaluering ved hjelp av bestemte immunostainings.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Merk: Alle celler ble isolert fra resected ikke-tumorous human lever vev, som forble etter delvis leverreseksjon med primær eller sekundær leversvulster. Informert samtykke fra pasientene ble oppnådd i henhold til de etiske retningslinjene fra Charité - Universitätsmedizin Berlin.
1. Utarbeidelse av materialer og løsninger
- Sterilisere alle instrumenter og materialer på forhånd for å unngå bakteriell forurensning under isolasjon prosessen.
- Fremstille de løsninger som er nødvendige for perfusjon av leveren vevsprøve, isolering prosessen med hepatocytter og ikke-parenchymale leverceller og dyrking av primære humane leverceller i henhold til tabell 1 og 2, med unntak av Digestion-løsning som fremstilles fersk før bruk. Alle oppløsninger kan lagres ved 4 ° C, og det anbefales å bruke dem i løpet av 4 uker etter fremstillingen.
- Steriliserealle løsninger ved hjelp av en 0,22 mikrometer flaske topp filter.
2. Utarbeidelse av Perfusjons Utstyr
- Sett opp utstyr for perfusjon og fordøyelse av leveren vevsprøve som vist i figur 1A.
- Juster vannbad temperaturen til 39 ° C for å sikre optimal kollagenase P aktivitet under perfusjon og fordøyelsen.
3. Perfusjon og fordøyelse av leveren vev Sample (1,5 timer)
- Velg en vevsprøve med en intakt Glisson sin kapsel fra resected leveren vev. Når du kutter vevsprøve, prøv å få en liten snittflaten med gode synlige fartøy. Unngå varme iskemi ganger ved transport og håndtering av leveren vevsprøve på is inntil perfusjon.
- Ta vevet vekt under sterile betingelser og plassere leveren vevsprøve i en petriskål i den laminære luftstrøm. Rengjøre overflaten av vevsprøve med en steril kompress fra remaining blod og skylle kanylen innstilt med 1x Perfusjons-løsning jeg for å sikre at alle kanyle var gjennomtrengelig.
- Bruk vev lim for å fikse oliven av kanyler i noen større blodkar. Avhengig av størrelsen av leveren vevsprøve og antallet av skip på overflaten, benyttes en kanyle satt med 3 til 8 kanyler. Test perfusjon og se etter lekkasjer. Lukk alle blodkar, som lekker klar 1x Perfusjons-løsning jeg, med vev lim.
- Plasser cannulated leveren vevsprøve til Buchner-trakten på sin perforerte filterskive (figur 1A).
- Angi strømningshastigheten av den peristaltiske pumpe mellom 7.5 ml / min og 14,6 ml / min, avhengig av antallet kanyler som brukes og av motstanden av levervevet. Regulere strømningshastigheten hver gang for å sikre at det er en strøm, men langsom perfusjon. Perfuse vevet til helblodet blir spylt ut, men minst 20 min. Observer vev blir lysere i områder med gode perfusipå.
Merk: I enkelte tilfeller kan det være nødvendig å fastklemme et av kanyler med plast klemmer eller for å øke det indre trykk i et område ved å skyve forsiktig med en spatel mot leverkapselen, for å optimalisere perfusjon. En fullstendig fargeforandring til en lys gul til lys brunlig farge angir en god perfusjon. - Endre perfusjonsvæsken til fordøyelse-oppløsning inneholdende kollagenase P (tabell 1).
- Omorganisere oppsettet (figur 1A) for trinnet fordøyelsen. Derfor utføre en sirkulær strøm av Digestion-løsning i henhold til figur 1B i opptil 15 min.
Merk: Det er viktig å stoppe perfusjon umiddelbart når leveren vevsprøve er tilstrekkelig fordøyd. En god fordøyelse kan observeres, når vevet viser ingen tegn til elastisitet som vurdert ved vedlikehold av kapsel deformasjoner, når det skyves med en spatel.
4. Isolering av hepatocytter (1 time)
- Turne den peristaltiske pumpen og legg leveren vevsprøve i et glassfat. Skyll utsiden av vevsprøve med iskald stopp-løsning (tabell 1). Fjern kanyler fra leveren vevsprøve. Bruke en skalpell til å åpne leveren vevsprøve, ved incising i midten av området der kanyler var festet. Hold omsorg at Glisson's kapselen forblir intakt.
- Skyll innsiden av vevsprøve og deretter dekke hele vevsprøve med iskald stopp-løsning. Rist forsiktig vev for å frigjøre cellene ut av vevet.
- Samle cellesuspensjonen og filtrere det gjennom et blikk trakt (plast trakt foret med gas kompress) i 50 ml plastrør. Tilsett mer stopp-løsning til leveren vevsprøve til et sluttvolum på 500 ml er fortært.
- Sentrifuger cellesuspensjonen ved 50 x g, 5 min, 4 ° C. Samle supernatanten for senere ikke-parenchymal celleisolasjon. Vask cellepelleten med PBS (figur 2A).
- Sentrifuger cellesuspensjonen på nytt ved 50 x g, 5 min, 4 ° C. Samle supernatanten og re-suspendere pelleten i hepatocytter Inkubasjon medium (tabell 2, figur 2B).
- Bestemme celletallet og levedyktigheten i den resulterende cellesuspensjonen ved hjelp av trypanblått-farving. Telle levende og døde celler i et Neubauer tellekammer. Beregn celle nummer, levedyktighet og utbytte av PHH hjelp av formler nedenfor.
utbytte (regnet celler) = telles celler x fortynningsfaktor x volum av cellesuspensjon (ml) x 10 000
utbytte (hepatocytter / (g levervev prøve)) = (utbytte (hepatocytter / (ml media)) x volum av cellesuspensjon (ml)) / (vekt av levervev prøve (g))
levedyktighet (%) = 100% x (antall levende celler) / (total celle nummer)
5. Rensing av hepatocytter (1 time)
Merk: Denne rensetrinnet anbefales, hvis levedyktigheter lavere enn 70%.
- Utføre alle trinnene på is. Fremstille en densitetsgradient på 25% ved å blande 5 ml densitetsgradient-oppløsning og 15 ml PBS for tetthetsgradient-sentrifugering.
- Sette et maksimum på 50 Mio cellene i en samlet ut av hepatocytter rikt cellesuspensjonen langsomt og forsiktig på toppen av den 25% densitetsgradient lag for å sikre at en klar adskillelse av begge sjikt oppnås (figur 2C). Sette rørene forsiktig inn i sentrifugen og sentrifuger ved 1250 xg, 20 min, 4 ° C uten brems (figur 2D).
- Aspirer værende cellesuspensjonen og døde celler i interfase. Avhengig av fettinnholdet kan man også suge densitetsgradient-løsning.
Merk: PHH med lavt fettinnhold danne en tett pellet og den densitetsgradient kan suget fullstendig. PHH med høyt lipidinnhold danne en mer diffus pellet og en masse av levedyktige celler kan forbli i densitetsgradient løsningen ovenfor pelleten. - Re-suspendere hepatocytter pellets med PBS og sentrifuger på nytt ved 50 x g, 5 min, 4 ° C. Pool pellets, vaske igjen med PBS og re-suspendere renset PHH i hepatocytter Inkubasjon medium. Utfør celletelling slik det er beskrevet i trinn 4,6.
6. Dyrking av hepatocytter
- Forbered cellekultur retter for såing av PHH av belegg dem med en ekstracellulær matrise, for eksempel rottehalecollagen (kollagen type I). Klargjør rottehalecollagen i henhold til den protokoll etablert av Rajan et al. 17
- Fortynn rottehalecollagen stamløsning på 1: 200 i PBS. Overføring 100 mL / cm 2 rottehalecollagen løsning i kulturen retter, ta vare at hele overflaten er dekket. Inkuber cellekulturplast i 20 minutter ved romtemperatur. Aspirer værende rottehalecollagen løsning.
- Seed 15 x 10 4 hepatocytter / cm 2 i hepatocytter Inkubasjon medium på kultur dishes belagt med rottehale kollagen. Dyrke cellene i en fuktet inkubator ved 37 ° C, 5% CO2 i minst 4 timer. Etter 4 timer hepatocyttene har klebet, og mediet kan endres.
- Utføre undersøkelser avhengig av det eksperimentelle oppsettet. En kultur tid på 48 timer er anbefalt å la cellene å komme seg fra isolasjon prosessen.
7. Isolering av ikke-parenkymatøs leverceller (1,5-2 timer)
- Sentrifuger samles supernatanten (trinn 4,5 og 4,6) ved 72 x g, 5 min, 4 ° C for å fjerne de resterende erytrocytter og hepatocytter. Pool supernatants og sentrifuge dem to ganger for å oppnå to cellepellets: 300 xg, 5 min, 4 ° C for avleiring av HSC, LEC og dels KC og 650 xg, 7 min, 4 ° C for sedimentering av det gjenværende KC.
- Pool både pellets og re-suspendere dem i HBSS. Forbered en 25% og en 50% tetthet gradienter ved å blande tettshetsgradient løsning og PBS for tettshetsgradient sentrifugeugation (25% densitetsgradient oppløsning: 5 ml densitetsgradient-oppløsning og 15 ml PBS, 50% densitetsgradient oppløsning: 10 ml densitetsgradient oppløsning og 10 ml PBS, se figur 2). Plasser 25% densitetsgradient oppløsningen forsiktig på toppen av densitetsgradienten løsning lag 50%.
- Sett NPC suspensjonen langsomt og forsiktig på toppen av densitetsgradienten oppløsning lag 25% på en måte som en klar adskillelse av begge lag er oppnådd.
- Sentrifuger cellesuspensjonen på den densitetsgradient ved 1800 xg, 20 min, 4 ° C uten brems (figur 2.2).
- Sug av døde celler og celleavfall fra det øverste laget. NPC er plassert i grenseflaten mellom 25% og 50% tettshetsgradient lag (figur 2). Samle NPC, vaske dem med HBSS og sentrifuger cellesuspensjonen å anvende den ovenfor beskrevne doble sentrifugeringstrinn (trinn 7.2.).
8. Separering av Kupffer celler (EtterlevelseSeparasjonstrinn) (1 time)
- Utføre en celletelling for KC i NPC fraksjonen som beskrevet i trinn 4.6. (For utseendet på KC i suspensjon se Figur 3B). Sentrifuger NPC fraksjonen med de ovenfor beskrevne to sentrifugeringstrinn (trinn 7.2) og re-suspen NPC i Kupffer Cell poding medium (tabell 2).
- Seed KC fraksjon på plast celledyrkningskar ved en tetthet på 5 x 10 5 KC / cm2. Inkuber KC kulturene i 20 min i en fuktet inkubator ved 37 ° C, 5% CO2. Primær KC holder seg på cellekultur plast i løpet av kort tid (figur 2.3).
- Samle supernatanten inneholder ikke levd NPC, bestående hovedsakelig av LMU og HSC. Pool supernatantene for senere separasjon av LEC (se kapittel 9) og HSC (se avsnitt 10). Vask heft KC med HBSS og dyrke dem i Kupffer cellekulturmedium (tabell 2) ved 37 ° C, 5% CO2 i en fuktet inkubator.
9. Separering av endotelceller (1,5 timer)
- Sentrifuger samles supernatanten (trinn 8.5.) Ved 300 x g, 5 min, 4 ° C. Vask pelleten med PBS. Etter sentrifugering ved 300 x g, 5 min, 4 ° C re-suspendere cellene i stel celle / endotelcelle separasjonsmedium og utføre en celletelling for alle gjenværende celler som beskrevet i trinn 4.6.
- Re-suspendere 1 x 10 7 Mio celler i 1 ml stel Cell / endotelcelle separasjon mellom, tilsett 20 mL blokkering løsning fra MACS-KIT og 20 mL av CD31 Micro perler for immunolabeling og inkuber den resulterende suspensjonen i 15 min ved 4 ° C temperatur (figur 2.4).
- Atskilt fra LEC HSC som beskrevet i produsentens protokoll for den magnetisk aktivert cellesorteringssystem MACS (figur 2.5). Elueres magnetisk beholdt CD31-positive LEC og suspendere dem i stel Cell / endotelcelle kulturmedium (tabell 2).
- Utfør celletelling for LEC som beskrevet i trinn 4.6. Seed LEC i en tetthet på 1,25 x 10 5 celler / cm2 i cellekulturbeholdere som er belagt med rottehale kollagen (se trinn 6.1). Dyrke cellene ved 37 ° C, 5% CO2 i en fuktig inkubator.
10. Separering av stel Celler (0,5 timer)
- Umerket HSC passerer separasjonskolonnen under MACS prosedyren. Samle HSC fraksjonen (se trinn 9.5, figur 2.5). Utfør celletelling slik det er beskrevet i trinn 4,6.
- Seed HSC med en tetthet på 5 x 10 4 celler / cm2 i cellekulturbeholdere som er belagt med rottehale kollagen (se trinn 6.1) i stel celle / endotelcelle kulturmedium (tabell 2) og dyrke dem ved 37 ° C, 5% CO 2 i en fuktet inkubator.
Tabell 1: perfusjon og isolasjon løsning.
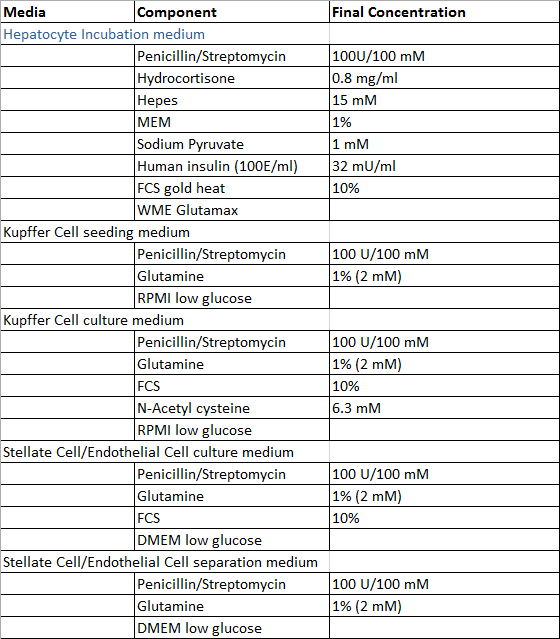
Tabell 2: Kultur og isolasjonsmateriale.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Separasjonen inn i en parenchymale og ikke-parenchymale fraksjon, ved hjelp av tetthetsgradient-sentrifugering som en rengjøringen kombinert med bruk av klebende egenskaper og MACS fører til vellykket PHH og NPC isolasjon. PHH og NPC kan isoleres i høy kvalitet og kvantitet. Figur 1 viser representative oppsett av utstyr for leveren perfusjon og fordøyelsen. 10% FCS ble tilsatt til kollagenase P inneholdende perfusjon - Løsning II for å redusere proteolytisk aktivitet av proteaser, og for å stabilisere kollagenase P aktivitet i retur. I konsekvens lengre fordøyelsen ganger kreves for NPC isolasjon kan brukes uten en negativ innvirkning på levedyktigheten til PHH.

Fig. 1: perfusjon og fordøyelse oppsett Den første perfusjon trinnet utføres i order å fjerne gjenværende blod, varme opp vevet og fjerne Ca 2+ å oppløse celle-celle-forbindelser ved hjelp av 1x perfusjoner Løsning I (PI) (A). Resirkulering av Fordøyelse-løsning (DG) er utført for fordøyelse av levervevet under perfusjon trinn II (B).

Fig. 2: Forenklet skjematisk fremstilling av den fullstendige PHH og NPC isolasjonsprosess Forandringer fra Pfeiffer et al 1, 2014 med tillatelse of Experimental Biology and Medicine.. Først blir leveren vevsprøve perfusert og spaltet ved en to-trinns EGTA / kollagenase P perfusjon teknikk (A). Den fikk Cellesuspensjonen sentrifugeres først ved 50 x g, 5 min, 4 ° C (B), for å separere de større PHH-fraksjon (pellet) fra den mindre NPC-fraksjon (supernatant). I tilfelle av en PHH levedyktighet under 70%, kan det levedyktige PHH fraksjon anrikes ved en tetthetsgradient sentrifugering ved 1250 x g, 20 min, 4 ° C (C) resulterer i settling av PHH ved bunnen av røret, mens død celler / cellerester er plassert på toppen av tettshetsgradient sjikt (D). Innsamlede supernatantene til den innledende sentrifugering (1) blir sentrifugert ved hjelp av to trinn: 1) 300 xg, 5 min, 4 ° C, og 2) 650 xg, 7 min, 4 ° C. Etter den første sentrifugeringen KC er delvis lokalisert i supernatanten. I denne sammenheng er det andre isoleringstrinnet nødvendig. De fått Cellepelletene ble samlet og resuspendert i HBSS. Deretter blir cellesuspensjonen ble forsiktig lagt på toppen av en densitetsgradient to-lag (25% / 50%). De lagdelte densitetsgradient Rørene blir sentrifugert ved 1800 x g, 20 min, 4 ° C (2). Døde celler på toppen av 25% densitetsgradient lag kastes. NPC plassert mellom den mellomfase av 25% og 50% density gradient lag blir samlet og slått sammen. NPC fraksjon podes på ubestrøket cellekultur plast. Ved hjelp av en 20 min inkubasjonstid (tilslutning separasjonstrinn) KC skilles fra andre levercellepopulasjoner (3). LEC og HSC er adskilt ved hjelp av MACS-kit. Derfor er de innsamlede gjenværende leverceller i supernatanten sentrifugeres ved 300 x g, 5 min, 4 ° C, og er merket med CD31-konjugert mikroperler (4). Bare CD31-negative HSC passerer MACS separasjonskolonnen (5). CD31-positive LMU stick til kolonnen. Endelig kolonnen fjernes fra den magnetiske enheten og CD31-positive LEC elueres ut av kolonnen (5). Klikk her for å se en større versjon av dette tallet.
Den isolerte PHH viste en avkastning på 14,2 x 10 6 ± 6,6 x 10 6 levedyktig PHH / g levervev og levedyktighet om 760,6 ± 4,2% (tabell 3 1). Mikroskopisk synlige trekk var en typisk stor cytoplasmisk volum i kombinasjon med lipiddråper og mellom en og fire kjerner, (figur 3A). Cellestørrelsen varierer mellom 20 til 30 mikrometer i suspensjon.
KC var den vanligste celletype i NPC fraksjon. Vi isolert ca 1,9 x 10 6 ± 0,2 x 10 6 levedyktig KC / g levervev med en levedyktigheten til 92,8 ± 3,5% (tabell 3 1). KC er meget små celler (omtrent 5 um) med en lav cytoplasma / kjerne-forhold og typisk mikrovilli på overflaten (figur 3B).
Til slutt har vi brukt MACS separasjonsteknikk for å separere CD31-positive LEC fra den gjenværende CD31-negative HSC. Utbyttet av LMU var omtrent 2,7 x 10 5 ± 0,1 x 10 5 levedyktig LEC / g liver vev og den oppnådde levedyktighet var 95,6 ± 2,8% (tabell 3 1). Identifikasjonskriterier er den multiple granulae og en størrelse på omtrent 10 mikrometer i cellesuspensjonen (figur 3C), så vel som den karakteristiske spindel form etter en kort tid dyrking (figur 3G).
Isoleringen prosess ga et utbytte HSC omtrent 4,7 x 10 5 ± 0,2 x 10 5 levedyktig HSC / g lever (N = 8) med en levedyktighet på 89,6 ± 3,8% (tabell 3 1). Mikroskopisk identifiserbare egenskaper var en størrelse på omtrent 20 mikrometer og en typisk granulert utseende med en varierende mengde av fettdråper (figur 3D).
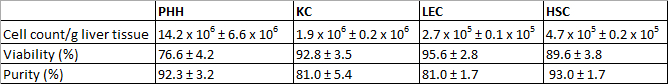
Tabell 3: Rentene, levedyktighet og renhet av isolerte PHH og NPC. Tre forskjellige donorer ble evaluert. Data er gitt som middelverdi ± SD. Denne tabellen ble publisert før i Pfeiffer et al. 1, 2014, og er gjengitt med tillatelse fra Experimental Biology and Medicine.
For identifisering og bestemmelse av cellekultur renhet, ble hver isolerte cellefraksjon ble behandlet med antistoffer mot celletypespesifikke antigenene. Cellene ble behandlet med fluoriserende sekundære antistoffer og undersøkt ved immunfluorescens-mikroskopi. Renheten ble bestemt ved telling av fluorescerende positive fargede celler i forhold til det totale celletallet visualisert ved farging Hoechst.
Etter 24 timers dyrking PHH viste en karakteristisk kantet form og ofte polyploidi (Figur 3E). PHH var positive for CK 18 (figur 3I) og viste en renhet på 92,3 ± 3,2%(Tabell 3 1).
KC levd innen 20 minutter på cellekultur plastflater. Etter å ha observert en inkubasjonstid på 24 hr små runde celler med en fremstående rund cellekjernen (figur 3F). Overflateproteinet CD68 ble anvendt for å identifisere KC (figur 3J). Renheten av CD68-positive celler utgjorde 81,0 ± 5,4% (tabell 3 1).
Til tross for MACS separasjon ved hjelp av CD31 merking i løpet av NPC separasjonen var det fortsatt mulig å farge isolert LEC med CD31. Derfor isolert og dyrket LEC ble farget med CD31 for identifisering og bestemmelse av renhet. I tillegg LEC viste immunoreaktivitets for mesenchymale celle markør vimentin (figur 3K). Vi har observert omtrent 81,0 ± 1,7% av positive fargede celler (tabell 3 1). HSC med sine typiske fremtredende fettdråper (figur 3 H) var preget av immunfluorescens farging for GFAP (figur 3L). HSC renhet var 93,0 ± 1,7% (tabell 3 1).
Hver celle fraksjonen ble kontra med andre NPC markører. Alle celle fraksjonene inneholdt et lite antall andre lever-spesifikke celletyper, men var negative for hepatocytt markør CK18 og cholangiocyte markør CK19.

Fig. 3: Morfologi av human parenchymale og ikke-parenchymale leverceller i suspensjon og etter tilslutning Den venstre kolonne (A - D) viser de forskjellige isolerte levercellepopulasjoner direkte etter isolering prosesseni fasekontrastmikroskop syn: PHH (A), KC (B), LEC (C), og HSC (D). Den midterste kolonnen (E - H) presenterer bilder av isolert og dyrket PHH (E), KC (F), LEC (G) og HSC (H) etter 24 timers dyrking (fasekontrastmikroskop). Immunfluorescens-baserte karakterisering av de forskjellige celle fraksjoner er vist i siste kolonne: PHH viste positive signaler for hepatocytter markør CK18 (I, 24 timer etter isolering), var positive for den markør CD68 KC (J, 24 timer etter isolering), LMU viser positive signaler for vimentin (K, 72 timer etter isolasjon) og HSC var positive for GFAP (L, 72 timer etter isolasjon). Cellekjerner ble farget med Hoechst; forstørrelse: 400X. Modifisert fra Pfeiffer et al. 1, 2014 med tillatelse fra Experimental biologi og medisin. Klikk her for å se en større versjon av dette tallet.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Den publiserte protokollen beskriver en teknikk for å isolere ren PHH og NPC, nemlig KC, HSC og LEC, samtidig i høy kvalitet og renhet fra samme prøve av menneskelig levervev. De fleste av publikasjonene omhandler levercelleisolasjoner dekker bare en av disse cellepopulasjoner 18-20 og isoleringsprosedyrer som utføres med humant vev er sjeldne (gjennomgått av Damm et al.) 21. Tilpassing av metoder etablert med animalsk vev (f.eks rottelever) til human lever avdekket flere forskjeller i celle egenskaper mellom dyr og mennesker cellepopulasjoner. Etableringen av en levercelleisolasjon metode som dekker de forskjellige levercellepopulasjoner avslørte at kombinere parenchymal og ikke-parenchymale celleisolasjon er et kritisk trinn på grunn av forskjellen i koketiden som er nødvendig for optimale resultater. Overfor denne utfordringen vi utviklet en levercelleisolasjon protokollen kombinere ulike teknikker og tilpassetse til våre PHH isolasjon protokoll 10.
Ved tilsetning av 10% FCS til kollagenase P-inneholdende løsning II var vi i stand til å redusere den proteolytiske aktiviteten av proteaser. Denne endringen tillot lengre fordøyelsen ganger, er nødvendig for å få høye tall av NPC. I følge kunne vi isolere PHH samt NPC av god kvalitet og i høy kvantitet. Vellykket levercelleisolasjon avhenger sterkt av den opprinnelige vev kvalitet. Donor data og anamnese kan påvirke celle kvalitet og kvantitet. Fra vår erfaring er det ingen sammenheng med donor spesifikke faktorer og også svært erfarne medarbeidere kan bli møtt til mislykket celle isolasjon. Fordi kvaliteten på donorvevet er et kritisk punkt, alle eksterne kilder, noe som kan svekke vevet kvalitet, må minimaliseres.
De kritiske faktorer er varm ischemi ganger etter det kirurgiske inngrep og kald ischemi ganger under transport av vevet to laboratoriet. I tillegg til noen kilder for bakterielle infeksjoner bør unngås. Det må bemerkes at noen ganger orgelet selv kan inneholde bakteriell forurensning, for eksempel i tilfelle av galle veissykdommer. Kritiske trinn i isoleringsprosedyren dekke perfusjon tider og densitetsgradientsentrifugering trinn. Den første perfusjon skritt bør vare 20-30 min. Kortere perfusjon tider kan føre til ufullstendig løsgjøring av celle-celle-kontakter som resulterer i forekomst av cellegruppene i tjente cellesuspensjon. En langvarig første perfusjon reduserer celleviabilitet og induserer celle stress på grunn av Ca 2+ uttømming.
Den andre perfusjon trinnet utføres for enzymatisk vevsfordøyelse krever litt erfaring for å bestemme den optimale grad fordøyelse for å ta avgjørelse om å stoppe den proteolytiske reaksjon til riktig tidspunkt. Korte fordøyelsen ganger føre til lav avkastning og lengre fordøyelsen ganger til celle stress og celleskader.Fra vår erfaring tidsrammen mellom ufordøyd vev og skadet vev under fordøyelsen ligger ofte innenfor et vindu på 1-3 min. En ufullstendig perfusjon kan motvirkes ved å forskyve trykket i vevet inn i et annet område ved hjelp av klemmer for klemming av kanyler. I tillegg myk trykk med en spatel inn i vevsprøven fører til en endring i vevsperfusjon. Vevet er komprimert og de indre trykket øker. Deretter blir blodårene også komprimeres og deres radius avtar. Med en nedgang i radius, motstanden øker (Hagen-Poiseuilleschen lov) og perfusjon løsning foretrekker veien med minst motstand og perfuses andre områder. I samsvar med Baccarani og medarbeidere observerte vi at fibrotisk vev eller cirrhose er behov for en lengre periode fordøyelse fører til lavere celle viabilities 22. Av denne grunn anbefaler vi å unngå vev av pasienter med leverfibrose eller skrumplever.
Utarbeidelse oghåndtering av gradienter tettheten samt høsting celler ut av gradienter (se trinn 5 og 7) dekker også kritiske trinn. De forskjellige densitetsgradient lag og cellesuspensjonen må overføres i en langsom og forsiktig måte for opprettelse av skarpe interphases. I tillegg er det alltid en risiko for å skade gradienten under håndtering, spesielt når innhøsting av cellene. I løpet av NPC separasjon er den tilslutning separasjonstrinn avgjørende for senere utbytter og renhet i alle NPC fraksjoner. For å øke celletall på ikke klebet NPC og renheten av KC et ytterligere vasketrinn kan være nyttig. Vaskeløsningen i dette trinnet blir slått sammen med supernatanten for videre NPC separasjon. For å unngå forurensning ved bakterier, sopp eller virus strenge aseptiske betingelser må sikres 23.
I avhengighet av de nødvendige cellepopulasjoner protokollen kan endres og reguleres ved å hoppe over bestemte trinn. For eksempel hvis bare KC erkreves det to sentrifugeringstrinn for NPC sedimentering kan reduseres til den andre sentrifugeringstrinn og trinnene for HSC og LEC separasjon kan slippes. Perfusjon tider og g-kraft for sentrifugeringen kan også varieres i avhengighet av vev og cellekvalitet. Fibrotisk vev krever langvarig fordøyelsen ganger, derfor er det behov for å nøye kontrollere vev elastisitet. Opphopning av lipid dråper i fett hepatocytter reduserer celletetthet og endrer derfor sedimenteringsegenskaper. Ifølge våre observasjoner kan det være nyttig å justere g-kraft i PHH isolasjon avhengig av fettinnholdet i PHH, ved høye PhH mengder er nødvendige. Det må bemerkes at eventuelle endringer av den innledende sentrifugeringstrinn vil negativt påvirke NPC isolasjon når det gjelder kvalitet og kvantitet. Så langt, anbefaler vi g-krefter mellom 50 xg (hepatocytter med lavt fettinnhold) og 150 xg (hepatocytter med høyt fettinnhold). I tillegg fatty HEPAtocytes tendens til å danne et mindre kompakt cellepellet etter densitetsgradient sentrifugering, og den ytterligere cellehøstingen må endres som beskrevet i trinn 5.5.
Å fremskynde isoleringsprosedyren noen trinn kan gjøres samtidig. For eksempel parallelt med rensing av de isolerte hepatocytter en annen person kan begynne med NPC isolasjon. I tillegg densitetsgradienten oppløsninger kan fremstilles på forhånd. Dersom det er flere enn to personer enda flere trinn kan utføres på samme tid.
I forhold til andre mennesker lever celle isolasjon protokoller våre resultater viser tilsvarende eller høyere celleutbytte og viabilities som er publisert tidligere i Experimental Biology og Medicine 1. For KC isolasjon Alabraba og medarbeidere demonstrerte isolasjon resultater med et utbytte på 2,3 x 10 6 levedyktig KC / g levervev kombinert med en levedyktighet på omkring 98% 13, som er sammenlignbarevår KC resultater (celle nummer: 1,9 x 10 6 levedyktig KC / g levervev, levedyktighet ca 93%). Flertallet av publiserte LEC isolasjon data beskrive isoleringer fra hele organer 15,24. Gerlach og kolleger samt Lalor og kolleger isolert celle tall mellom 10 3 og 10 6 celler / orgel 15,24. Disse dataene kan ikke sammenlignes direkte til celle isoleringer fra vevsprøver. Men ved å bruke vår protokoll viste vi gir for LMU på 2,7 x 10 5 levedyktige LMU / g levervev, som er langt større når ekstrapolert på en hel organ. HSC ble isolert med et utbytte på ca. 4,7 x 10 levedyktige 5 HSC / g levervev og levedyktigheten til omtrent 90%. Eksisterende resultatene publisert av Friedman og medarbeidere viste halvdel lavere celleutbytter (2,3 x 10 5 HSC / g Livers), men en tilsvarende renhet (91%) 14. Når det gjelder vår protokoll, kan lave celleutbytte være forårsaket av dårlig blodgjennomstrømning og fordøyelse på grunn av lav eller ingen sirkulasjon av 1x Perfusjons-løsning;n I og fordøyelse-løsning i vevet. I tillegg gassbobler i vev kan forstyrre den intra-vev sirkulasjon av 1x perfusjon-oppløsning I og fordøyelse-løsning. I slike tilfeller kan perfusjonen forbedres ved å øke perfusjonstrykk og eliminering av gassbobler ved klemming enkelt kanyler og / eller ved bruk av en spatel for å skyve mot vevsprøve. En dårlig levedyktighet er i de fleste tilfeller er en konsekvens av celle stress. Langvarig iskemi ganger, skade av Ca 2+ utarming og proteolyse av membranproteiner er knyttet til celleskader, synlig ved blebs av cellemembranen. Fra våre observasjoner disse cellene en meget følsomme mot skjærspenninger, og i de fleste tilfeller dør i løpet av isoleringsprosedyren. Oppsummert vellykket isolering og separering av parenchymale og ikke-parenchymale leverceller krever at kritiske trinnene utføres i den rette tidsrommet, blir pipetteringstrinn utføres nøyaktig og generelt tiden for cellen isolasjon og separasjon should holdes så kort som mulig 21. En ulempe ved den beskrevne protokoll er at isoleringsbetingelsene (f.eks perfusjon ganger) ikke kan være helt standardisert, men må tilpasses individuelt til vevet kvalitet. I tillegg kan utbyttet og renheten av de fått cellepopulasjoner variere i avhengighet av vevet kvalitet og fordøyelsen utfallet.
Vi har nylig publisert en studie som viser innflytelsen av dyrkningsforhold kombinert med funksjonell karakterisering av hver NPC celletype isolert ved denne metoden en. Muligheten til å isolere og skille forskjellige cellepopulasjoner i leveren tillater etablering av innovative human lever celle co-kulturer og vev-konstruert in vitro lever modeller. Det er velkjent at PHH dyrking i 2D monokulturer fører til dedifferentiation og tap av typiske cellefunksjoner 7. Av denne grunn er det nødvendig å etterligne in vivo vev architecture innen in vitro lever modeller. Kostadinova og medarbeidere (2013 8,9) samt Messner og medarbeidere (2013 8,9) opprettet funksjonelle co-kulturen lever modeller for påvisning av levertoksiske effekter. Imidlertid NPC ikke ble karakterisert og spesifikke funksjoner ble ikke undersøkt i disse systemene.
Derfor videre forskning bør fokusere på undersøkelser på langsiktig overlevelse av NPC, deres spesifikke egenskaper og interaksjoner i co-kulturer. For slike studier, kan det også være av interesse for å etablere en protokoll for isolering av cholangiocytes. Realisering av funksjonelle in vitro co-kulturer, inkludert alle celletyper som finnes i mors leveren kan være et ytterligere skritt i retning av in vivo som humane lever modeller.
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
Vi vil gjerne takke Jia Li Liu for deres støtte i etableringen av figur 1. Denne studien ble støttet av det tyske føderale Kunnskapsdepartementet (BMBF) prosjektet Virtual Lever: 0315741.
Materials
| Name | Company | Catalog Number | Comments |
| General Equipment | |||
| PIPETBOY | Eppendorf | ||
| pipettes | Eppendorf | ||
| microscope | Carl Zeiss | ||
| microscope | Olympus | ||
| CO2-incubator | Binder | ||
| Lamin Air | Heraeus | ||
| Centrifuge Varifuge 3.0R | Heraeus | ||
| Urine Beaker | Sarstedt | 2041101 | |
| perfusor syringe 50 ml | B.Braun | 12F0482022 | |
| Bottle Top Filter | Nalgene | 1058787 | |
| Falcon 50 ml Polypropylene Conical Tube | BD Biosciences | 352070 | |
| Falcon 15 ml Polypropylene Conical Tube | BD Biosciences | 352096 | |
| Tissue Culture plate | BD Biosciences | 533047 | 24 well |
| serological pipettes | BD Biosciences | 357525, 357551, 357543 | 25 ml, 10 ml, 5 ml |
| pipette tips | SARSTEDT | 0220/2278014, 0005/2242011, 0817/2222011 | 100 µl, 200 µl, 1,000 µl |
| Name | Company | Catalog Number | Comments |
| Isolation Equipment | |||
| water bath | Lauda | ||
| peristaltic pump | Carl Roth | ||
| circulation thermostat | Lauda | ||
| pH meter | Schott | ||
| fine scales | Sartorius | ||
| stand | |||
| Büchner funnel | Haldenwanger | ||
| plastic funnel | |||
| silicone tube | |||
| cannulae with olive tips | |||
| glass dish | |||
| forceps | |||
| scalpel | Feather | 12068760 | |
| Neubauer counting chamber | Optic Labor | ||
| cell lifter | Costar | ||
| Surgical Drape | Charité Universitätsmedizin Berlin | A2013027 | |
| compress | Fuhrmann | 40013331 | |
| sterile surgical gloves | Gammex PF | 1203441104 | |
| Tissue glue | B. Braun | 1050052 | |
| glass bottle | VWR | ||
| Collagenase P | Roche | 13349524 | |
| Percoll Separating Solution | Biochrom | L6145 | Density 1.124 g/ml |
| Hank’s BSS | PAA | H00911-3938 | |
| Dulbecco’s PBS | PAA | H15 - 002 | without Mg/Ca |
| Ampuwa | Plastipur | 13CKP151 | |
| Albumin | Sigma-Aldrich | A7906 | |
| NaCl | Merck | 1,064,041,000 | |
| KCl | Merck | 49,361,000 | |
| Hepes Pufferan | Roth | 133196836 | |
| EDTA | Sigma | E-5134 | |
| Name | Company | Catalog Number | Comments |
| Media Equipment | |||
| DMEM | PAA | E15-005 | Low Glucose (1 g/L) (without L-Glutamine) |
| HEPES Buffer Solution 1 M | GIBCO | 1135546 | |
| L-Glutamine | GIBCO | 25030-024 | 200 mM |
| MEM NEAA | GIBCO | 11140-035 | |
| penicillin/streptomycin | GIBCO | 15140-122 | |
| RPMI 1640 | PAA | E15 - 039 | without L-Glutamine |
| Sodium Pyruvate | GIBCO | 1137663 | 100 mM |
| Trypan Blue Solution | Sigma-Aldrich | T8154 | 0.4% |
| William’s E | GIBCO | 32551-020 | |
| with GlutaMAX™ | |||
| EGTA | Sigma-Aldrich | 03780-50G | |
| Fortecortin | Merck | 49367 | 8 mg/2 ml |
| Human-Insulin | Lilly | HI0210 | 100 I.E./ml |
| N-Acetyl cysteine | Sigma-Aldrich | A9165-5G | |
| Fetal calf serum (FCS) | PAA | A15-101 | |
| Name | Company | Catalog Number | Comments |
| Equipment for Immunostainings | |||
| CD 68 | R&D Systems, USA | monoclonal | |
| CK 19 | Santa Cruz | D2309 | polyclonal |
| CK18 | Santa Cruz | K2105 | monoclonal |
| Vimentin | Santa Cruz | monoclonal | |
| GFAP | Sigma Aldrich | monoclonal | |
| Triton X-100 | Sigma Aldrich | 23.472-9 | |
| Goat anti-Mouse IgG1-PE | Santa Cruz | C0712 | |
| Goat anti-rabbit IgG-FITC | Santa Cruz | L0412 | |
| Methanol | J.T.Baker | 1104509006 | |
| Formaldehyde 4% | Herbeta Arzneimittel | 200-001-8 | |
| Bovine serum albumin (BSA) | Sigma Aldrich | A7906-100G |
References
- Pfeiffer, E., et al. Isolation, characterization, and cultivation of human hepatocytes and non-parenchymal liver cells. Exp Biol Med. , Maywood. (2014).
- Si-Tayeb, K., Lemaigre, F. P., Duncan, S. A. Organogenesis and development of the liver. Dev Cell. 18 (2), 175-189 (2010).
- Alpini, G., Phillips, J. O., Vroman, B., LaRusso, N. F. Recent advances in the isolation of liver cells. Hepatology. 20 (2), 494-514 (1994).
- Godoy, P., et al. Recent advances in 2D and 3D in vitro systems using primary hepatocytes, alternative hepatocyte sources and non-parenchymal liver cells and their use in investigating mechanisms of hepatotoxicity, cell signaling and ADME. Arch Toxicol. 87 (8), 1315-1530 (2013).
- Gómez-Lechón, M. J., Castell, J. V., Donato, M. T. Hepatocytes--the choice to investigate drug metabolism and toxicity in man: in vitro variability as a reflection of in vivo. Chem Biol Interact. 168 (1), 30-50 (2007).
- Ginai, M., et al. The use of bioreactors as in vitro models in pharmaceutical research. Drug Discov Today. 18 (19-20), 922-935 (2013).
- Schyschka, L., et al. Hepatic 3D cultures but not 2D cultures preserve specific transporter activity for acetaminophen-induced hepatotoxicity. Arch Toxicol. 87 (8), 1581-1593 (2013).
- Kostadinova, R., et al. A long-term three dimensional liver co-culture system for improved prediction of clinically relevant drug-induced hepatotoxicity. Toxicol Appl Pharmacol. 268 (1), 1-16 (2013).
- Messner, S., Agarkova, I., Moritz, W., Kelm, J. M. Multi-cell type human liver microtissues for hepatotoxicity testing. Arch Toxicol. 87 (1), 209-213 (2013).
- Nussler, A. K., Nussler, N. C., Merk, V., Brulport, M., Schormann, W., Yao, P., Hengstler, J. G. The Holy Grail of Hepatocyte Culturing and Therapeutic Use. Strategies in Regenerative Medicine. Santin, M. , Springer. New York. 1-38 (2009).
- Friedman, S. L., Roll, F. J. Isolation and culture of hepatic lipocytes, Kupffer cells, and sinusoidal endothelial cells by density gradient centrifugation with Stractan. Anal Biochem. 161 (1), 207-218 (1987).
- Knook, D. L., Blansjaar, N., Sleyster, E. C. Isolation and characterization of Kupffer and endothelial cells from the rat liver. Exp Cell Res. 109 (2), 317-329 (1977).
- Alabraba, E. B., et al. A new approach to isolation and culture of human Kupffer cells. J Immunol Methods. 326 (1-2), 139-144 (2007).
- Friedman, S. L., et al. Isolated hepatic lipocytes and Kupffer cells from normal human liver: morphological and functional characteristics in primary culture. Hepatology. 15 (2), 234-243 (1992).
- Lalor, P. F., Lai, W. K., Curbishley, S. M., Shetty, S., Adams, D. H. Human hepatic sinusoidal endothelial cells can be distinguished by expression of phenotypic markers related to their specialised functions in vivo. World J Gastroenterol. 12 (34), 5429-5439 (2006).
- Lee, S. M., Schelcher, C., Demmel, M., Hauner, M., Thasler, W. E. Isolation of human hepatocytes by a two-step collagenase perfusion procedure. J Vis Exp. (79), (2013).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nat Protoc. 1 (6), 2753-2758 (2006).
- Chang, W., et al. Isolation and culture of hepatic stellate cells from mouse liver. Acta Biochim Biophys Sin (Shanghai). 46 (4), 291-298 (2014).
- Zeng, W. Q., et al. A new method to isolate and culture rat kupffer cells. PLoS One. 8 (8), e70832 (2013).
- Tokairin, T., et al. A highly specific isolation of rat sinusoidal endothelial cells by the immunomagnetic bead method using SE-1 monoclonal antibody. J Hepatol. 36 (6), 725-733 (2002).
- Damm, G., et al. Human parenchymal and non-parenchymal liver cell isolation, culture and characterization. Hepatology International. 7, 915-958 (2013).
- Baccarani, U., et al. Isolation of human hepatocytes from livers rejected for liver transplantation on a national basis: results of a 2-year experience. Liver Transpl. 9 (5), 506-512 (2003).
- Shen, L., Hillebrand, A., Wang, D. Q., Liu, M. Isolation and primary culture of rat hepatic cells. J Vis Exp. (64), (2012).
- Gerlach, J. C., et al. Large-scale isolation of sinusoidal endothelial cells from pig and human liver. J Surg Res. 100 (1), 39-45 (2001).



