Abstract
Naast parenchymale hepatocyten, de lever bestaat uit niet-parenchymcellen (NPC), te weten Kupffer cellen (KC), lever endotheelcellen (LEC) en leverstellaatcellen (HSC). Tweedimensionale (2D) kweek van primaire humane hepatocyten (PHH) wordt nog steeds beschouwd als de "gouden standaard" voor in vitro testen van geneesmiddelmetabolisme en hepatotoxiciteit. Het is bekend dat de 2D-monocultuur van PHH lijdt aan dedifferentiatie en functieverlies. Recent werd aangetoond dat hepatische NPC een centrale rol in de lever (patho-) fysiologie en het behoud van PHH functies spelen. Lopend onderzoek houdt de reconstructie van in vivo weefselarchitectuur van 3D- en co-kweekmodellen de beperkingen van 2D monoculturen te overwinnen. Eerder gepubliceerde we een methode om humane levercellen isoleren en onderzocht de geschiktheid van deze cellen voor het gebruik in celkweken in Experimental Biology and Medicine 1. Op basis van de brede belangstelling voor deze technique het doel van dit artikel is een meer gedetailleerd protocol voor de levercel isolatiewerkwijze zoals een video, die een gemakkelijke weergave van deze techniek zal verschaffen.
Menselijke lever cellen werden uit menselijk leverweefsel monsters van chirurgische ingrepen geïsoleerd door een twee-staps EGTA / collagenase P perfusie techniek. PHH werden gescheiden van de NPC door een eerste centrifugatie bij 50 x g. Dichtheidsgradiënt centrifugatie stappen werden gebruikt voor het verwijderen van dode cellen. Individuele levercel populaties werden geïsoleerd van de verrijkte NPC fractie met behulp van specifieke cel eigenschappen en celsortering procedures. Naast het PHH isolatie waren we in staat om te scheiden KC, LEC en HSC voor verdere teelt.
Tezamen de gepresenteerde protocol maakt de isolatie van PHH en NPC in hoge kwaliteit en kwantiteit van één donor weefselmonster. De toegang tot het gezuiverde levercel populaties kan het ontstaan van in vivo als menselijke li toestaanver modellen.
Introduction
Menselijk leverweefsel is zeer complex en bestaat uit twee verschillende mobiele eenheden, parenchymcellen en niet-parenchymale cellen (NPC). Parenchymale levercellen bevatten hepatocyten en cholangiocyten. Hepatocyten vertegenwoordigen 60 tot 70% van de totale levercellen en zijn goed voor het grootste deel van de metabolische leverfuncties, bijvoorbeeld galzuur en een aanvulling factor synthese, de biologische omzetting en de energiestofwisseling 2,3.
De kleinere NPC fractie vormt 30-40% van de levercellen. NPC onder andere cel populaties, namelijk Kupffer cellen (KC), lever endotheelcellen (LEC) en de leverstellaatcellen (HSC). Deze heterogene celfractie speelt een centrale rol in fysiologische processen in de lever. Bovendien NPC deelnemen bij het veroorzaken acute leverbeschadiging, bijvoorbeeld drugs geïnduceerde leverschade (DILI) en in chronische lever verwondingen, zoals cirrose 4.
In de afgelopen jaren, human levercellen zijn er meer en meer van essentieel belang in onderzoek en ontwikkeling van de drug het testen, de ontwikkeling van geneesmiddelen en de identificatie van nieuwe biochemische pathways in leverziekten geworden. Voor in vitro testen PHH monoculturen worden nog steeds beschouwd als de "gouden standaard" 5. De belangrijkste beperking van de huidige homotypische levermodellen is dedifferentiatie en verlies van functie van de levercellen binnen een paar dagen 4. De oprichting van 3-dimensionale (3D) kweektechnieken is gebleken dat deze beperkingen kunnen worden gecompenseerd 4,6. Maar zelfs de moderne 3D-cultuur technieken zijn niet in staat om al hepatotoxische werkingsmechanismen 7 weer te geven. Ontbrekende NPC populaties in de bestaande in vitro modellen besproken als een mogelijke reden voor deze discrepantie met de in vivo situatie. Aangetoond is dat de communicatie cel-cel tussen de verschillende celpopulaties lever speelt een centrale rol in fysiologische homeostase, maar ook in pathophysiologic 8 verwerkt. Daarom is de wetenschappelijke aandacht richt zich meer en meer op NPC en hun cel-cel interacties. Het doelgericht gebruik in co-cultuur tissue engineered systemen zou een oplossing voor de grote vraag in vitro levermodellen 8,9 die zo dicht mogelijk bij de in vivo situatie mogelijke zijn.
Momenteel is de belangrijkste uitdaging is de ontwikkeling van een gestandaardiseerde menselijke lever co-cultuur model, dat duidelijk omschreven delen van PHH en NPC bevat. Bijgevolg worden isolatietechnieken voor de heterogene levercellen nodig en die moeten worden geoptimaliseerd om zuivere celpopulaties krijgen. Hoewel gestandaardiseerde protocollen voor isolatie PHH bestaan 10, de gestandaardiseerde isolatie van humane NPC nog in ontwikkeling. Meeste gepubliceerde NPC isolatie protocollen gebaseerd op experimenten met niet-menselijke cellen 11,12. Slechts een paar publicaties beschrijven de isolatie proces van menselijke NPC en de meeste hebben alleen betrekking opwerkwijzen voor de isolatie van een enkele celtype 11-16. De belangrijkste celeigenschappen die zijn aangewend voor celscheiding zijn grootte, dichtheid, hechtingsgedrag, en de expressie van oppervlakte-eiwitten. Op basis van deze kenmerken hebben we een vereenvoudigde protocol te isoleren PHH, KC, LEC en HSC, die voorheen in Experimental Biology and Medicine 1 werd gepubliceerd. Vanwege de grote belangstelling voor deze techniek was het doel van dit artikel om een gedetailleerd protocol voor de levercel isolatiewerkwijze zoals een video, waardoor het reproduceren van de techniek makkelijker te verschaffen. Het protocol omvat ook werkwijzen voor kwaliteitscontrole evaluatie van opbrengst en levensvatbaarheid en voor identificatie en zuiverheid beoordelingsproces met specifieke immunokleuring.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Let op: Alle cellen werden geïsoleerd uit resected non-tumor menselijke lever weefsel, dat bleef na gedeeltelijke leverresectie met primaire of secundaire levertumoren. Geïnformeerde toestemming van de patiënten werd verkregen volgens de ethische richtlijnen van de Charité - Universitätsmedizin Berlijn.
1. Voorbereiding van de materialen en oplossingen
- Steriliseren alle instrumenten en materialen vooraf bacteriële besmetting tijdens de isolatie te vermijden.
- Bereid de oplossingen die voor de perfusie van de lever weefsel monster, de isolatiewerkwijze van hepatocyten en niet-parenchymale levercellen en de kweek van primaire humane levercellen volgens de tabellen 1 en 2, met uitzondering van spijsvertering-oplossing die vers is bereid voorafgaand aan gebruik. Alle oplossingen kunnen worden opgeslagen bij 4 ° C en het wordt aanbevolen om deze binnen 4 weken na bereiding gebruikt.
- Steriliserenalle oplossingen met behulp van een 0,22 pm fles top filter.
2. Voorbereiding van de perfusie Equipment
- Opgezet uitrusting voor perfusie en digestie van het leverweefsel monster zoals weergegeven in figuur 1A.
- Stel het waterbad temperatuur tot 39 ° C om een optimale collagenase P activiteit mogelijk tijdens de perfusie en de spijsvertering.
3. Perfusie en de spijsvertering van de lever weefselmonster (1,5 uur)
- Selecteer een weefselmonster met een intacte Glisson de capsule uit de uitgesneden leverweefsel. Bij het snijden van het weefselmonster, probeer dan een klein snijvlak met een goed zichtbare schepen te verkrijgen. Vermijd warme ischemie tijden door het vervoer en de behandeling van de lever weefselmonster op ijs tot perfusie.
- Neem het weefselgewicht onder steriele omstandigheden en plaats het leverweefsel monster in een petrischaal in de laminaire luchtstroom. Reinig het oppervlak van het weefselmonster met een steriel kompres uit remaining bloed en spoel de canule set met behulp van 1x perfusie-oplossing Ik ervoor te zorgen dat alle canule waren permeabel.
- Gebruik weefsel lijm op de olijven van de canules in enkele grotere bloedvaten te repareren. Afhankelijk van de grootte van de lever weefsel monster en het aantal vaartuigen op het oppervlak, gebruik van een canule set met 3-8 canules. Test de perfusie en te controleren op lekkages. Sluit alle bloedvaten, die duidelijke 1x perfusie-oplossing I, met weefsel lijm lekken.
- Plaats de canule leverweefsel monster in een Büchner trechter zijn geperforeerde filterschijf (Figuur 1A).
- Stel het debiet van de peristaltische pomp van 7,5 ml / min en 14,6 ml / min, afhankelijk van het aantal canules gebruikt en de weerstand van het leverweefsel. Stel het debiet telkens om ervoor te zorgen dat er een stroom maar langzaam perfusie. Perfuseren het weefsel totdat het bloed wordt uitgespoeld, maar ten minste 20 min. Let op het weefsel helderder worden in gebieden met een goede perfusiop.
Opmerking: In sommige gevallen kan het nodig zijn één van de canules met plastic klem of klemmen aan de binnendruk van een gebied te vergroten door zacht drukken met een spatel tegen de lever capsule, de doorbloeding te optimaliseren. Een volledige kleurverandering tot een lichtgele tot lichtbruin kleur geeft een goede perfusie. - Verander de perfusievloeistof om de spijsvertering-oplossing bevattende collagenase P (tabel 1).
- De volgorde van de installatie (Figuur 1A) voor de vertering stap. Speelt daarom een kringloop van spijsvertering-oplossing volgens figuur 1B tot 15 minuten.
Opmerking: Het is van cruciaal belang voor de perfusie onmiddellijk te stoppen wanneer de lever weefselmonster voldoende verteerd. Een goede vertering kan worden waargenomen, wanneer het weefsel komt geen elasticiteit bepaald door handhaving capsule vervormingen, wanneer deze wordt ingedrukt met een spatel.
4. Isolatie van hepatocyten (1 uur)
- Turn de peristaltische pomp uit en zet het leverweefsel monster in een glazen schaal. Spoel de buitenkant van het weefselmonster met ijskoude stop-oplossing (Tabel 1). Verwijder de canules uit de lever weefselmonster. Gebruik een scalpel om de lever weefselmonster geopend door incisie in het midden van het gebied waar de canules werden vastgemaakt. Houd zorg dat de Glisson's capsule blijft intact.
- Spoel de binnenkant van het weefselmonster en het gehele weefselmonster met ijskoude stop-oplossing. Schud het weefsel voorzichtig aan de cellen uit het weefsel los te maken.
- Verzamel de celsuspensie en filteren door middel van een blik trechter (plastic trechter gevoerd met gaas kompres) in 50 ml plastic buizen. Voeg meer Stop-oplossing voor de lever weefselmonster tot een eindvolume van 500 ml wordt verbruikt.
- Centrifugeer de celsuspensie bij 50 x g, 5 min, 4 ° C. Verzamel de bovenstaande vloeistof later niet-parenchymale cel isolatie. Was de celpellet met PBS (Figuur 2A).
- Centrifugeer de celsuspensie opnieuw bij 50 xg, 5 min, 4 ° C. Verzamel de supernatant en resuspendeer de pellet in Hepatocyte Incubation medium (tabel 2, figuur 2B).
- Bepaal het aantal cellen en de levensvatbaarheid van de verkregen celsuspensie met behulp van trypan blauw kleuring. Tel het aantal levende en dode cellen in een Neubauer telkamer. Bereken het aantal cellen, levensvatbaarheid en opbrengst van PHH via de formule.
opbrengst (getelde cellen) = geteld cellen x verdunningsfactor x volume van de cel suspensie (ml) x 10.000
opbrengst (hepatocyten / (g leverweefsel monster)) = (opbrengst (hepatocyten / (ml media)) x Volume celsuspensie (ml)) / (gewicht van leverweefsel monster (g))
levensvatbaarheid (%) = 100% x (aantal levende cellen) / (totaal aantal cellen)
5. Zuivering van hepatocyten (1 uur)
Opmerking: Deze zuiveringsstap wordt aanbevolen, wanneer de levensvatbaarheidlager dan 70%.
- Voer alle stappen op het ijs. Bereid een 25% dichtheidsgradiënt door 5 ml dichtheidsgradiënt oplossing en 15 ml PBS dichtheidsgradiënt centrifugatie.
- Zet maximaal 50 miljoen cellen in totaal uit de hepatocyten rijke celsuspensie voorzichtig en langzaam bovenop de 25% dichtheidsgradiënt laag zodat een duidelijke scheiding van de beide lagen wordt verkregen (Figuur 2C). Zet de buizen voorzichtig in de centrifuge en centrifugeer bij 1250 xg, 20 min, 4 ° C zonder rem (figuur 2D).
- Zuig de resterende celsuspensie en de dode cellen in de interfase. Afhankelijk van het vetgehalte men zou ook zuig het dichtheidsgradiënt oplossing.
Opmerking: PHH met een laag vetgehalte vormen een dichte pellet en de dichtheidsgradiënt kan volledig worden opgezogen. PHH met een hoog lipidegehalte vormen een diffuse pellet en veel van levensvatbare cellen in de dichtheidsgradiënt oplossing boven de pellet overblijven. - Resuspendeer de hepatocyte pellets met PBS en centrifugeer opnieuw bij 50 xg, 5 min, 4 ° C. de pellets zwembad, opnieuw wassen met PBS en resuspendeer gezuiverd PHH in Hepatocyte Incubation medium. Voer cel tellen zoals beschreven in stap 4.6.
6. Teelt van hepatocyten
- Bereid de celkweek gerechten voor het zaaien van PHH door ze te coaten met een extracellulaire matrix, bijvoorbeeld rattenstaart collageen (collageen type I). Bereid de rattenstaart collageen volgens de door Rajan et al protocol. 17
- Verdun de rattenstaart collageen voorraad oplossing 1: 200 in PBS. Transfer 100 ul / cm2 rattenstaart collageen oplossing in de cultuur gerechten, zorg dat het hele oppervlak is bedekt. Incubeer de celkweek kunststoffen voor 20 min bij kamertemperatuur. Zuig de resterende rattenstaart collageen oplossing.
- Seed 15 x 10 4 levercellen / cm2 in Hepatocyte incubatiemedium over cultuur disheS gecoat met rattenstaart collageen. Cultiveren van de cellen in een bevochtigde incubator bij 37 ° C, 5% CO2 gedurende ten minste 4 uur. Na 4 uur de hepatocyten gehecht en het medium kan worden veranderd.
- Voeren onderzoeken afhankelijk van de experimentele opstelling. Een cultuur van 48 uur is aanbevolen om de cellen te herstellen van de isolatiewerkwijze.
7. Isolatie van niet-parenchymale levercellen (1,5-2 uur)
- Centrifugeer de verzamelde supernatant (stap 4,5 en 4,6) bij 72 xg, 5 min, 4 ° C om de resterende erythrocyten en hepatocyten elimineren. Verzamel de supernatanten en centrifugeer ze twee keer twee celpellets kwamen: 300 xg, 5 min, 4 ° C voor de sedimentatie van HSC, LEC deels KC en 650 x g, 7 min, 4 ° C gedurende sedimentatie van de resterende KC.
- Pool zowel pellets en resuspendeer ze in HBSS. Bereid een 25% en 50% dichtheidsgradiënten door mengen dichtheidsgradiënt oplossing en PBS dichtheidsgradiënt CENTRIFugation (25% dichtheidsgradiënt oplossing: 5 ml dichtheidsgradiënt oplossing en 15 ml PBS, 50% dichtheidsgradiënt oplossing: 10 ml dichtheidsgradiënt oplossing en 10 ml PBS, zie figuur 2). Plaats de 25% dichtheidsgradiënt oplossing voorzichtig bovenop de 50% dichtheidsgradiënt oplossing laag.
- Zet de NPC suspensie langzaam en voorzichtig bovenop de 25% dichtheidsgradiënt oplossing laag op een manier die een duidelijke scheiding van de beide lagen wordt verkregen.
- Centrifugeer de celsuspensie op de dichtheidsgradiënt bij 1800 x g, 20 min, 4 ° C zonder rem (figuur 2,2).
- Aspireren dode cellen en celresten uit de bovenste laag. De NPC liggen in de interfase tussen 25% en 50% dichtheidsgradiënt laag (figuur 2). Verzamel NPC, was ze met HBSS en centrifugeer de celsuspensie het toepassen van de hierboven beschreven dual centrifugeren (stap 7.2.).
8. Scheiding van Kupffer cellen (AdherenceScheidingsstap) (1 uur)
- Voer een celgetal van de KC in de NPC fractie zoals beschreven in stap 4.6. (Voor de verschijning van KC in suspensie zie figuur 3B). Centrifugeer de NPC fractie de bovenbeschreven tweevoudige centrifugatie (stap 7,2) en resuspendeer de NPC in Kupffer cel enten medium (tabel 2).
- Het zaad van de KC-houdende fractie op plastic celkweek schepen bij een dichtheid van 5 x 10 5 KC / cm2. Incubeer de KC kweken gedurende 20 min in een bevochtigde incubator bij 37 ° C, 5% CO2. Primaire KC zich op celcultuur plastic binnen een korte tijd (Figuur 2.3).
- Verzamel de supernatant dat niet gehandeld NPC, voornamelijk bestaande uit LEC en HSC. de supernatanten voor latere scheiding van LEC Pool (zie paragraaf 9) en HSC (zie paragraaf 10). Was de hechtende KC met HBSS en te kweken in Kupffer celkweekmedium (Tabel 2) bij 37 ° C, 5% CO2 in een bevochtigde incubator.
9. Scheiding van endotheelcellen (1,5 uur)
- Centrifugeer de verzamelde supernatant (stap 8,5.) Bij 300 xg, 5 min, 4 ° C. Was de pellet met PBS. Na centrifugatie bij 300 xg, 5 min, 4 ° C resuspendeer de cellen in stellaatcel / endotheelcellen scheidingsmedium en voer een celgetal van alle resterende cellen zoals beschreven in stap 4.6.
- Resuspendeer 1 x 10 7 miljoen cellen in 1 ml stellaatcel / endotheelcellen scheidingsmedium, voeg 20 pl blokkeeroplossing van de MACS-KIT en 20 pl van de CD31 microparels voor immunokleuring en incubeer de resulterende suspensie gedurende 15 minuten bij 4 ° C temperatuur (figuur 2,4).
- LEC gescheiden van HSC zoals beschreven in het merk gebruikt protocol voor de magnetisch geactiveerde celsortering systeem MACS (figuur 2,5). Elueer magnetisch behield CD31-positieve LEC en op te schorten ze in Stellaatcellen Cell / endotheelcellen kweekmedium (tabel 2).
- Voer cel tellen voor LEC zoals beschreven in stap 4.6. Zaad LEC in een dichtheid van 1,25 x 10 5 cellen / cm2 in celkweek schepen gecoat met rattenstaart collageen (zie stap 6.1). Cultiveren van de cellen bij 37 ° C, 5% CO2 in een bevochtigde incubator.
10. Scheiding van stellaatcellen (0,5 uur)
- Ongelabelde HSC passeren de scheidingskolom in de MACS procedure. Verzamel de HSC-fractie (zie stap 9.5, Figuur 2.5). Voer cel tellen zoals beschreven in stap 4.6.
- Zaad HSC met een dichtheid van 5 x 10 4 cellen / cm2 in cel kweekvaten gecoat met rattenstaart collageen (zie stap 6,1) in stellaatcel / endotheelcellen cultuurmedium (Tabel 2) en te kweken bij 37 ° C, 5% CO2 in een bevochtigde incubator.
Tabel 1: perfusie en isolatieoplossing.
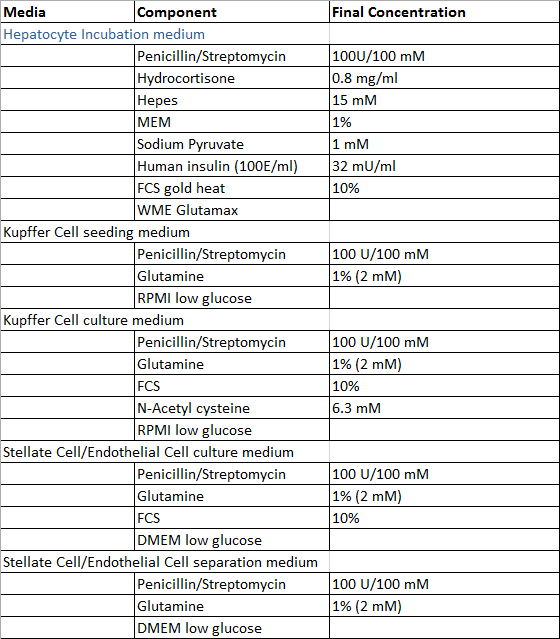
Tabel 2: Cultuur en isolatie media.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
De scheiding in een parenchymale en niet-parenchymale fractie via dichtheidsgradiënt centrifugering zoals een reinigingsprocedure combinatie met het gebruik van hechtingseigenschappen en MACS leidt tot succesvolle PHH en NPC isolatie. PHH en NPC kan worden geïsoleerd in hoge kwaliteit en kwantiteit. Figuur 1 toont de representatieve instellingen van het apparaat voor de lever perfusie en de spijsvertering. 10% FCS werd aan de collagenase P met Perfusion toegevoegd - oplossing II proteolytische activiteit van proteases te verminderen en collagenase P activiteit stabiliseren rendement. Als gevolg langere spijsvertering keer nodig is voor NPC isolatie kan worden toegepast zonder een negatief effect op de levensvatbaarheid van PHH.

Figuur 1:. Perfusie en spijsvertering setup De eerste perfusie wordt uitgevoerd in orde uitgevoerdr om de resterende bloed te verwijderen, op te warmen het weefsel en verwijder Ca 2+ naar cel-cel-verbindingen op te lossen met behulp van 1x infusies Solution I (PI) (A). Recirculatie van Spijsvertering-oplossing (DG) wordt uitgevoerd voor digestie van de lever weefsel tijdens perfusie stap II (B).

Figuur 2:. Vereenvoudigde schematische weergave van de volledige PHH en NPC isolatie proces Modified van Pfeiffer et al 1, 2014 met toestemming van Experimental Biology and Medicine.. Eerst wordt de lever weefselmonster geperfuseerd en verteerd door een tweestaps EGTA / P collagenase perfusie methode (A). De verplaatsende celsuspensie aanvankelijk gecentrifugeerd bij 50 x g, 5 min, 4 ° C (B), om de grotere PHH-fractie (pellet) van de kleinere NPC-fractie te scheiden (supernatant). Bij een levensvatbaarheid PHH dan 70%, kan de levensvatbare PHH fractie is verrijkt met een dichtheidsgradiënt centrifugeren bij 1250 x g, 20 min, 4 ° C (C) verkregen in afwikkeling van de PHH op de bodem van de buis, terwijl dode cellen / celafval zijn bovenop de dichtheidsgradiënt laag (D). Verzamelde supernatanten van de initiële centrifugering (1) gecentrifugeerd met twee stappen: 1) 300 xg, 5 min, 4 ° C en 2) 650 x g, 7 min, 4 ° C. Na de eerste centrifugatie KC gedeeltelijk in het supernatant. In dit verband is de tweede isolatiestap noodzakelijk. De verplaatsende celpellets worden samengevoegd en geresuspendeerd in HBSS. Vervolgens wordt de celsuspensie voorzichtig gelaagd bovenop een tweelaags (25% / 50%) dichtheidsgradiënt. De gelaagde dichtheidsgradiënt buizen worden gecentrifugeerd bij 1800 x g, 20 min, 4 ° C (2). Dode cellen bovenop de 25% dichtheidsgradiënt laag worden verwijderd. NPC gelegen tussen het grensvlak van de 25% en 50% density verlooplaag worden verzameld en samengevoegd. De NPC fractie wordt gezaaid op ongecoat celkweek kunststoffen. Met behulp van een 20 min incubatietijd (hechting scheidingsstap) KC worden van andere levercel populaties (3). LEC en HSC gescheiden door het MACS-kit. Dat de verzamelde resterende levercellen in het supernatant gecentrifugeerd bij 300 x g, 5 min, 4 ° C, en gelabeld met CD31-geconjugeerd microbolletjes (4). Alleen CD31-negatieve HSC passeren de MACS scheiding kolom (5). CD31-positieve LEC vasthouden aan de kolom. Ten slotte wordt de kolom van het magnetisch apparaat en de CD31-positieve LEC verwijderd worden uitgewassen uit de kolom (5). Klik hier om een grotere versie van deze figuur te bekijken.
De geïsoleerde PHH liet een opbrengst van 14,2 x 10 6 ± 6,6 x 10 6 levensvatbare PHH / g leverweefsel en een levensvatbaarheid van ongeveer 760,6 ± 4,2% (tabel 3 1). Microscopisch zichtbare kenmerken waren typisch groot cytoplasmatisch volume in combinatie met vetdruppels en één tot vier kernen (figuur 3A). De celgrootte variëren van 20 tot 30 pm in suspensie.
KC waren de meest voorkomende celtype in het NPC fractie. We isoleerden ongeveer 1,9 x 10 6 ± 0,2 x 10 6 levensvatbare KC / g leverweefsel met een levensvatbaarheid van 92,8 ± 3,5% (tabel 3 1). KC zijn zeer kleine cellen (ongeveer 5 pm) met een lage cytoplasma / kern-verhouding en typische microvilli op het oppervlak (Figuur 3B).
Tenslotte gebruikten we de MACS scheidingstechniek op CD31-positieve LEC scheiden van de resterende CD31-negatieve HSC. De opbrengst van de LEC was ongeveer 2,7 x 10 5 ± 0,1 x 10 5 levensvatbare LEC / g liver weefsel en de bereikte levensvatbaarheid was 95,6 ± 2,8% (tabel 3 1). Identificatiecriteria zijn meerdere granulae met een maat van ongeveer 10 um celsuspensie (figuur 3C) en de karakteristieke spindel vorm na korte tijd kweek (Figuur 3G).
Het isolatieproces resulteerde in een HSC opbrengst ongeveer 4,7 x 10 5 ± 0,2 x 10 5 levensvatbare HSC / g lever (N = 8) met een levensvatbaarheid van 89,6 ± 3,8% (tabel 3 1). Microscopisch identificeerbare kenmerken een grootte van ongeveer 20 pm en een typische verschijning gegranuleerd met een variërende hoeveelheid vetdruppels (Figuur 3D).
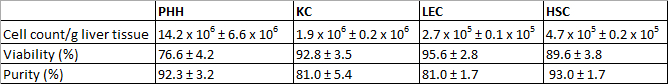
Tabel 3: Opbrengsten, levensvatbaarheid en zuiverheid van geïsoleerde PHH en NPC. Drie verschillende donoren werden geëvalueerd. De gegevens worden gegeven als gemiddelde ± SD. Deze tabel werd eerder in Pfeiffer et al. 1, 2014 gepubliceerd en is herdrukt met toestemming van Experimental Biology and Medicine.
Voor de identificatie en bepaling van celkweek zuiverheid, werd elke geïsoleerde fractie cel behandeld met antilichamen tegen celtype specifieke antigenen. De cellen werden behandeld met fluorescente secundaire antilichamen en onderzocht met immunofluorescentie microscopie. De zuiverheid werd bepaald door het tellen positieve fluorescerende gekleurde cellen in verhouding tot het totale aantal cellen zichtbaar gemaakt door Hoechst kleuring.
Na 24 uur van de teelt PHH toonde een karakteristieke veelhoekige vorm en vaak polyploidie (figuur 3E). PHH waren positief voor CK 18 (Figuur 3I) en vertoonde een zuiverheid van 92,3 ± 3,2%(Tabel 3 1).
KC gehandeld binnen 20 minuten op celcultuur plastic oppervlakken. Na een incubatietijd van 24 uur kleine ronde cellen met een prominente round celkern werden waargenomen (figuur 3F). Het oppervlakte-eiwit CD68 werd gebruikt om KC (Figuur 3J) identificeren. De zuiverheid van CD68 positieve cellen bedroeg 81,0 ± 5,4% (tabel 3 1).
Ondanks de MACS scheiding met behulp van CD31 etikettering tijdens de scheiding NPC was het nog steeds mogelijk om geïsoleerde LEC kleuren met CD31. Daarom werden de geïsoleerde en gecultiveerd LEC gekleurd met CD31 voor de identificatie en de bepaling van de zuiverheid. Daarnaast LEC toonde immunoreactiviteit voor de mesenchymale cel marker vimentine (figuur 3K). We waargenomen bij ongeveer 81,0 ± 1,7% van positieve gekleurde cellen (Tabel 3 1). HSC met hun typische prominente vetdruppels (Figuur 3H) werden gekenmerkt door immunofluorescentie kleuring voor GFAP (figuur 3L). HSC zuiverheid was 93,0 ± 1,7% (tabel 3 1).
Elke fractie cel werd tegengekleurd met andere NPC markers. Alle GSM fracties bevatten een klein aantal andere lever specifieke celtypen, maar waren negatief voor de hepatocytmerker CK18 en CK19 cholangiocyte marker.

. Figuur 3: morfologie van de menselijke parenchymale en niet-parenchymale levercellen in suspensie en na naleving De linker kolom (A - D) toont de verschillende geïsoleerde lever celpopulaties direct na de isolatie procesin fasecontrastmicroscopie view: PHH (A), KC (B), LEC (C), en HSC (D). De middenkolom (E - H) presenteert beelden van geïsoleerde en gekweekte PHH (E), KC (F), LEC (G) en HSC (H) na 24 uur kweken (fasecontrast microscopie). Immunofluorescentie gebaseerde karakterisering van de verschillende celfracties wordt in de laatste kolom: PHH toonde positieve signalen voor het hepatocytmerker CK18 (I, 24 uur na isolatie), KC waren positief voor de marker CD68 (J, 24 uur na isolatie), LEC toonde positieve signalen voor vimentine (K, 72 uur na isolatie) en HSC waren positief voor GFAP (L, 72 uur na isolatie). Celkernen werden gekleurd met Hoechst; vergroting: 400X. Gewijzigd ten opzichte van Pfeiffer et al. 1, 2014 met toestemming van Experimental Biology and Medicine. Klik hier om een grotere versie van deze figuur te bekijken.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
De gepubliceerde protocol beschrijft een techniek om pure PHH en NPC, namelijk KC, HSC en LEC isoleren, tegelijkertijd in hoge kwaliteit en zuiverheid van hetzelfde monster van het menselijk leverweefsel. De meerderheid van de publicaties over levercel isolaties bestrijkt slechts één van die celpopulaties 18-20 en isolatie procedures uitgevoerd met menselijk weefsel zijn zeldzaam (beoordeeld door Damm et al.) 21. Aanpassing van gelegd met dierlijk weefsel (bijvoorbeeld rat lever) voor de menselijke lever methoden onthulde een aantal verschillen in cel eigenschappen tussen dierlijke en menselijke cel populaties. De oprichting van een levercel isolatiewerkwijze die de verschillende celpopulaties lever aangetoond dat het combineren van de parenchymale en niet-parenchymale cel isolatie is een kritische stap door het verschil in destructietijd vereist voor optimale resultaten. Geconfronteerd met deze uitdaging hebben we een levercel isolatie protocol combineren van verschillende technieken en aangepast aan dese onze PHH isolatieprotocol 10.
Door toevoeging van 10% FCS aan de collagenase P bevattende oplossing II waren we in staat om de proteolytische activiteit van proteasen te beperken. Deze wijziging toegestaan langere spijsvertering tijden, die nodig zijn voor het verkrijgen van grote aantallen NPC. Bijgevolg konden we PHH isoleren en NPC van goede kwaliteit en in grote hoeveelheid. Succesvolle levercel isolatie sterk afhankelijk van de kwaliteit eerste weefsel. De donor data en anamnese kunnen de kwaliteit en kwantiteit cel beïnvloeden. Vanuit onze ervaring is er geen correlatie met donor specifieke factoren en ook zeer ervaren personeel kan worden geconfronteerd mislukte cel isolement. Omdat de kwaliteit van het donorweefsel een kritisch punt, alle externe bronnen, die het weefsel kwaliteit kunnen aantasten, moeten worden geminimaliseerd.
Meest kritische factoren zijn warme ischemie keer na de chirurgische ingreep en koude ischemie keer tijdens het transport van het weefsel to het laboratorium. Bovendien enkele bron voor bacteriële infecties moet worden vermeden. Er zij op gewezen dat soms het orgel zelf kunnen bacteriële contaminatie, bijvoorbeeld bevatten, bij gal luchtwegen ziekten. Kritische stappen in de isolatie procedure hebben betrekking op de perfusie tijden en dichtheidsgradiënt centrifugeren stappen. De eerste stap moet perfusie 20-30 min duren. Kortere perfusie tijden kunnen leiden tot onvolledige loslating van cel-cel contacten waardoor het optreden van celgroepen in de gegenereerde celsuspensie. Een langdurige eerste perfusie vermindert de levensvatbaarheid van de cellen en induceert cel-stress als gevolg van Ca 2+ uitputting.
De tweede perfusie stap uitgevoerd voor enzymatische weefsel spijsvertering vereist enige ervaring om de optimale vertering mate bepalen voor het nemen van het besluit over het stoppen van de proteolytische reactie op het juiste tijdstip. Korte spijsvertering tijden leiden tot lage opbrengsten en langdurig spijsvertering tijden van stress en celbeschadiging cel.Vanuit onze ervaring het tijdsbestek tussen onverteerd weefsel en beschadigd weefsel tijdens de spijsvertering ligt vaak binnen een raam van 1-3 min. Een onvolledige perfusie kan worden tegengegaan door het verschuiven van de druk binnen het weefsel in een ander gebied met klemmen voor afknijpen canules. Bovendien zachte druk met een spatel richting weefselmonster leidt tot een verandering in weefselperfusie. Het weefsel wordt samengedrukt en de inwendige druk toeneemt. Vervolgens worden de bloedvaten ook gecomprimeerd en de straal afneemt. Met een afname straal, de weerstand toe (Hagen-Poiseuille wet) en de perfusievloeistof verkiest de weg van de minste weerstand en perfundeert andere gebieden. Overeenkomstig Baccarani en collega observeerden we dat fibrotisch weefsel of cirrotische heeft een langere periode vertering leidt tot levensvatbaarheid van de cellen 22 verlagen. Om deze reden raden wij u aan weefsel van patiënten met leverfibrose of cirrose te voorkomen.
De voorbereiding enafhandeling van de dichtheid gradiënten evenals oogsten cellen uit de hellingen (zie stap 5 en 7) ook betrekking kritische stappen. De verschillende dichtheidsgradiënt lagen en de celsuspensie hebben in een langzame en zorgvuldige manier te dragen voor het maken van scherpe interfasen. Bovendien is er altijd het risico voor het verloop beschadigen tijdens de behandeling, met name tijdens het oogsten van de cellen. Bij het afscheiden NPC de hechting scheidingsstap is cruciaal voor latere opbrengst en zuiverheid van alle NPC fracties. Om de cel aantal niet gehandeld NPC en de zuiverheid van KC te verhogen een extra wasstap kan nuttig zijn. De wasoplossing van deze stap wordt gepoold met de supernatanten verder NPC scheiding. Om verontreiniging door bacteriën te voorkomen, schimmels of virussen strikte aseptische condities moeten worden gewaarborgd 23.
In afhankelijkheid van de vereiste celpopulaties kan het protocol worden veranderd en aangepast door het overslaan van specifieke stappen. Bijvoorbeeld als alleen KC zijnvereist de dubbele centrifugatiestap NPC sedimentatie kan worden gereduceerd tot de tweede centrifugatiestap en de stappen voor HSC en LEC scheiding kan worden verwijderd. Perfusie tijden en g-kracht voor het centrifugeren kan ook gevarieerd afhankelijk van weefsels en cellen kwaliteit. Fibrotisch weefsel vereist langdurige digestietijden, daarom is er behoefte aan intensief controleren weefselelasticiteit. Accumulatie van vetdruppels in vette hepatocyten vermindert de celdichtheid en daarmee verandert sedimentatie eigenschappen. Volgens onze waarnemingen kan het nuttig zijn de G-kracht aan te passen tijdens PHH isolatie afhankelijk van het vetgehalte van de PHH, wanneer hoge hoeveelheden PHH vereist. Er dient te worden opgemerkt dat eventuele wijzigingen van de oorspronkelijke centrifugeren stap negatief zullen beïnvloeden de NPC isolatie in termen van kwaliteit en kwantiteit. Tot nu toe wordt aanbevolen G-krachten tussen 50 xg (hepatocyten met laag vetgehalte) en 150 xg (hepatocyten met hoog vetgehalte). Daarnaast vette hepatocytes meestal een minder compacte celpellet na dichtheidsgradiënt centrifugatie en de verdere verzamelen van cellen moet worden veranderd zoals beschreven in stap 5.5 vormen.
Het versnellen van de isolatiewerkwijze aantal stappen kunnen tegelijkertijd worden uitgevoerd. Bijvoorbeeld parallel met de zuivering van de geïsoleerde hepatocyten een tweede persoon begint met de NPC isolatie. Bovendien de dichtheidsgradiënt oplossingen kunnen worden voorbereid. Als er meer dan twee personen nog meer stappen kunnen worden uitgevoerd op hetzelfde moment.
In vergelijking met andere humane levercel isolatieprocedures onze resultaten vergelijkbare of hogere opbrengsten en cel levensvatbaarheid zoals eerder in Experimental Biology and Medicine 1. KC isolatie Alabraba en medewerkers gedemonstreerd isolatie resultaten met een rendement van 2,3 x 10 6 levensvatbare KC / g leverweefsel gecombineerd met een levensvatbaarheid van ongeveer 98% 13, die vergelijkbaar zijnonze KC resultaten (aantal cellen: 1,9 x 10 6 levensvatbare KC / g leverweefsel, levensvatbaarheid van ongeveer 93%). De meerderheid van de gepubliceerde LEC isolatie gegevens beschrijven isolaties van hele organen 15,24. Gerlach en medewerkers en Lalor en medewerkers die celaantallen tussen 3 en 10 10 6 cellen / organen 15,24. Deze gegevens kunnen niet direct worden vergeleken isolaties van weefselmonsters cel. Het gebruik ons protocol toonden we opbrengsten van LEC van 2,7 x 10 5 levensvatbare LEC / g leverweefsel, die veruit groter wanneer geëxtrapoleerd geheel orgaan. HSC werden geïsoleerd met een opbrengst van ongeveer 4,7 x 10 5 levensvatbare HSC / g leverweefsel en levensvatbaarheid ongeveer 90%. Bestaande resultaten gepubliceerd door Friedman en collega's toonde half onderste cel opbrengsten (2,3 x 10 5 HSC / g lever), maar een dergelijk zuiver water (91%) 14. Ten aanzien van ons protocol, kunnen lage cel opbrengsten worden veroorzaakt door slechte doorbloeding en de spijsvertering als gevolg van lage of geen circulatie van 1x perfusie-Solution I en de spijsvertering-oplossing in het weefsel. Daarnaast gasbellen in het weefsel kan de intra-weefsel circulatie van 1x perfusie-oplossing I en de spijsvertering-Solution verstoren. In deze gevallen kan de perfusie worden verbeterd door de perfusiedruk en verwijdering van gasbellen door klemmen één canules en / of met een spatel voor het duwen tegen het weefselmonster. Een slechte levensvatbaarheid is meestal een gevolg van celstress. Langdurige ischemietijden, schade door Ca2 + depletie en proteolyse van membraaneiwitten zijn gekoppeld aan schade zichtbaar blebs van de celmembraan cel. Aanbevolen waarnemingen deze cellen zeer gevoelig voor afschuifspanning en meestal tijdens de isolatieprocedure sterven. Samenvattend succesvolle isolatie en scheiding van parenchym en niet-parenchymale levercellen vereist dat kritische stappen worden uitgevoerd in het juiste tijdsbestek pipetteerstappen zorgvuldig en algemeen uitgevoerd tijde van de cel isolatie en scheiding should zo kort mogelijk 21 gehouden. Een nadeel van de beschreven protocol is dat de isolatie (bijv, perfusie keer) niet geheel homogeen kan zijn, maar afzonderlijk worden aangepast aan het weefsel kwaliteit. Bovendien kan de opbrengst en zuiverheid van de gewonnen celpopulaties variëren afhankelijk van het weefsel kwaliteit en de vertering uitkomst.
We hebben onlangs een studie gepubliceerd waaruit de invloed van teeltomstandigheden, gecombineerd met functionele karakterisering van elke NPC celtype geïsoleerd door deze methode 1. De mogelijkheid om te isoleren en apart verschillende celpopulaties van de lever maakt het mogelijk creëren van innovatieve menselijke lever cel co-culturen en-tissue engineered in vitro lever modellen. Het is bekend dat PHH teelt in 2D monoculturen leidt tot dedifferentiatie en verlies van typische celfuncties 7. Daarom is het noodzakelijk om de in vivo weefsel archi nabootsentuur binnen in vitro lever modellen. Kostadinova en medewerkers (2013 8,9) en Messner en medewerkers (2013 8,9) met succes functiemodellen co-kweek lever voor de detectie van hepatotoxische effecten. Echter, NPC niet gekarakteriseerd en specifieke functies werden niet onderzocht in deze systemen.
Derhalve verder onderzoek gericht op onderzoek op lange termijn overleven van NPC, de specifieke kenmerken en interacties in co-culturen. Voor dergelijke studies, kan het ook interessant zijn om een protocol vast te stellen voor de isolatie van cholangiocyten. Realisatie van functionele in vitro co-kweken met alle celtypes in de lever natieve kan een verdere stap in de richting van in vivo modellen zoals lever mens zijn.
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
We willen graag bedanken Li Jia Liu voor hun steun in de creatie van Figuur 1. Deze studie werd ondersteund door het Duitse Federale Ministerie van Onderwijs en Onderzoek project (BMBF) Virtual Lever: 0.315.741.
Materials
| Name | Company | Catalog Number | Comments |
| General Equipment | |||
| PIPETBOY | Eppendorf | ||
| pipettes | Eppendorf | ||
| microscope | Carl Zeiss | ||
| microscope | Olympus | ||
| CO2-incubator | Binder | ||
| Lamin Air | Heraeus | ||
| Centrifuge Varifuge 3.0R | Heraeus | ||
| Urine Beaker | Sarstedt | 2041101 | |
| perfusor syringe 50 ml | B.Braun | 12F0482022 | |
| Bottle Top Filter | Nalgene | 1058787 | |
| Falcon 50 ml Polypropylene Conical Tube | BD Biosciences | 352070 | |
| Falcon 15 ml Polypropylene Conical Tube | BD Biosciences | 352096 | |
| Tissue Culture plate | BD Biosciences | 533047 | 24 well |
| serological pipettes | BD Biosciences | 357525, 357551, 357543 | 25 ml, 10 ml, 5 ml |
| pipette tips | SARSTEDT | 0220/2278014, 0005/2242011, 0817/2222011 | 100 µl, 200 µl, 1,000 µl |
| Name | Company | Catalog Number | Comments |
| Isolation Equipment | |||
| water bath | Lauda | ||
| peristaltic pump | Carl Roth | ||
| circulation thermostat | Lauda | ||
| pH meter | Schott | ||
| fine scales | Sartorius | ||
| stand | |||
| Büchner funnel | Haldenwanger | ||
| plastic funnel | |||
| silicone tube | |||
| cannulae with olive tips | |||
| glass dish | |||
| forceps | |||
| scalpel | Feather | 12068760 | |
| Neubauer counting chamber | Optic Labor | ||
| cell lifter | Costar | ||
| Surgical Drape | Charité Universitätsmedizin Berlin | A2013027 | |
| compress | Fuhrmann | 40013331 | |
| sterile surgical gloves | Gammex PF | 1203441104 | |
| Tissue glue | B. Braun | 1050052 | |
| glass bottle | VWR | ||
| Collagenase P | Roche | 13349524 | |
| Percoll Separating Solution | Biochrom | L6145 | Density 1.124 g/ml |
| Hank’s BSS | PAA | H00911-3938 | |
| Dulbecco’s PBS | PAA | H15 - 002 | without Mg/Ca |
| Ampuwa | Plastipur | 13CKP151 | |
| Albumin | Sigma-Aldrich | A7906 | |
| NaCl | Merck | 1,064,041,000 | |
| KCl | Merck | 49,361,000 | |
| Hepes Pufferan | Roth | 133196836 | |
| EDTA | Sigma | E-5134 | |
| Name | Company | Catalog Number | Comments |
| Media Equipment | |||
| DMEM | PAA | E15-005 | Low Glucose (1 g/L) (without L-Glutamine) |
| HEPES Buffer Solution 1 M | GIBCO | 1135546 | |
| L-Glutamine | GIBCO | 25030-024 | 200 mM |
| MEM NEAA | GIBCO | 11140-035 | |
| penicillin/streptomycin | GIBCO | 15140-122 | |
| RPMI 1640 | PAA | E15 - 039 | without L-Glutamine |
| Sodium Pyruvate | GIBCO | 1137663 | 100 mM |
| Trypan Blue Solution | Sigma-Aldrich | T8154 | 0.4% |
| William’s E | GIBCO | 32551-020 | |
| with GlutaMAX™ | |||
| EGTA | Sigma-Aldrich | 03780-50G | |
| Fortecortin | Merck | 49367 | 8 mg/2 ml |
| Human-Insulin | Lilly | HI0210 | 100 I.E./ml |
| N-Acetyl cysteine | Sigma-Aldrich | A9165-5G | |
| Fetal calf serum (FCS) | PAA | A15-101 | |
| Name | Company | Catalog Number | Comments |
| Equipment for Immunostainings | |||
| CD 68 | R&D Systems, USA | monoclonal | |
| CK 19 | Santa Cruz | D2309 | polyclonal |
| CK18 | Santa Cruz | K2105 | monoclonal |
| Vimentin | Santa Cruz | monoclonal | |
| GFAP | Sigma Aldrich | monoclonal | |
| Triton X-100 | Sigma Aldrich | 23.472-9 | |
| Goat anti-Mouse IgG1-PE | Santa Cruz | C0712 | |
| Goat anti-rabbit IgG-FITC | Santa Cruz | L0412 | |
| Methanol | J.T.Baker | 1104509006 | |
| Formaldehyde 4% | Herbeta Arzneimittel | 200-001-8 | |
| Bovine serum albumin (BSA) | Sigma Aldrich | A7906-100G |
References
- Pfeiffer, E., et al. Isolation, characterization, and cultivation of human hepatocytes and non-parenchymal liver cells. Exp Biol Med. , Maywood. (2014).
- Si-Tayeb, K., Lemaigre, F. P., Duncan, S. A. Organogenesis and development of the liver. Dev Cell. 18 (2), 175-189 (2010).
- Alpini, G., Phillips, J. O., Vroman, B., LaRusso, N. F. Recent advances in the isolation of liver cells. Hepatology. 20 (2), 494-514 (1994).
- Godoy, P., et al. Recent advances in 2D and 3D in vitro systems using primary hepatocytes, alternative hepatocyte sources and non-parenchymal liver cells and their use in investigating mechanisms of hepatotoxicity, cell signaling and ADME. Arch Toxicol. 87 (8), 1315-1530 (2013).
- Gómez-Lechón, M. J., Castell, J. V., Donato, M. T. Hepatocytes--the choice to investigate drug metabolism and toxicity in man: in vitro variability as a reflection of in vivo. Chem Biol Interact. 168 (1), 30-50 (2007).
- Ginai, M., et al. The use of bioreactors as in vitro models in pharmaceutical research. Drug Discov Today. 18 (19-20), 922-935 (2013).
- Schyschka, L., et al. Hepatic 3D cultures but not 2D cultures preserve specific transporter activity for acetaminophen-induced hepatotoxicity. Arch Toxicol. 87 (8), 1581-1593 (2013).
- Kostadinova, R., et al. A long-term three dimensional liver co-culture system for improved prediction of clinically relevant drug-induced hepatotoxicity. Toxicol Appl Pharmacol. 268 (1), 1-16 (2013).
- Messner, S., Agarkova, I., Moritz, W., Kelm, J. M. Multi-cell type human liver microtissues for hepatotoxicity testing. Arch Toxicol. 87 (1), 209-213 (2013).
- Nussler, A. K., Nussler, N. C., Merk, V., Brulport, M., Schormann, W., Yao, P., Hengstler, J. G. The Holy Grail of Hepatocyte Culturing and Therapeutic Use. Strategies in Regenerative Medicine. Santin, M. , Springer. New York. 1-38 (2009).
- Friedman, S. L., Roll, F. J. Isolation and culture of hepatic lipocytes, Kupffer cells, and sinusoidal endothelial cells by density gradient centrifugation with Stractan. Anal Biochem. 161 (1), 207-218 (1987).
- Knook, D. L., Blansjaar, N., Sleyster, E. C. Isolation and characterization of Kupffer and endothelial cells from the rat liver. Exp Cell Res. 109 (2), 317-329 (1977).
- Alabraba, E. B., et al. A new approach to isolation and culture of human Kupffer cells. J Immunol Methods. 326 (1-2), 139-144 (2007).
- Friedman, S. L., et al. Isolated hepatic lipocytes and Kupffer cells from normal human liver: morphological and functional characteristics in primary culture. Hepatology. 15 (2), 234-243 (1992).
- Lalor, P. F., Lai, W. K., Curbishley, S. M., Shetty, S., Adams, D. H. Human hepatic sinusoidal endothelial cells can be distinguished by expression of phenotypic markers related to their specialised functions in vivo. World J Gastroenterol. 12 (34), 5429-5439 (2006).
- Lee, S. M., Schelcher, C., Demmel, M., Hauner, M., Thasler, W. E. Isolation of human hepatocytes by a two-step collagenase perfusion procedure. J Vis Exp. (79), (2013).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nat Protoc. 1 (6), 2753-2758 (2006).
- Chang, W., et al. Isolation and culture of hepatic stellate cells from mouse liver. Acta Biochim Biophys Sin (Shanghai). 46 (4), 291-298 (2014).
- Zeng, W. Q., et al. A new method to isolate and culture rat kupffer cells. PLoS One. 8 (8), e70832 (2013).
- Tokairin, T., et al. A highly specific isolation of rat sinusoidal endothelial cells by the immunomagnetic bead method using SE-1 monoclonal antibody. J Hepatol. 36 (6), 725-733 (2002).
- Damm, G., et al. Human parenchymal and non-parenchymal liver cell isolation, culture and characterization. Hepatology International. 7, 915-958 (2013).
- Baccarani, U., et al. Isolation of human hepatocytes from livers rejected for liver transplantation on a national basis: results of a 2-year experience. Liver Transpl. 9 (5), 506-512 (2003).
- Shen, L., Hillebrand, A., Wang, D. Q., Liu, M. Isolation and primary culture of rat hepatic cells. J Vis Exp. (64), (2012).
- Gerlach, J. C., et al. Large-scale isolation of sinusoidal endothelial cells from pig and human liver. J Surg Res. 100 (1), 39-45 (2001).



