Abstract
Accanto epatociti parenchimali, il fegato è costituito da cellule non parenchimali (NPC) vale a dire cellule di Kupffer (KC), fegato le cellule endoteliali (LEC) e le cellule stellate epatiche (HSC). Bidimensionale (2D) cultura di primaria epatociti umani (PHH) è ancora considerato come il "gold standard" per i test in vitro del metabolismo dei farmaci e di epatotossicità. È ben noto che la monocultura 2D PHH soffre dedifferentiation e perdita di funzione. Recentemente è stato dimostrato che epatica NPC giocano un ruolo centrale nel fegato (patologica) fisiologia e il mantenimento delle funzioni PHH. La ricerca attuale si concentra sulla ricostruzione di vivo dell'architettura tessuto da 3D-e co-coltura modelli di superare i limiti di monocolture 2D. In precedenza abbiamo pubblicato un metodo per isolare le cellule di fegato umano e studiato l'idoneità di queste cellule per il loro impiego in colture cellulari in Biologia e Medicina Sperimentale 1. Sulla base del vasto interesse in questo technique lo scopo di questo articolo è quello di fornire un protocollo più dettagliata del processo di isolamento delle cellule epatiche tra cui un video, che permetterà un facile riproduzione di questa tecnica.
cellule epatiche umane sono state isolate da campioni di tessuto di fegato umano di interventi chirurgici da un EGTA / collagenasi tecnica P perfusione in due fasi. PHH stati separati dal NPC da una centrifugazione iniziale a 50 x g. Densità fasi di centrifugazione a gradiente sono stati usati per la rimozione delle cellule morte. popolazioni di cellule individuali del fegato sono stati isolati dalla frazione arricchita NPC utilizzando le proprietà cellulari specifici e le procedure di separazione delle cellule. Accanto l'isolamento PHH siamo stati in grado di separare KC, LEC e HSC per ulteriori coltivazione.
Nel loro insieme, il protocollo presentato permette l'isolamento di PHH e NPC in alta qualità e la quantità di campione di tessuto da un donatore. L'accesso alle popolazioni di cellule del fegato purificati potrebbe consentire la creazione di in vivo come Li umanamodelli ver.
Introduction
tessuto epatico umano è molto complesso e consiste di due diverse entità cellulari, cellule parenchimali e cellule non parenchimali (NPC). cellule epatiche parenchimali includono epatociti e colangiociti. Gli epatociti rappresentano dal 60 al 70% delle cellule del fegato totali e rappresentano la maggior parte delle funzioni epatiche metaboliche, ad esempio, acidi biliari e completano la sintesi fattore, biotrasformazione ed energia metabolismo 2,3.
La frazione NPC minore costituisce il 30-40% delle cellule epatiche totali. NPC includono diverse popolazioni di cellule, ovvero cellule di Kupffer (KC), le cellule del fegato endoteliali (LEC) e le cellule stellate epatiche (HSC). Questa frazione cellulare eterogenico gioca un ruolo centrale in processi fisiologici del fegato. Inoltre, NPC partecipare a mediare danno epatico acuto, ad esempio, lesioni indotte dal farmaco fegato (DILI), così come nelle lesioni croniche del fegato, come la cirrosi 4.
Negli ultimi anni, hcellule epatiche Uman sono diventati sempre più essenziale nella ricerca e nello sviluppo di test anti-droga, lo sviluppo di farmaci e l'identificazione di nuove vie biochimiche nelle malattie del fegato. Per i test in vitro monocolture PHH sono ancora considerati come il "gold standard" 5. La principale limitazione degli attuali modelli di fegato omotipiche è dedifferentiation e perdita di funzione degli epatociti nel giro di pochi giorni 4. La creazione di tecniche (3D) cultura 3-dimensionale ha dimostrato che questi limiti possono essere compensate 4,6. Tuttavia, anche le moderne tecniche di coltura 3D non sono in grado di visualizzare tutte le modalità epatotossici di azioni 7. Manca popolazioni NPC nei modelli esistenti in vitro sono discussi come possibile motivo di questa discrepanza per la situazione in vivo. È stato dimostrato che la comunicazione cellula-cellula tra le diverse popolazioni cellulari fegato gioca un ruolo centrale nella omeostasi fisiologica, ma anche in pathophysiologic elabora 8. Pertanto l'attenzione scientifica si concentra sempre di più sulla NPC e le loro interazioni cellula-cellula. Il loro utilizzo mirato in co-coltura e sistemi di ingegneria tessutale potrebbe essere una soluzione per la forte domanda di modelli di fegato in vitro 8,9 che sono il più vicino alla situazione in vivo possibile.
Attualmente la sfida principale è lo sviluppo di un modello di fegato di co-cultura umana standardizzata, che contiene porzioni ben definite di PHH e NPC. Di conseguenza, tecniche di isolamento per le cellule del fegato molto eterogenei sono necessari e quelli devono essere ottimizzate per ottenere popolazioni di cellule pure. Mentre esistono protocolli standardizzati per l'isolamento PHH 10, l'isolamento standardizzato di NPC umano è ancora in fase di sviluppo. Protocolli di isolamento NPC più pubblicati sono basati su esperimenti con le cellule non umane 11,12. Solo pochi pubblicazioni descrivono il processo di isolamento della NPC umana e la maggior parte coprono soloMetodi per l'isolamento di una singola cellula tipo 11-16. Le caratteristiche cellulari più importanti che sono stati sfruttati per la separazione cellulare sono dimensione, densità, comportamento di attaccamento, e l'espressione di proteine di superficie. Sulla base di queste caratteristiche abbiamo sviluppato un protocollo semplificato per isolare PHH, KC, LEC e HSC, che è stato pubblicato in precedenza in Biologia e Medicina Sperimentale 1. A causa del grande interesse in questa tecnica, lo scopo di questo articolo è quello di fornire un protocollo più dettagliata del processo di isolamento delle cellule epatiche tra cui un video, che consentirà riproducendo la tecnica più facilmente. Il protocollo include anche i metodi di controllo di qualità per la valutazione della resa e la vitalità, nonché per l'identificazione e la purezza valutazione con immunostainings specifici.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Nota: Tutte le cellule sono state isolate da tessuto epatico resecato non tumorale umano, che è rimasto dopo resezione parziale del fegato con tumori epatici primari o secondari. Il consenso informato dei pazienti è stato ottenuto secondo le linee guida etiche del Charité - Universitätsmedizin Berlino.
1. Preparazione di materiali e soluzioni
- Sterilizzare tutti gli strumenti ed i materiali in anticipo per evitare contaminazione batterica durante il processo di isolamento.
- Preparare le soluzioni richieste per la perfusione del campione di tessuto epatico, il processo di isolamento di epatociti e cellule epatiche non parenchimali e la coltivazione di cellule epatiche umane primarie secondo le tabelle 1 e 2, ad eccezione di digestione-Solution che viene preparato fresco prima dell'uso. Tutte le soluzioni possono essere conservati a 4 ° C e si raccomanda di utilizzarle entro 4 settimane dopo la preparazione.
- Sterilizzaretutte le soluzioni che utilizzano un filtro alto 0,22 micron bottiglia.
2. Preparazione di perfusione attrezzature
- Impostare l'apparecchiatura per la perfusione e la digestione del campione di tessuto epatico come mostrato nella Figura 1A.
- Regolare la temperatura del bagno di acqua a 39 ° C per garantire un'attività P ottimale collagenasi durante la perfusione e la digestione.
3. perfusione e la digestione del Campione tessuto di fegato (1,5 ore)
- Selezionare un campione di tessuto con la capsula intatta di Glisson dal tessuto epatico asportato. Quando si taglia il campione di tessuto, cercare di ottenere una piccola superficie di taglio con buoni vasi visibili. Evitare tempi di ischemia calda per il trasporto e la manipolazione del campione di tessuto epatico in ghiaccio fino perfusione.
- Prendere il peso del tessuto in condizioni sterili e posizionare il campione di tessuto epatico in una capsula di Petri nel flusso d'aria laminare. Pulire la superficie del campione di tessuto con una compressa sterile reprodotti minerali di sangue e lavare il set cannula utilizzando 1x perfusione-Soluzione per assicurare che tutte cannula erano permeabili.
- Utilizzare colla tessuto per fissare le olive delle cannule in alcuni vasi sanguigni più grandi. A seconda della dimensione del campione di tessuto epatico e il numero dei vasi sulla superficie, utilizzare una cannula set con 3 a 8 cannule. Testare la perfusione e verificare la presenza di perdite. Chiudere tutti i vasi sanguigni, che fuoriescono 1x perfusione-Soluzione, con la colla del tessuto.
- Posizionare il campione di tessuto epatico cannulato nell'imbuto Büchner sul suo disco filtrante forato (Figura 1A).
- Impostare la portata della pompa peristaltica tra 7,5 ml / min e 14,6 ml / min a seconda del numero di cannule utilizzati e sulla resistenza del tessuto epatico. Regolare la portata ogni volta per garantire che vi sia una perfusione corrente ma lento. Profumato il tessuto fino al sangue intero viene risciacquato ma almeno 20 min. Osservare il tessuto diventerà più luminosa in aree con buone perfusisopra.
Nota: In alcuni casi, può essere necessario bloccare uno dei cannule con fascette di plastica o per aumentare la pressione interna di una zona spingendo dolcemente con una spatola contro la capsula epatica, per ottimizzare la perfusione. Un cambiamento di colore completo ad un giallo chiaro al colore marrone chiaro indica un buon perfusione. - Cambiare il liquido di perfusione alla digestione-Soluzione contenente collagenasi P (Tabella 1).
- Riorganizzare la configurazione (Figura 1A) per la fase di digestione. Pertanto eseguire un flusso circolare di digestione-Solution di figura 1B per un massimo di 15 min.
Nota: E 'fondamentale per fermare immediatamente la perfusione quando il campione di tessuto epatico è sufficientemente digerito. Una buona digestione può essere osservato, quando il tessuto non mostra alcun segno di elasticità valutata mediante manutenzione di deformazioni capsula, quando viene spinto con una spatola.
4. L'isolamento degli epatociti (1 ora)
- Turna la pompa peristaltica off e collocare il campione di tessuto epatico in un piatto di vetro. Risciacquare l'esterno del campione di tessuto con ghiaccio freddo Stop-Solution (Tabella 1). Rimuovere le cannule dal campione di tessuto epatico. Utilizzare un bisturi per aprire il campione di tessuto epatico, incidendo in mezzo alla zona in cui erano attaccate le cannule. Mantenere la cura che la capsula Glisson's rimane intatto.
- Risciacquare l'interno del campione di tessuto e quindi coprire l'intera campione di tessuto con ghiaccio freddo Stop-Solution. Agitare il tessuto delicatamente per rilasciare le cellule di tessuto.
- Raccogliere la sospensione cellulare e filtrare attraverso un imbuto di sguardo (imbuto di plastica rivestito con garza compressa) in 50 ml tubi di plastica. Aggiungere più Stop-Solution al campione di tessuto epatico fino consumato un volume finale di 500 ml.
- Centrifugare la sospensione cellulare a 50 xg, 5 min, 4 ° C. Raccogliere il surnatante per l'isolamento delle cellule non parenchimali in seguito. Lavare il pellet di cellule con PBS (Figura 2A).
- Centrifugare nuovamente la sospensione cellulare a 50 xg, 5 min, 4 ° C. Raccogliere il surnatante e risospendere il pellet in mezzo epatociti incubazione (Tabella 2, Figura 2B).
- Determinare il numero di cellulare e la vitalità nella sospensione cellulare risultante utilizzando trypan colorazione blu. Contare le cellule vive e morte in una camera di conta Neubauer. Calcolare il numero di cellule, la vitalità e la resa dei PHH utilizzando le formule seguenti.
rendimento (cellule contate) = cellule contate x fattore di diluizione x volume di sospensione cellulare (ml) x 10.000
Resa (epatociti / (g fegato campione di tessuto)) = (resa (epatociti / (supporti ml)) x volume di sospensione cellulare (ml)) / (peso del campione di tessuto epatico (g))
redditività (%) = 100% x (numero di cellule vive) / (numero totale di cellule)
5. Purificazione degli epatociti (1 ora)
Nota: Si raccomanda Questa fase di purificazione, la vitalitàè inferiore al 70%.
- Eseguire tutti i passaggi su ghiaccio. Preparare un gradiente di densità 25% mescolando 5 ml di soluzione gradiente di densità e 15 ml di PBS per centrifugazione in gradiente di densità.
- Mettere un massimo di 50 celle Mio totale fuori dalla ricca sospensione cellulare di epatociti lentamente e sopra dello strato gradiente di densità 25% per garantire che una chiara separazione dei due strati è ottenuto (Figura 2C). Mettere attentamente le valvole nella centrifuga e centrifugare a 1250 xg, 20 min, 4 ° C senza freno (Figura 2D).
- Aspirare il restante sospensione cellulare e le cellule morte della interfase. A seconda del contenuto di grasso uno potrebbe anche aspirare il gradiente-soluzione densità.
Nota: PHH con basso contenuto lipidico formare un pellet denso e il gradiente di densità può essere aspirato completamente. PHH con alto contenuto lipidico formare un pellet più diffuso e un sacco di cellule vitali possono rimanere nella soluzione gradiente di densità sopra il pellet. - Risospendere il pellet di epatociti con PBS e centrifugare di nuovo a 50 xg, 5 min, 4 ° C. Si riuniscono gli pellets, sciacquare con PBS e risospendere purificata PHH in mezzo Hepatocyte incubazione. Effettuare il conteggio delle cellule, come descritto al punto 4.6.
6. La coltivazione di epatociti
- Preparare i piatti di coltura cellulare per la semina di PHH da rivestimento con una matrice extracellulare, per il collagene coda esempio di ratto (collagene di tipo I). Preparare il collagene coda di ratto secondo il protocollo stabilito da Rajan et al. 17
- Diluire la coda di topo collagene Soluzione 1: 200 in PBS. Trasferire 100 microlitri / cm 2 di ratto soluzione di collagene di coda nei piatti di coltura, avendo cura che l'intera superficie è coperta. Incubare le plastiche di coltura cellulare per 20 minuti a temperatura ambiente. Aspirare la soluzione rimanente collagene coda di topo.
- Seme di 15 x 10 4 epatociti / cm 2 a mezzo di epatociti di incubazione sulla cultura dishes rivestito con collagene coda di topo. Coltivare le cellule in un incubatore umidificato a 37 ° C, 5% CO 2 per almeno 4 ore. Dopo 4 ore epatociti hanno aderito e il mezzo può essere modificato.
- Eseguire ricerche a seconda del setup sperimentale. Si consiglia un tempo di coltura 48 h per permettere alle cellule di recuperare dal processo di isolamento.
7. L'isolamento delle cellule epatiche non parenchimali (1,5-2 ore)
- Centrifugare il supernatante raccolto (passo 4.5 e 4.6) a 72 xg, 5 min, 4 ° C per eliminare gli eritrociti e epatociti. Pool i supernatanti e centrifugare due volte per ottenere due pellet cellulari: 300 xg, 5 min, 4 ° C per la sedimentazione di HSC, LEC e parzialmente KC e 650 xg, 7 min, 4 ° C per sedimentazione dei rimanenti KC.
- Pool entrambi i pellet e li ri-sospendere in HBSS. Preparare un 25% e una densità del 50% gradienti di miscelazione soluzione gradiente di densità e PBS per gradiente di densità centrifugation (25% soluzione gradiente di densità: 5 soluzione gradiente di densità e ml 15 ml PBS, soluzione al 50% in gradiente di densità: soluzione gradiente di 10 ml di densità e 10 ml di PBS, vedere Figura 2). Posizionare la soluzione gradiente di densità 25% attenzione sulla parte superiore dello strato soluzione gradiente di densità 50%.
- Mettere la sospensione NPC cura e lentamente sulla parte superiore dello strato soluzione gradiente di densità 25% in modo da ottenere una netta separazione dei due strati.
- Centrifugare la sospensione cellulare sul gradiente di densità a 1.800 xg, 20 min, 4 ° C senza freno (Figura 2.2).
- Aspirare le cellule morte e detriti cellulari dal livello più alto. L'NPC si trovano nella interfase tra lo strato gradiente di densità 25% e 50% (Figura 2). Raccogliere NPC, lavarli con HBSS e centrifugare la sospensione cellulare applicando la fase di centrifugazione sopra descritta doppia (punto 7.2.).
8. separazione delle cellule di Kupffer (aderenzaSeparazione Step) (1 ora)
- Eseguire una conta di cellule per la KC nella frazione NPC come descritto al punto 4.6. (Per la comparsa di KC in sospensione vedi Figura 3B). Centrifugare la frazione NPC con la fase di centrifugazione dual descritto sopra (passo 7.2) e risospendere il NPC in Kupffer cellulare semina medio (Tabella 2).
- Seme della frazione contenente KC in serbatoi di plastica coltura cellulare ad una densità di 5 x 10 5 KC / cm 2. Incubare le culture KC per 20 min in un incubatore umidificato a 37 ° C, 5% CO 2. Primaria KC aderire su plastica coltura cellulare entro un breve periodo di tempo (Figura 2.3).
- Raccogliere il surnatante contenente non abbia aderito NPC, che consiste principalmente di LEC e HSC. PISCINA La surnatanti per dopo la separazione di LEC (vedere la sezione 9) e HSC (vedi punto 10). Lavare l'aderente KC con HBSS e coltivare Kupffer coltura cellulare medio (Tabella 2) a 37 ° C, 5% CO2 in un incubatore umidificato.
9. separazione delle cellule endoteliali (1,5 ore)
- Centrifugare il surnatante raccolto (fase 8.5.) A 300 xg, 5 min, 4 ° C. Lavare il pellet con PBS. Dopo centrifugazione a 300 xg, 5 min, 4 ° C risospendere le cellule in cellule stellato / mezzo di separazione delle cellule endoteliali ed eseguire un conteggio delle cellule per tutte le celle rimanenti come descritto al punto 4.6.
- Risospendere 1 x 10 7 cellule Mio in 1 ml cella stellato / endoteliale mezzo di separazione cellulare, aggiungere 20 ml soluzione bloccante dal MACS-kit e 20 ml delle perline CD31 Micro per immunomarcatura e incubare la sospensione risultante per 15 minuti a 4 ° C di temperatura (Figura 2.4).
- LEC separata da HSC come descritto nel protocollo del produttore di sistema per cell sorting attivato magneticamente MACS (Figura 2.5). Eluire magneticamente mantenuto LEC CD31-positivo e sospenderle in stellato CEll / terreno di coltura di cellule endoteliali (Tabella 2).
- Eseguire cella conta per LEC come descritto al punto 4.6. Seed LEC in una densità di 1,25 x 10 5 cellule / cm 2 in recipienti di coltura delle cellule rivestite di collagene coda di ratto (vedi punto 6.1). Coltivare le cellule a 37 ° C, 5% CO 2 in un incubatore umidificato.
10. La separazione delle cellule stellate (0,5 ore)
- Senza etichetta HSC passare la colonna di separazione durante la procedura MACS. Raccogliere la frazione HSC (vedi punto 9.5, figura 2.5). Effettuare il conteggio delle cellule, come descritto al punto 4.6.
- HSC Seed con una densità di 5 x 10 4 cellule / cm 2 in recipienti di coltura delle cellule rivestite di collagene coda di ratto (vedere il punto 6.1) nel stellato cellulare / terreno di coltura di cellule endoteliali (Tabella 2) e li coltivano a 37 ° C, 5% CO 2 in un incubatore umidificato.
Tabella 1: Perfusione e soluzione di isolamento.
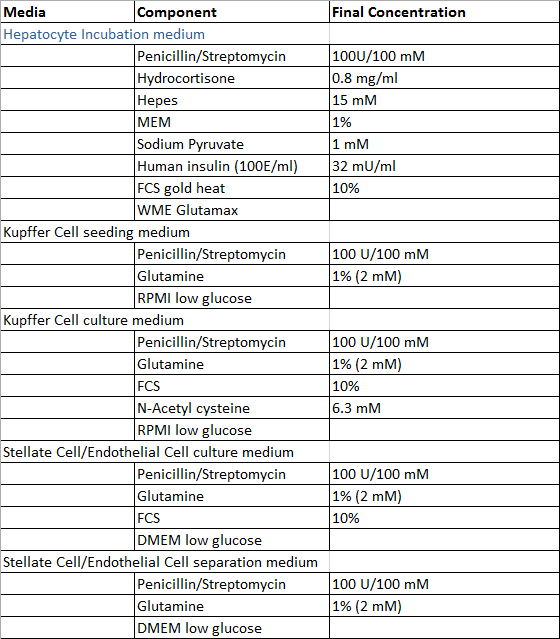
Tabella 2: cultura e di isolamento dei media.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
La separazione in una frazione parenchimale e non parenchimali, con densità centrifugazione in gradiente come una procedura di pulizia combinato con l'uso di proprietà di aderenza e MACS porta a successo isolamento PHH e NPC. PHH e NPC possono essere isolati in alta qualità e quantità. Figura 1 mostra la configurazione rappresentante delle attrezzature per la perfusione del fegato e la digestione. 10% FCS è stato aggiunto alla collagenasi P contenente perfusione - soluzione II per ridurre l'attività proteolitica della proteasi e stabilizzare l'attività P collagenasi in cambio. Di conseguenza è più tempi di digestione necessari per l'isolamento NPC può essere applicata senza un impatto negativo sulla redditività delle PHH.

Figura 1:. Perfusione e la configurazione digestione Il primo passo perfusione viene effettuata in order per rimuovere residui di sangue, riscaldare il tessuto e rimuovere Ca 2+ per sciogliere cellula-cellula-connessioni utilizzando 1x perfusioni Soluzione (PI) (A). Ricircolo di digestione-Solution (DG) viene eseguita per digestione del tessuto epatico durante la perfusione fase II (B).

Figura 2:. Semplificata rappresentazione schematica del completo processo di isolamento e PHH NPC Modificato da Pfeiffer et al 1 2014 con il permesso di Biologia e Medicina Sperimentale.. Innanzitutto, il campione di tessuto epatico è perfuso e digerito da un EGTA / collagenasi tecnica P perfusione due fasi (A). La sospensione cellulare viene centrifugato ottenuto inizialmente a 50 xg, 5 min, 4 ° C (B), per separare il grande PHH-frazione (pellet) dal più piccolo NPC-frazione (supernatant). In caso di una vitalità PHH inferiore a 70%, la frazione PHH valida può essere arricchito da una centrifugazione in gradiente di densità a 1.250 xg, 20 min, 4 ° C (C) con conseguente assestamento del PHH nella parte inferiore del tubo, mentre sono morti cellule / detriti cellulari sono situati sulla parte superiore dello strato gradiente di densità (D). surnatanti raccolta del centrifugazione iniziale (1) vengono centrifugati utilizzando due fasi: 1) 300 XG, 5 min, 4 ° C e 2) 650 XG, 7 min, 4 ° C. Dopo la prima centrifugazione KC sono parzialmente situato nel surnatante. In questo contesto, il secondo passo isolamento è necessario. I pellet cellulari ottenuti sono raggruppati e risospese in HBSS. Successivamente, la sospensione cellulare sono accuratamente sovrapposto di un gradiente di densità a due strati (25% / 50%). I tubi gradiente di densità strati vengono centrifugati a 1800 xg, 20 min, 4 ° C (2). Le cellule morte sulla parte superiore dello strato gradiente di densità 25% vengono scartati. NPC situato tra l'interfase del 25% e il 50% densità livello sfumatura vengono raccolte e pool. La frazione NPC seminato su patinati di plastica di coltura cellulare. Utilizzando un tempo di incubazione 20 min (aderenza fase di separazione) KC sono separati da altre popolazioni cellulari epatiche (3). LEC e HSC sono separati utilizzando il MACS-kit. Pertanto le cellule epatiche rimanenti raccolti nel surnatante sono centrifugati a 300 xg, 5 min, 4 ° C, e sono etichettati con microsfere CD31 coniugato (4). Solo CD31-negative HSC passa la colonna di separazione MACS (5). CD31-positivo LEC bastone alla colonna. Infine, la colonna viene rimosso dal dispositivo magnetico e la LEC CD31-positive vengono eluiti dalla colonna (5). Fai clic qui per vedere una versione più grande di questa figura.
L'isolato PHH ha mostrato una resa di 14,2 x 10 6 ± 6.6 x 10 6 praticabile / g tessuto epatico PHH e una vitalità su 76.6 ± 4,2% (Tabella 3 1). Microscopicamente caratteristiche visibili erano un tipico grande volume del citoplasma in combinazione con goccioline lipidiche e tra uno e quattro nuclei, (Figura 3A). La dimensione della cella varia tra 20 e 30 micron in sospensione.
KC fosse il tipo cellulare più comune nella frazione NPC. Abbiamo isolato circa 1,9 x 10 6 ± 0,2 x 10 6 vitali / g di tessuto epatico KC con agibilità di 92,8 ± 3,5% (Tabella 3 1). KC sono molto piccole cellule (circa 5 micron) con un rapporto citoplasma / nucleo bassa e tipica microvilli sulla superficie (Figura 3B).
Infine abbiamo utilizzato la tecnica MACS di separazione per separare LEC CD31-positivo il restante CD31-negativo HSC. La resa di LEC era di circa 2,7 x 10 5 ± 0,1 x 10 5 vitali LEC / g liver tessuti e la vitalità raggiunto era 95,6 ± 2,8% (tabella 3 1). Criteri di identificazione sono il granulae multipla e una dimensione di circa 10 micron di sospensione cellulare (Figura 3C), così come la forma del mandrino caratteristica dopo un breve periodo di coltivazione (figura 3G).
Il processo di isolamento provocato una resa HSC circa 4,7 x 10 5 ± 0,2 x 10 5 vitali HSC / g di fegato (N = 8) con agibilità di 89,6 ± 3,8% (Tabella 3 1). Microscopicamente caratteristiche identificabili erano di dimensioni di circa 20 micron e un tipico aspetto granulato con una quantità variabile di goccioline lipidiche (Figura 3D).
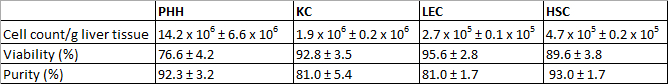
Tabella 3: i rendimenti, la vitalità e la purezza di isolati PHH e NPC. Sono stati valutati tre donatori diversi. I dati sono espressi come media ± SD. Questa tabella è stato pubblicato prima in Pfeiffer et al. 1, 2014 e viene ristampato con il permesso di Biologia e Medicina Sperimentale.
Per l'identificazione e la determinazione di coltura cellulare purezza, ogni frazione di cellule isolato è stato trattato con anticorpi contro gli antigeni specifici tipo di cellula. Le cellule sono state trattate con anticorpi secondari fluorescenti e studiati al microscopio immunofluorescenza. La purezza è stata determinata contando le cellule positive fluorescenti colorati in relazione al numero totale di cellule visualizzati da Hoechst colorazione.
Dopo 24 ore di coltura PHH ha mostrato una forma poligonale caratteristico e spesso poliploidia (Figura 3E). PHH era positivo per CK 18 (Figura 3I) e ha mostrato una purezza di 92,3 ± 3,2%(Tabella 3 1).
KC ha aderito entro 20 minuti su superfici di plastica di coltura cellulare. Dopo un tempo di incubazione di piccole cellule rotonde 24 hr con un nucleo cellulare rotonda di primo piano sono stati osservati (Figura 3F). La proteina di superficie CD68 è stato utilizzato per identificare KC (Figura 3J). La purezza delle cellule positive CD68 pari a 81,0 ± 5,4% (Tabella 3 1).
Nonostante la separazione MACS utilizzando etichettatura CD31 durante la separazione NPC è stato ancora possibile macchiare isolato LEC con CD31. Pertanto, il LEC isolate e coltivate sono state colorate con CD31 per l'identificazione e la determinazione della purezza. Inoltre LEC ha mostrato immunoreattività per il marcatore di cellule mesenchimali vimentina (Figura 3 K). Abbiamo osservato circa 81,0 ± 1,7% di cellule colorate positivi (Tabella 3) 1. HSC con i loro tipici gocce lipidiche di primo piano (Figura 3H) sono stati caratterizzati da immunofluorescenza per GFAP (figura 3L). HSC purezza era 93,0 ± 1,7% (Tabella 3 1).
Ogni frazione di cellule è stato di contrasto con altri marcatori NPC. Tutte le frazioni cellulari contenevano un piccolo numero di altri tipi di cellule specifiche del fegato, ma sono risultati negativi per il marcatore epatociti CK18 e CK19 marcatore colangiociti.

. Figura 3: Morfologia umana e parenchimali cellule epatiche non parenchimali in sospensione e dopo l'adesione La colonna di sinistra (A - D) mostra le diverse popolazioni di cellule epatiche isolate direttamente dopo il processo di isolamentoin fase di vista microscopio a contrasto: PHH (A), KC (B), LEC (C), e HSC (D). La colonna centrale (E - H) presenta immagini di isolato e coltivato PHH (E), KC (F), LEC (G) e HSC (H) dopo 24 ore di coltivazione (microscopio a contrasto di fase). Caratterizzazione immunofluorescenza a base delle diverse frazioni cellulari è mostrato nell'ultima colonna: PHH ha mostrato segnali positivi per il CK18 marcatore epatociti (I, 24 ore dopo l'isolamento), KC sono risultati positivi per il CD68 marcatore (J, 24 ore dopo l'isolamento), LEC ha mostrato segnali positivi per vimentina (K, 72 ore dopo l'isolamento) e HSC sono risultati positivi per la GFAP (L, 72 ore dopo l'isolamento). nuclei delle cellule sono state colorate con Hoechst; ingrandimento: 400X. Modificato da Pfeiffer et al. 1, 2014, con il permesso di esperienza fumi?Biologia e Medicina imental. Cliccate qui per vedere una versione più grande di questa figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
Il protocollo pubblicato descrive una tecnica per isolare puro PHH e NPC, cioè KC, HSC e LEC, simultaneamente in alta qualità e purezza dallo stesso campione di tessuto epatico umano. La maggior parte delle pubblicazioni che si occupano di isolamenti cellule del fegato coprono solo una di quelle popolazioni cellulari 18-20 e le procedure di isolamento eseguiti con i tessuti umani sono rari (recensito da Damm et al.) 21. Adattamento dei metodi stabiliti con tessuto animale (ad esempio, fegato di ratto) di fegato umano ha rivelato alcune differenze nelle proprietà delle celle tra popolazioni di cellule umane e animali. L'istituzione di un metodo di isolamento delle cellule del fegato che coprono le diverse popolazioni di cellule del fegato ha rivelato che unisce l'isolamento delle cellule parenchimali e non-parenchimale è un passo fondamentale a causa della differenza di tempo di digestione richiesto per risultati ottimizzati. Di fronte a questa sfida, abbiamo sviluppato un protocollo di isolamento delle cellule del fegato che combina tecniche diverse e adattati allase al nostro PHH isolamento protocollo 10.
Con l'aggiunta di 10% FCS al collagenasi P contenente Solution II siamo stati in grado di ridurre l'attività proteolitica della proteasi. Questa modifica ha permesso tempi di digestione più lunghi, necessari per ottenere un elevato numero di NPC. Di conseguenza siamo stati in grado di isolare PHH così come NPC di buona qualità e in quantità elevata. isolamento delle cellule del fegato di successo dipende fortemente dalla qualità del tessuto iniziale. I dati del donatore e anamnesi possono influenzare la qualità delle cellule e la quantità. Dalla nostra esperienza non vi è alcuna correlazione con fattori specifici dei donatori e anche personale molto esperto può essere affrontato per l'isolamento delle cellule senza successo. Poiché la qualità del tessuto donatore è un punto critico, tutte le fonti esterne, che possono compromettere la qualità del tessuto, devono essere minimizzati.
La maggior parte dei fattori critici sono momenti ischemia calda dopo l'intervento chirurgico e tempi di ischemia fredda durante il trasporto della t tessutio il laboratorio. Inoltre tutte le fonti per le infezioni batteriche dovrebbe essere evitato. Va notato che a volte l'organo stesso può contenere la contaminazione batterica, ad esempio, nel caso di malattie del tratto biliare. Passaggi critici all'interno della procedura di isolamento coprono i tempi di perfusione e le fasi di centrifugazione in gradiente di densità. Il primo passo perfusione dovrebbe durare 20-30 min. volte perfusione brevi possono portare al distacco incompleta dei contatti cellula-cellula conseguente comparsa di gruppi di cellule in sospensione cellulare ottenuta. Un prolungato prima perfusione riduce la vitalità delle cellule e induce lo stress cellulare dovuto al Ca 2+ esaurimento.
Il secondo passo perfusione eseguita per la digestione enzimatica del tessuto richiede una certa esperienza per determinare il grado di digestione ottimale per prendere la decisione di fermare la reazione proteolitica al punto giusto tempo. tempi di digestione brevi portano a basse rese e tempi di digestione prolungati alla cella stress e danni cellulari.Dalla nostra esperienza il lasso di tempo tra il tessuto non digerito e tessuti danneggiati durante la digestione, spesso si trova all'interno di una finestra di 1-3 min. Un perfusione incompleta può essere contrastata spostando la pressione all'interno del tessuto in un'altra zona con fascette per pizzicare fuori cannule. Inoltre pressione morbido con una spatola verso il campione di tessuto comporta una variazione della perfusione tissutale. Il tessuto è compresso e la pressione aumenta interne. Successivamente, i vasi sanguigni sono compressi e loro raggio diminuisce. Con una diminuzione del raggio, la resistenza aumenta (legge Hagen-Poiseuille) e la soluzione di perfusione preferisce la via di minore resistenza e perfuses altri settori. In conformità con Baccarani e collaboratori abbiamo osservato che il tessuto fibrotico o cirrotico ha bisogno di un periodo di digestione più lungo che porta ad abbassare vitalità cellulare 22. Per questo motivo si consiglia di evitare il tessuto dei pazienti con fibrosi epatica o cirrosi.
La preparazione emanipolazione dei gradienti di densità così come le cellule raccolta su gradienti (vedi punto 5 e 7) comprendono anche passaggi critici. I diversi strati gradiente di densità e la sospensione cellulare devono essere trasferiti in modo lento e accurato per la creazione di interfasi taglienti. Inoltre vi è sempre il rischio di danneggiare il gradiente durante la manipolazione, specialmente durante la raccolta delle cellule. Durante la separazione NPC la fase di separazione aderenza è fondamentale per i rendimenti più tardi e la purezza di tutte le frazioni NPC. Per aumentare il numero di cellule di non aderito NPC e la purezza del KC una fase di lavaggio aggiuntivo può essere utile. La soluzione di lavaggio di questa fase è riunito con i surnatanti per ulteriore separazione NPC. Per evitare la contaminazione da parte di batteri, funghi o virus rigorose condizioni asettiche devono essere garantita 23.
In dipendenza delle popolazioni cellulari richiesti il protocollo può essere modificato e regolato saltando passaggi specifici. Per esempio, se solo KC sononecessaria la fase di centrifugazione per dual NPC sedimentazione può essere ridotta alla seconda fase di centrifugazione e la procedura per HSC e la separazione LEC può essere eliminato. i tempi di perfusione e g-force per la centrifugazione possono anche essere variate in funzione del tessuto e la qualità delle cellule. tessuto fibrotico richiede prolungato tempo di digestione, quindi, vi è una necessità di controllare attentamente l'elasticità dei tessuti. L'accumulo di goccioline lipidiche negli epatociti grassi diminuisce la densità cellulare e cambia di conseguenza le proprietà di sedimentazione. Secondo le nostre osservazioni può essere utile per regolare la forza g durante l'isolamento PHH a seconda del contenuto lipidico del PHH, quando sono necessarie quantità elevate PHH. Va notato che qualsiasi modifica della fase di centrifugazione iniziale sarà influenzare negativamente l'isolamento NPC in termini di qualità e quantità. Finora, si consiglia di g-forze tra 50 g (epatociti con basso contenuto di grassi) e 150 g (epatociti con alto contenuto di grassi). HEPA Inoltre grassitocytes tendono a formare un pellet di cellule meno compatto dopo centrifugazione in gradiente di densità e l'ulteriore raccolta di cellule deve essere cambiato come descritto al punto 5.5.
Per accelerare la procedura di isolamento alcuni passaggi possono essere eseguiti simultaneamente. Per esempio in parallelo con la purificazione degli epatociti isolati una seconda persona può iniziare con l'isolamento NPC. Inoltre le soluzioni gradiente di densità possono essere preparati in anticipo. Se vi sono più di due persone ancora più fasi possono essere eseguite contemporaneamente.
In confronto ad altri protocolli di isolamento delle cellule epatiche umane i nostri risultati mostrano rendimenti e vitalità cellulare simili o superiori, come pubblicato in precedenza in Biologia Sperimentale e Medicina 1. Per KC isolamento Alabraba e collaboratori hanno dimostrato risultati isolamento con una resa di 2,3 x 10 6 vitali / g di tessuto epatico KC combinato con agibilità di circa il 98% 13, che sono paragonabili ala nostra KC (numero di cellulare: 1,9 x 10 6 praticabile KC / g di tessuto epatico, la vitalità circa il 93%) dei risultati. La maggior parte dei dati di isolamento LEC pubblicati descrivono isolamenti da organi interi 15,24. Gerlach e collaboratori, nonché Lalor e collaboratori numero di cellule isolate tra il 10 e il 10 3 6 cellule / organo 15,24. Questi dati non possono essere confrontati direttamente alla cella isolamenti da campioni di tessuto. Tuttavia, utilizzando il nostro protocollo abbiamo mostrato rendimenti per LEC di 2,7 x 10 5 vitali / g tessuti del fegato LEC, che sono di gran lunga più grande quando estrapolati su un intero organo. HSC stato isolato con una resa di circa 4,7 x 10 5 / g tessuti del fegato vitali HSC e vitalità circa il 90%. Risultati esistenti pubblicati da Friedman e colleghi hanno mostrato metà inferiore rendimenti cellulari (2,3 x 10 5 HSC / g fegati), ma una purezza simile (91%) 14. Per quanto riguarda il nostro protocollo, i rendimenti delle cellule bassi possono essere causati da cattiva perfusione e la digestione a causa della bassa o nessuna circolazione di 1x perfusione-Solution I e digestione-Solution all'interno del tessuto. Inoltre bolle di gas nel tessuto possono disturbare la circolazione intra-tessuto di 1x perfusione-Solution I e la digestione-Solution. In questi casi, la perfusione può essere migliorata aumentando la pressione di perfusione e l'eliminazione delle bolle di gas serrando singoli cannule e / o utilizzando una spatola per la spinta contro il campione di tessuto. Una cattiva viabilità è in molti casi una conseguenza dello stress cellulare. I tempi di ischemia prolungata, danni da Ca 2+ impoverimento e proteolisi delle proteine di membrana sono collegate al danno cellulare, visibile blebs della membrana cellulare. Dalle nostre osservazioni queste cellule molto sensibili alle sollecitazioni di taglio e in molti casi muoiono durante la procedura di isolamento. In sintesi, l'isolamento successo e la separazione delle cellule epatiche parenchimali e non parenchimali richiede che punti critici sono eseguite nei tempi di destra, le fasi di pipettamento vengono eseguite accuratamente e in generale il tempo per l'isolamento delle cellule e la separazione should essere il più breve possibile 21. Uno svantaggio del protocollo descritto è che le condizioni di isolamento (ad esempio, i tempi di perfusione) non possono essere completamente standardizzato, ma devono essere adattati individualmente alla qualità del tessuto. Inoltre, la resa e la purezza delle popolazioni di cellule ottenute possono variare in funzione della qualità del tessuto e il risultato digestione.
Abbiamo recentemente pubblicato uno studio che dimostra l'influenza delle condizioni di coltivazione in combinazione con caratterizzazione funzionale di ogni tipo di cellula NPC isolato da questo metodo 1. La possibilità di isolare e popolazioni distinte di cellule diverse del fegato permette la creazione di co-colture di cellule di fegato umano innovativi e di modelli di fegato tissutale in vitro. E 'noto che la coltivazione PHH in 2D mono-colture comporta dedifferentiation e perdita di funzioni cellulari tipiche 7. Per questo motivo è necessario simulare il vivo archi tessutotura all'interno dei modelli di fegato in vitro. Kostadinova e collaboratori (2013 8,9), così come Messner e collaboratori (2013) 8,9 stabiliti con successo modelli di co-coltura di fegato funzionali per la rilevazione di effetti epatotossici. Tuttavia, NPC non sono stati caratterizzati e funzioni specifici non sono stati studiati in questi sistemi.
Pertanto ulteriori ricerche dovrebbero concentrarsi sulle indagini sulla sopravvivenza a lungo termine dei NPC, le loro caratteristiche specifiche e le interazioni all'interno di co-culture. Per tali studi, potrebbe anche essere di interesse per stabilire un protocollo per l'isolamento dei colangiociti. Realizzazione di funzionali co-colture in vitro, compresi tutti i tipi di cellule presenti nel fegato nativo potrebbe essere un ulteriore passo nella direzione di in vivo come i modelli di fegato umano.
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
Vorremmo ringraziare Jia Li Liu per il loro supporto nella creazione della figura 1. Questo studio è stato sostenuto dal Ministero federale tedesco dell'Istruzione e Progetto di ricerca (BMBF) Fegato virtuale: 0.315.741.
Materials
| Name | Company | Catalog Number | Comments |
| General Equipment | |||
| PIPETBOY | Eppendorf | ||
| pipettes | Eppendorf | ||
| microscope | Carl Zeiss | ||
| microscope | Olympus | ||
| CO2-incubator | Binder | ||
| Lamin Air | Heraeus | ||
| Centrifuge Varifuge 3.0R | Heraeus | ||
| Urine Beaker | Sarstedt | 2041101 | |
| perfusor syringe 50 ml | B.Braun | 12F0482022 | |
| Bottle Top Filter | Nalgene | 1058787 | |
| Falcon 50 ml Polypropylene Conical Tube | BD Biosciences | 352070 | |
| Falcon 15 ml Polypropylene Conical Tube | BD Biosciences | 352096 | |
| Tissue Culture plate | BD Biosciences | 533047 | 24 well |
| serological pipettes | BD Biosciences | 357525, 357551, 357543 | 25 ml, 10 ml, 5 ml |
| pipette tips | SARSTEDT | 0220/2278014, 0005/2242011, 0817/2222011 | 100 µl, 200 µl, 1,000 µl |
| Name | Company | Catalog Number | Comments |
| Isolation Equipment | |||
| water bath | Lauda | ||
| peristaltic pump | Carl Roth | ||
| circulation thermostat | Lauda | ||
| pH meter | Schott | ||
| fine scales | Sartorius | ||
| stand | |||
| Büchner funnel | Haldenwanger | ||
| plastic funnel | |||
| silicone tube | |||
| cannulae with olive tips | |||
| glass dish | |||
| forceps | |||
| scalpel | Feather | 12068760 | |
| Neubauer counting chamber | Optic Labor | ||
| cell lifter | Costar | ||
| Surgical Drape | Charité Universitätsmedizin Berlin | A2013027 | |
| compress | Fuhrmann | 40013331 | |
| sterile surgical gloves | Gammex PF | 1203441104 | |
| Tissue glue | B. Braun | 1050052 | |
| glass bottle | VWR | ||
| Collagenase P | Roche | 13349524 | |
| Percoll Separating Solution | Biochrom | L6145 | Density 1.124 g/ml |
| Hank’s BSS | PAA | H00911-3938 | |
| Dulbecco’s PBS | PAA | H15 - 002 | without Mg/Ca |
| Ampuwa | Plastipur | 13CKP151 | |
| Albumin | Sigma-Aldrich | A7906 | |
| NaCl | Merck | 1,064,041,000 | |
| KCl | Merck | 49,361,000 | |
| Hepes Pufferan | Roth | 133196836 | |
| EDTA | Sigma | E-5134 | |
| Name | Company | Catalog Number | Comments |
| Media Equipment | |||
| DMEM | PAA | E15-005 | Low Glucose (1 g/L) (without L-Glutamine) |
| HEPES Buffer Solution 1 M | GIBCO | 1135546 | |
| L-Glutamine | GIBCO | 25030-024 | 200 mM |
| MEM NEAA | GIBCO | 11140-035 | |
| penicillin/streptomycin | GIBCO | 15140-122 | |
| RPMI 1640 | PAA | E15 - 039 | without L-Glutamine |
| Sodium Pyruvate | GIBCO | 1137663 | 100 mM |
| Trypan Blue Solution | Sigma-Aldrich | T8154 | 0.4% |
| William’s E | GIBCO | 32551-020 | |
| with GlutaMAX™ | |||
| EGTA | Sigma-Aldrich | 03780-50G | |
| Fortecortin | Merck | 49367 | 8 mg/2 ml |
| Human-Insulin | Lilly | HI0210 | 100 I.E./ml |
| N-Acetyl cysteine | Sigma-Aldrich | A9165-5G | |
| Fetal calf serum (FCS) | PAA | A15-101 | |
| Name | Company | Catalog Number | Comments |
| Equipment for Immunostainings | |||
| CD 68 | R&D Systems, USA | monoclonal | |
| CK 19 | Santa Cruz | D2309 | polyclonal |
| CK18 | Santa Cruz | K2105 | monoclonal |
| Vimentin | Santa Cruz | monoclonal | |
| GFAP | Sigma Aldrich | monoclonal | |
| Triton X-100 | Sigma Aldrich | 23.472-9 | |
| Goat anti-Mouse IgG1-PE | Santa Cruz | C0712 | |
| Goat anti-rabbit IgG-FITC | Santa Cruz | L0412 | |
| Methanol | J.T.Baker | 1104509006 | |
| Formaldehyde 4% | Herbeta Arzneimittel | 200-001-8 | |
| Bovine serum albumin (BSA) | Sigma Aldrich | A7906-100G |
References
- Pfeiffer, E., et al. Isolation, characterization, and cultivation of human hepatocytes and non-parenchymal liver cells. Exp Biol Med. , Maywood. (2014).
- Si-Tayeb, K., Lemaigre, F. P., Duncan, S. A. Organogenesis and development of the liver. Dev Cell. 18 (2), 175-189 (2010).
- Alpini, G., Phillips, J. O., Vroman, B., LaRusso, N. F. Recent advances in the isolation of liver cells. Hepatology. 20 (2), 494-514 (1994).
- Godoy, P., et al. Recent advances in 2D and 3D in vitro systems using primary hepatocytes, alternative hepatocyte sources and non-parenchymal liver cells and their use in investigating mechanisms of hepatotoxicity, cell signaling and ADME. Arch Toxicol. 87 (8), 1315-1530 (2013).
- Gómez-Lechón, M. J., Castell, J. V., Donato, M. T. Hepatocytes--the choice to investigate drug metabolism and toxicity in man: in vitro variability as a reflection of in vivo. Chem Biol Interact. 168 (1), 30-50 (2007).
- Ginai, M., et al. The use of bioreactors as in vitro models in pharmaceutical research. Drug Discov Today. 18 (19-20), 922-935 (2013).
- Schyschka, L., et al. Hepatic 3D cultures but not 2D cultures preserve specific transporter activity for acetaminophen-induced hepatotoxicity. Arch Toxicol. 87 (8), 1581-1593 (2013).
- Kostadinova, R., et al. A long-term three dimensional liver co-culture system for improved prediction of clinically relevant drug-induced hepatotoxicity. Toxicol Appl Pharmacol. 268 (1), 1-16 (2013).
- Messner, S., Agarkova, I., Moritz, W., Kelm, J. M. Multi-cell type human liver microtissues for hepatotoxicity testing. Arch Toxicol. 87 (1), 209-213 (2013).
- Nussler, A. K., Nussler, N. C., Merk, V., Brulport, M., Schormann, W., Yao, P., Hengstler, J. G. The Holy Grail of Hepatocyte Culturing and Therapeutic Use. Strategies in Regenerative Medicine. Santin, M. , Springer. New York. 1-38 (2009).
- Friedman, S. L., Roll, F. J. Isolation and culture of hepatic lipocytes, Kupffer cells, and sinusoidal endothelial cells by density gradient centrifugation with Stractan. Anal Biochem. 161 (1), 207-218 (1987).
- Knook, D. L., Blansjaar, N., Sleyster, E. C. Isolation and characterization of Kupffer and endothelial cells from the rat liver. Exp Cell Res. 109 (2), 317-329 (1977).
- Alabraba, E. B., et al. A new approach to isolation and culture of human Kupffer cells. J Immunol Methods. 326 (1-2), 139-144 (2007).
- Friedman, S. L., et al. Isolated hepatic lipocytes and Kupffer cells from normal human liver: morphological and functional characteristics in primary culture. Hepatology. 15 (2), 234-243 (1992).
- Lalor, P. F., Lai, W. K., Curbishley, S. M., Shetty, S., Adams, D. H. Human hepatic sinusoidal endothelial cells can be distinguished by expression of phenotypic markers related to their specialised functions in vivo. World J Gastroenterol. 12 (34), 5429-5439 (2006).
- Lee, S. M., Schelcher, C., Demmel, M., Hauner, M., Thasler, W. E. Isolation of human hepatocytes by a two-step collagenase perfusion procedure. J Vis Exp. (79), (2013).
- Rajan, N., Habermehl, J., Coté, M. F., Doillon, C. J., Mantovani, D. Preparation of ready-to-use, storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nat Protoc. 1 (6), 2753-2758 (2006).
- Chang, W., et al. Isolation and culture of hepatic stellate cells from mouse liver. Acta Biochim Biophys Sin (Shanghai). 46 (4), 291-298 (2014).
- Zeng, W. Q., et al. A new method to isolate and culture rat kupffer cells. PLoS One. 8 (8), e70832 (2013).
- Tokairin, T., et al. A highly specific isolation of rat sinusoidal endothelial cells by the immunomagnetic bead method using SE-1 monoclonal antibody. J Hepatol. 36 (6), 725-733 (2002).
- Damm, G., et al. Human parenchymal and non-parenchymal liver cell isolation, culture and characterization. Hepatology International. 7, 915-958 (2013).
- Baccarani, U., et al. Isolation of human hepatocytes from livers rejected for liver transplantation on a national basis: results of a 2-year experience. Liver Transpl. 9 (5), 506-512 (2003).
- Shen, L., Hillebrand, A., Wang, D. Q., Liu, M. Isolation and primary culture of rat hepatic cells. J Vis Exp. (64), (2012).
- Gerlach, J. C., et al. Large-scale isolation of sinusoidal endothelial cells from pig and human liver. J Surg Res. 100 (1), 39-45 (2001).



