Introduction
Un patrimonio di dati sperimentali hanno mostrato che l'epicardio influenza passaggi critici nello sviluppo cardiaco. Durante lo sviluppo, la transversum setto dà luogo ad un gruppo di cellule mesoteliali noto come proepicardium 1-4. Le cellule del proepicardium poi migrano e la busta miocardio formare il epicardio. In seguito, un sottogruppo di cellule epicardici subiscono EMT dando luogo ad una popolazione di cellule migratoria epicardio-derivato (EPDCs) che poi invadono il miocardio. Genetica così come retrovirale lignaggio tracciando esperimenti hanno dimostrato che EPDCs differenziarsi in vari lignaggi comprese le cellule muscolari lisce, i fibroblasti, cellule endoteliali e cardiomiociti (se presenti). Pertanto EPDCs contribuiscono significativamente allo sviluppo del sistema vascolare coronarico e architettura miocardica 1,2,4-9. Inoltre, l'epicardio è essenziale per lo sviluppo dello strato compatto ventricolare 10-12. per postaxample Gittenberger-de Groot et al. hanno dimostrato che inibendo la conseguenza del proepicardium porta ad una serie di difetti come un miocardio sottile, loop carente del cuore e anormale formazione setto interventricolare e, di conseguenza, embrionali letalità 13. fattori paracrini secreti dal dell'epicardio embrionale modulano la proliferazione dei cardiomiociti e differenziazione. Coerentemente con questo, specifici per epicardium cancellazione dei percorsi di segnalazione come l'acido retinoico (RA), i fattori di crescita dei fibroblasti (FGF) e Wnt / β-catenina ha provocato la crescita del miocardio difettoso e letalità embrionale 14-16.
Anche se il epicardio è stato creduto di essere quiescente nei cuori adulti, recenti studi hanno dimostrato che il programma di sviluppo si riattiva nel epicardio seguente lesione cardiaca 17,18. Dopo l'attivazione, le cellule subiscono una rapida proliferazione e EMT che si traducono in formazione EPDC. Queste cellule presentano la capacity di differenziarsi in fibroblasti e cellule muscolari lisce, ma non cardiomiociti e cellule endoteliali 18. Inoltre, i EPDCs secernono fattori pro-angiogenici che gli aiuti nella vascolarizzazione della zona danneggiata e quindi facilitare il miglioramento della funzione cardiaca, riducendo la dimensione dell'infarto. A causa di questi risultati, l'epicardio ha guadagnato interesse per lo studio dello sviluppo cardiovascolari, malattie e rigenerazione.
tecnologia transgenica ha rivoluzionato la ricerca medica nel 21 ° secolo. Con l'aiuto di tecnologie transgeniche, modelli di malati di topo che mimano la condizione umana metabolicamente e fisiopatologico sono stati sviluppati con successo. Tuttavia, lo studio del comportamento delle cellule epicardico in questi mutanti è stata una sfida dovuta principalmente ai primi di letalità embrionale. Considerando il ruolo significativo che la epicardio gioca nello sviluppo cardiaco e la rigenerazione, abbiamo istituito un sistema di coltura in vitro per epicardia del mouseL cellule. Questo metodo permette la coltura a lungo termine delle cellule epicardici e facilita lo studio dettagliato delle due proprietà importanti dell'epicardio: la sua capacità di migrare e differenziarsi. I ventricoli escisse dal mouse potrebbero essere coltivati in gel di collagene che possono essere utilizzati per condurre saggi di migrazione. Essendo coltivate in una matrice 3D che replica la matrice extracellulare ricca di collagene dello strato subepicardico meglio riassume il vivo fisiologia cellulare in. In alternativa possono essere coltivate su vetrini da camera per stabilire un monostrato epicardico che può quindi essere utilizzato per una varietà di applicazioni a valle. Questo monostrato può essere utilizzato per colorare per proteine di giunzione stretti che forniranno approfondimenti sulla capacità del epicardio sottoporsi EMT che è cruciale per la migrazione. Inoltre, esperimenti differenziazione possono essere effettuati anche su queste cellule. Inoltre, profilo di espressione genica può essere analizzata per estrarre l'RNA dalle cellule el'esecuzione di reazione a catena della polimerasi quantitativa (qPCR). Infine, i monostrati potrebbero anche essere trattati con agenti seguita da un'analisi molecolare per verificare le potenziali terapie. Mettere insieme, questo sistema di coltura epicardico ci offre la possibilità di visualizzare e raccogliere dati molecolare che favorisce la nostra comprensione dello sviluppo epicardico.
Un'altra caratteristica desiderabile di questo metodo è che è semplice e non richiede alcuna configurazione elaborata. In breve, gli embrioni vengono raccolte al E11.5 E12.5 o in seguito alla quale il cuore è asportato. I ventricoli sono poi coltivate su entrambi i gel di collagene o diapositive da camera. Successivamente, queste cellule possono essere usate per condurre esperimenti a valle.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
Tutti gli esperimenti sono stati approvati dal Comitato Istituzionale cura degli animali e Usa Duke-NUS Graduate Medical School.
1. Recupero embrionale Ventricoli
- Sacrifica un topo in stato di gravidanza a tempo allo stadio embrionale desiderato (E11.5 o E12.5) utilizzando una camera di eutanasia alla fornitura del gas di biossido di carbonio o un altro metodo di eutanasia approvato.
- Posizionare il mouse sul dorso su un tavolo anatomico. Disinfettare l'addome della femmina con il 70% di etanolo. Sollevare la pelle sopra la pancia e fare una piccola incisione (1-2 cm) con una lama, quindi tenere la pelle con entrambe le mani e tirare via per esporre la parete addominale.
- Ora tagliare la parete addominale per esporre il corno uterino. Utilizzare pinza sterile per sollevare il corno uterino e con attenzione tagliare i tessuti grassi e dei vasi sanguigni collegati al corno uterino. Tagliare al collo dell'utero per recuperare l'utero.
- Posizionare il corno uterino in una capsula di Petri contenente sterile freddo 1x fosfato Buff ered Saline (PBS) e risciacquare delicatamente. Porre la capsula di Petri sul ghiaccio.
- Usare le forbici per tagliare la linea mediana del corno uterino (di fronte al luogo in cui si trova la placenta) per esporre gli embrioni che sono ancora dentro il sacco vitellino e attaccati alla parete uterina attraverso la placenta.
- Utilizzando pinze sterili, tagliare aperto il sacco vitellino embrionali per liberare l'embrione.
- Posizionare l'embrione in un nuovo piatto di Petri contenente sterile freddo 1x PBS. Decapitare l'embrione e posizionarlo sul dorso. Tagliare aperto la parete toracica per esporre il cuore.
- Utilizzare pinze sterili per sollevare il cuore e tagliare via i vasi intorno ad esso per liberare il cuore dalla parete toracica. Prestare particolare attenzione a non danneggiare l'epicardio del cuore con gli strumenti chirurgici.
- Tagliare il tratto di efflusso ed entrambi atri. Trasferire il ventricolo di un altro piatto con 1x PBS freddo. Porre la capsula sul ghiaccio.
- Ripetere i passaggi 1,6-1,9 fino a che tutti i ventricoli vengono recuperati.
Nota: Culture questi espianti epicardici sia su vetrini da camera di vetro o su gel di collagene per applicazioni a valle.
- Vetro Camera Slides
- Per preparare il terreno di coltura, aggiungere il 10% di siero fetale bovino (FBS), 1% di penicillina / streptomicina e 2 ng / ml il fattore di crescita dei fibroblasti ricombinante 2 (FGF2) per mezzo di Dulbecco modificato Eagle (DMEM). Eseguire tutti i passaggi della cappa a flusso laminare.
- Aggiungere 500 microlitri terreni di coltura a ciascun pozzetto di una camera 8 pozzetti.
- Mettete ogni ventricolo asportato al centro di un pozzo. Orientare il ventricolo per mantenere il lato sezionato sulla superficie inferiore del pozzetto.
- Delicatamente la piastra a 37 ° C, 5% CO 2 incubatore di coltura cellulare.
- Mantenere la cultura con il minimo disturbo per permettere gli espianti di aderire. La formazione del monostrato epicardico può essere osservata dopo 48-72 ore.
- Per la differenziazione di epicardcellule IAL in cellule muscolari lisce, la cultura le cellule monostrato epicardici in mezzi di differenziazione per altri 6 giorni. Per preparare i mezzi di differenziazione, aggiungere il 10% FBS, 1% di penicillina / streptomicina e 50 ng / ml ricombinante fattore di crescita trasformante beta 1 (TGF-β1) per DMEM.
- Cambiare il terreno di coltura a giorni alterni.
- gel di collagene
- Preparare il gel di collagene in una piastra a 96 pozzetti utilizzando un kit commerciale 3D collagene cultura secondo il protocollo del produttore.
- Per preparare il volume desiderato di gel di collagene, mescolare la quantità appropriata di soluzione di collagene con 5x di DMEM e pipetta su e giù. La soluzione dovrebbe diventare giallo.
- Aggiungere un corrispondente volume di soluzione di neutralizzazione e miscelare bene immediatamente pipettando su e giù. La soluzione diventerà rosa.
- Pipettare 100 ml di questa miscela in ciascun pozzetto di una piastra a 96 pozzetti. Posizionare la piastra a 37 ° C, 5% CO 2 incubatore per 30-60 min ad albasso il gel di polimerizzare.
- Aggiungere 200 ml di terreni di coltura descritti sopra per ciascun pozzetto.
- Mettete ogni ventricolo asportato al centro di un pozzo. Orient ventricolo per mantenere il lato sezionato giù sul gel di collagene (apice del ventricolo deve affrontare sperimentatore). Delicatamente la piastra posteriore in incubatrice coltura cellulare.
- Dopo 3 giorni, rimuovere i ventricoli. Mettere la piastra posteriore nell'incubatore coltura cellulare per altri 2 giorni.
- Cambiare il terreno di coltura a giorni alterni.
3. Fissazione e Visualizzazione
Nota: le cellule epicardici possono essere visualizzati sia su vetrini da camera di vetro o gel di collagene.
- Aspirare i terreni di coltura e aggiungere un uguale volume di sterili 1x PBS per lavare le cellule.
- Aggiungere appena sufficiente 4% paraformaldeide (PFA) per coprire le cellule. Fissare le cellule per 10 minuti a 4 ° C.
- Rimuovere PFA e lavare espianti con 1x PBST (PBS 1x con0,1% triton X-100) per permeabilize cellule.
- Immunostain con l'anticorpo desiderato (ad esempio Alexa Fluor 488-falloidina; ZO-1, α-tubulina e α-actina del muscolo liscio) 7.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
Usando questo protocollo la cultura, le cellule epicardial primarie possono essere isolate con elevata purezza per le applicazioni a valle. Le cellule coltivate sono in grado di subire EMT, migrare e differenziarsi come cellule epicardial fare in vivo.
Per determinare la purezza della nostra cultura di cellule epicardico primarie, abbiamo analizzato gli espianti epicardici generati da Sema3d GFPCre / +; R26 Tom / + embrioni. Sema3d è espresso in cellule epicardial durante lo sviluppo cardiaco precoce, così le cellule epicardial derivate da questi embrioni saranno RFP etichettati. Abbiamo isolato ventricoli da Sema3d GFPCre / +; R26 Tom / + embrioni per espianti epicardici. Dopo 48-72 ore, siamo stati in grado di vedere un monostrato di cellule epicardici. Sovrapposizione di immunofluorescenza RFP e le immagini campo chiaro ha mostrato che la maggioranzadelle cellule migrati dai ventricoli sono di origine epicardico (Figura 1A - C). Abbiamo inoltre convalidato i nostri risultati, isolando RNA delle cellule epicardici primarie e l'esecuzione di qPCR che ha mostrato una forte espressione di specifici geni epicardici (Tbx18 e WT1), piuttosto che un gene marcatore cardiomiociti (Nkx2.5) (Figura 1C).
Successivamente abbiamo esaminato la capacità delle cellule di sottoporsi EMT analizzando la polarità cellula e cellula-cellula contatto di cellule epicardici. EMT è un processo biologico che permette una cellula epiteliale perda la sua polarità cellulare e il contatto cellula-cellula per trasformare in una cellula mesenchimale migratori. Il primo passo del EMT è il distacco dei contatti cellula-cellula. Abbiamo immunostained cellule epicardial con ZO-1 (noto anche come Tjp1, stretto giunzione proteina 1) che ha mostrato la localizzazione delle ZO-1 alla membrana plasmatica indicando che le cellule hannoancora subire EMT (Figura 2A). Successivamente abbiamo effettuato immunocolorazione per α-tubulina (Figura 2B) in modo da osservare l'organizzazione dei microtubuli espianti epicardici, che ha mostrato un allineamento polarizzata che facilita la migrazione direzionale delle cellule epicardici. Inoltre, per determinare il potenziale di differenziazione delle cellule epicardici, li coltivate per 6 giorni in un mezzo di differenziazione contenenti ricombinante TGF-β1. Immunocolorazione per la SMA ha dimostrato la differenziazione di successo di cellule epicardici in cellule muscolari lisce (Figura 2C).
Infine, per analizzare la migrazione delle cellule dell'epicardio-derivati e EMT epicardico, abbiamo anche effettuato un test di gel di invasione di collagene. cellule epicardium di derivazione sono stati visualizzati da falloidina immunocolorazione. Successful migrazione di cellule derivate epicardio può essere visto in tutto il espianto (Figura 3A). Per determinare il dapprofondito lavoro di penetrazione delle cellule nella matrice di collagene, 3D-ricostruzione è stata generata da immagini confocale. Penetrazione di cellule derivate epicardio può essere visto in z-stack (Figura 3B).
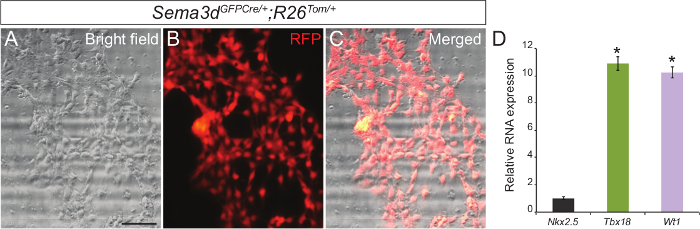
. Figura 1: colture primarie di cellule epicardici da embrionali di topo Hearts campo chiaro Rappresentante (A) e RFP immunofluorescenza (B) immagini di cellule epicardial primarie generate da E12.5 Sema3d GFPCre / +; R26 Tom / + cuori. Immagine campo chiaro ed immunofluorescenza uniti (C). Relativi livelli di espressione di mRNA di marcatori epicardici (Tbx18 e WT1) e marcatore dei cardiomiociti (Nkx2.5) nelle cellule epicardial primarie (D). I risultati sono stati normalizzati per GAPDH espressione, e la livelli di espressione relativi sono dati come una differenza volte rispetto all'espressione Nkx2.5 (n = 3). I dati sono presentati come media ± SD. Barra di scala = 200 micron. *, P <0.05. Cliccate qui per vedere una versione più grande di questa figura.
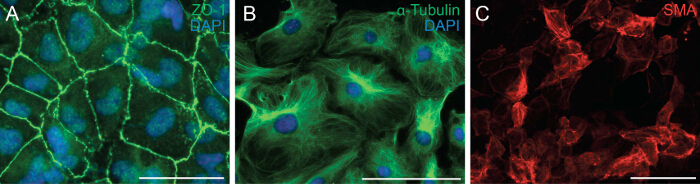
Figura 2: elementi primari epicardici mantengono la loro capacità di subire EMT e differenziazione Immunocolorazione su espianti epicardici per ZO-1 (A, verde) o α-tubulina (B, verde).. DAPI è stato utilizzato per visualizzare nuclei (blu). Cellule epicardici sono state differenziate in cellule muscolari lisce per 6 giorni e colorati con α-actina del muscolo liscio (SMA) (C, rosso). Barra di scala = 100 micron.3993fig2large.jpg "target =" _ blank "> Clicca qui per vedere una versione più grande di questa figura.

Figura 3:. Migrazione cellulare epicardici sulla superficie del gel del collageno ventricoli da embrioni E12.5 sono state coltivate su una matrice di gel di collagene tridimensionale e trattata con Alexa Fluor 488-phalloidin visualizzare migrazione cellulare epicardio derivato e penetrazione (A). Immagini confocali sono stati usati per costruire una immagine tridimensionale per determinare la penetrazione delle cellule lungo gli assi Z (B). Barra di scala = 50 micron. Cliccate qui per vedere una versione più grande di questa figura.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
È fondamentale per sviluppare tecniche che facilitano lo studio della epicardio per soddisfare la crescente importanza della epicardio in sviluppo cardiaco e rigenerazione. Il sistema di coltura epicardico pone notevoli vantaggi per la ricerca epicardico.
Un modo alternativo per isolare le cellule epicardial è usare fluorescenza attivato cell sorting (FACS). Questo metodo si basa sull'utilizzo di marcatori epicardici (o-specifica epicardio cellule transgenici espressione di una proteina fluorescente) per separare le cellule epicardial da altre linee. Tuttavia, un numero crescente di prove hanno dimostrato che i marcatori epicardici non sono espresse esclusivamente nel epicardio. Ad esempio, Tbx18 è espresso nel miocardio del setto interventricolare (IVS) mentre WT1 è espresso nell'endotelio 19-21. Quindi, la purezza della popolazione di cellule epicardici isolato è discutibile. Al contrario, il metodo qui descritto cultura battedvantage della natura migratoria delle cellule epicardici. Ciò consente l'isolamento di una popolazione altamente pura di cellule epicardici come dimostrato da esperimenti di etichettatura genetici. Un altro modo per ottenere cellule epicardial sarebbe la differenziazione delle cellule staminali umane pluripotenti (hPSCs) in cellule epicardial modulando in primo luogo il BMP, WNT e percorsi di acido retinoico segnalazione. Queste cellule differenziate molto simili alle caratteristiche fisiche e molecolari di cellule embrionali epicardial. Essi non sono solo in grado di sottoporsi a EMT, ma sono anche in grado di differenziarsi in fibroblasti e cellule muscolari lisce 22,23. Anche se questo metodo è molto promettente, è significativamente più complicato e richiede tempo che la cultura epicardico descritto in questo documento.
Inoltre, questa tecnica di coltura non richiede attrezzature specializzate e un ulteriore configurazione coltura tissutale esistente è sufficiente. Pur seguendo questo protocollo, è fondamentale prestare special attenzione a non danneggiare l'epicardio con strumenti chirurgici durante il recupero del cuore. Inoltre, è fondamentale per orientare ventricolo escisso con il lato sezionato affaccio sulla superficie del gel di collagene o diapositiva camera per facilitare la migrazione cellulare epicardico. Infine, la coltura deve essere mantenuta con il minimo disturbo in modo da consentire l'espianto di aderire al piatto di coltura.
La popolazione di cellule ottenute può quindi essere utilizzato per eseguire una serie di esperimenti a valle che sarà ulteriormente la nostra comprensione della biologia cellulare epicardico. Coltura degli espianti su vetrini da camera fornisce monostrati epicardici per vari esperimenti, tra cui la proliferazione epicardico cellulare, la sopravvivenza, la migrazione, EMT e differenziazione in linee cardiaci. Esso fornisce inoltre l'opportunità di testare l'effetto dei farmaci sulle proprietà cellulari della dell'epicardio così come i cambiamenti di espressione genica associata al trattamento farmacologico. Inoltre, culturing dell'epicardio su gel di collagene permette l'analisi delle celle in una matrice 3D invece della matrice 2D tradizionale, che fornisce una illustrazione più accurata in vivo fisiologia.
Tuttavia, un inconveniente di questa tecnica è che questo metodo può essere utilizzato solo per le cellule cultura epicardial da cuori embrionali tra E11.5-E12.5. Durante successivamente la gestazione o nel periodo neonatale all'epicardio perde la capacità di proliferare e migrare. Così è difficile usare questo metodo coltura per isolare cellule epicardial dagli stadi embrionali successive o topi adulti.
Nonostante questa limitazione, questa tecnica utilizza abilità di coltura di base e di configurazione per facilitare la crescita di cellule epicardici ex vivo che sarebbe molto utile per lo studio della epicardio e suoi ruoli in sviluppo cardiaco e rigenerazione.
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
Questo lavoro è stato sostenuto da fondi da Duke-NUS Graduate Medical School di Singapore, Goh fondazione e Singapore NRF borsa di studio (NRF-NRFF2016-01) per Manvendra K. Singh.
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco’s modified Eagle’s medium (DMEM) | Life tech invitrogen | 11995065 | |
| Penicillin/streptomycin solution | Life tech invitrogen | 15140122 | |
| Fetal bovine serum (FBS) | Life tech invitrogen | 10500064 | |
| Paraformaldehyde | Sigma | P6148-5KG | |
| Recombinant fibroblast growth factor 2 (FGF2) | PeproTech | 450-33 | |
| Recombinant transforming growth factor beta 1 (TGF-β1) | PeproTech | 100-21 | |
| ZO-1 antibody | Life tech invitrogen | 40-2200 | |
| α-Tubulin antibody | Sigma | T 6074 | |
| α-smooth muscle actin (SMA) antibody | Sigma | A 2547 | |
| Phalloidin antibody | Life tech invitrogen | A12379 | |
| 3D Collagen Culture kit | Millipore | ECM 675 | |
| 8-well chamber slide | Fisher Scientific | NNU 154534-PK | |
| Trizol reagent | Life Technologies | 15596-018 | |
| ViiA 7 Real-Time PCR System | Life Technologies | 4453536 | |
| Superscript First Strand Synthesis kit | Life Technologies | 11904-018 |
References
- Mikawa, T., Fischman, D. A. Retroviral analysis of cardiac morphogenesis: discontinuous formation of coronary vessels. Proc Natl Acad Sci U S A. 89, 9504-9508 (1992).
- Mikawa, T., Gourdie, R. G. Pericardial mesoderm generates a population of coronary smooth muscle cells migrating into the heart along with ingrowth of the epicardial organ. Dev Biol. 174, 221-232 (1996).
- Manner, J., Perez-Pomares, J. M., Macias, D., Munoz-Chapuli, R. The origin, formation and developmental significance of the epicardium: a review. Cells Tissues Organs. 169, 89-103 (2001).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P., Mentink, M. M., Gourdie, R. G., Poelmann, R. E. Epicardium-derived cells contribute a novel population to the myocardial wall and the atrioventricular cushions. Circ Res. 82, 1043-1052 (1998).
- von Gise, A., Pu, W. T. Endocardial and epicardial epithelial to mesenchymal transitions in heart development and disease. Circ Res. 110, 1628-1645 (2012).
- Katz, T. C., et al. Distinct compartments of the proepicardial organ give rise to coronary vascular endothelial cells. Dev Cell. 22, 639-650 (2012).
- Singh, M. K., Lu, M. M., Massera, D., Epstein, J. A. MicroRNA-processing enzyme Dicer is required in epicardium for coronary vasculature development. J Biol Chem. 286, 41036-41045 (2011).
- Degenhardt, K., Singh, M. K., Epstein, J. A. New approaches under development: cardiovascular embryology applied to heart disease. J Clin Invest. 123, 71-74 (2013).
- Singh, M. K., Epstein, J. A. Epicardium-derived cardiac mesenchymal stem cells: expanding the outer limit of heart repair. Circ Res. 110, 904-906 (2012).
- Manner, J. Experimental study on the formation of the epicardium in chick embryos. Anat Embryol (Berl). 187, 281-289 (1993).
- Manner, J., Schlueter, J., Brand, T. Experimental analyses of the function of the proepicardium using a new microsurgical procedure to induce loss-of-proepicardial-function in chick embryos. Dev Dyn. 233, 1454-1463 (2005).
- Pennisi, D. J., Ballard, V. L., Mikawa, T. Epicardium is required for the full rate of myocyte proliferation and levels of expression of myocyte mitogenic factors FGF2 and its receptor, FGFR-1, but not for transmural myocardial patterning in the embryonic chick heart. Dev Dyn. 228, 161-172 (2003).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P., Bergwerff, M., Mentink, M. M., Poelmann, R. E. Epicardial outgrowth inhibition leads to compensatory mesothelial outflow tract collar and abnormal cardiac septation and coronary formation. Circ Res. 87, 969-971 (2000).
- Lavine, K. J., et al. Endocardial and epicardial derived FGF signals regulate myocardial proliferation and differentiation in vivo. Dev Cell. 8, 85-95 (2005).
- Merki, E., et al. Epicardial retinoid X receptor alpha is required for myocardial growth and coronary artery formation. Proc Natl Acad Sci U S A. 102, 18455-18460 (2005).
- Stuckmann, I., Evans, S., Lassar, A. B. Erythropoietin and retinoic acid, secreted from the epicardium, are required for cardiac myocyte proliferation. Dev Biol. 255, 334-349 (2003).
- Huang, G. N., et al. C/EBP transcription factors mediate epicardial activation during heart development and injury. Science. 338, 1599-1603 (2012).
- Zhou, B., et al. Adult mouse epicardium modulates myocardial injury by secreting paracrine factors. J Clin Invest. 121, 1894-1904 (2011).
- Christoffels, V. M., et al. Tbx18 and the fate of epicardial progenitors. Nature. 458, 8-9 (2009).
- Rudat, C., Kispert, A. Wt1 and epicardial fate mapping. Circ Res. 111, 165-169 (2012).
- Duim, S. N., Kurakula, K., Goumans, M. J., Kruithof, B. P. Cardiac endothelial cells express Wilms' tumor-1: Wt1 expression in the developing, adult and infarcted heart. J Mol Cell Cardiol. 81, 127-135 (2015).
- Iyer, D., et al. Robust derivation of epicardium and its differentiated smooth muscle cell progeny from human pluripotent stem cells. Development. 142, 1528-1541 (2015).
- Witty, A. D., et al. Generation of the epicardial lineage from human pluripotent stem cells. Nat Biotechnol. 32, 1026-1035 (2014).



