Introduction
実験データの富は、心外膜は、心臓の開発における重要なステップに影響を与えることが示されています。開発中に、横中隔はproepicardium 1-4として知られている中皮細胞の塊を生じさせます。 proepicardiumからの細胞は、次に移動して、心外膜を形成する心筋を包みます。これに続いて、心外膜細胞のサブセットは、その後、心筋に侵入心外膜由来細胞(EPDCs)の遊走集団を生じるEMTを起こします。実験トレース遺伝子、ならびにレトロウイルス系統はEPDCsは、平滑筋細胞、線維芽細胞、内皮細胞および心筋細胞(もしあれば)を含む種々の系統に分化することを実証しました。したがってEPDCsは、冠血管系および心筋アーキテクチャ1,2,4-9の発展に大きく貢献しています。さらに、心外膜は、心室緻密層10-12の発展のために不可欠です。 EのXAMPLE Gittenbergerドはグルートら proepicardiumの伸長を阻害することが、このような薄い心筋、心臓や異常心室中隔形成の欠損ループとして、その結果、胚致死13等の欠陥の配列につながることを実証しました。胚性心外膜から分泌パラクリン要因は、心筋細胞の増殖および分化を調節します。これと一致して、レチノイン酸(RA)、線維芽細胞増殖因子(FGF)およびWnt /βカテニンシグナル伝達経路などの心外膜特異的欠失は、欠陥のある心筋の増殖および胚致死14-16もたらしました。
心外膜は、大人の心の中に静止状態であると考えられていたが、最近の研究では、発達プログラムが心外傷17,18以下の心外膜に再活性化されることが示されています。活性化されると、細胞はEPDCの形成をもたらす急速な増殖およびEMTを起こします。これらの細胞は、capacitを示しますyは、線維芽細胞や平滑筋細胞ではなく、心筋細胞または内皮細胞18に分化します。また、EPDCsは、損傷部位の血管新生を助ける、したがって梗塞サイズを減少させることにより改善された心機能を促進する血管新生促進因子を分泌します。これらの知見に、心外膜は、心血管の開発、病気と再生の研究に関心を集めています。
トランスジェニック技術は、21世紀の医学研究に革命をもたらしました。トランスジェニック技術の助けを借りて、代謝および病態生理学的に人間の条件を模倣する病気のマウスモデルが正常に開発されています。しかし、これらの変異体における心外膜細胞の挙動を研究すると、初期胚致死性が主な原因課題でした。心外膜は、心臓の開発と再生に果たしていることが重要な役割を考えると、我々は、マウスの噴門上部のためのin vitro培養系を確立していますL細胞。この方法は、心外膜細胞の長期培養を可能にし、心外膜の二つの重要な特性の詳細な検討が容易:移行と分化する能力を。マウスから切除した心室は、遊走アッセイを実施するために使用することができるコラーゲンゲル上で培養することができます。より良い心外膜下の層のコラーゲンが豊富な細胞外マトリックスを複製インビボの細胞生理学を再現する3Dマトリックスで培養されています。あるいは、それらは、次いで、下流の適用の種々のために使用することができる心外膜単層を確立するために、チャンバースライド上で培養することができます。この単分子膜は、移行のために重要であるEMTを受ける心外膜の能力に関する洞察を提供するタイトジャンクションタンパク質を染色するために使用することができます。また、分化実験は、これらの細胞上で行うことができます。さらに、遺伝子発現プロファイルは、細胞からRNAを抽出することによって分析することができると定量的ポリメラーゼ連鎖反応(qPCR)を行います。最後に、単層はまた、潜在的な治療薬をテストするために、分子分析を行っ剤を用いて治療することができます。まとめると、この心外膜培養系は、視覚化し、心外膜の開発についての我々の理解をfurthers分子データを収集する機会を提供してくれます。
この方法の別の望ましい特徴は、それが簡単であり、いかなる精巧なセットアップを必要としないことです。簡単に言えば、胚は、心臓を摘出されたE11.5またはE12.5以下で収穫されています。心室はその後、コラーゲンゲルまたはチャンバースライドのいずれかで培養されます。その後、これらの細胞は、下流の実験を行うために使用することができます。
Subscription Required. Please recommend JoVE to your librarian.
Protocol
すべての実験は、デューク-NUS大学院医学部制度動物実験委員会によって承認されました。
1.胚性心室を取得
- 二酸化炭素ガスの供給または他の承認された安楽死の方法で安楽死チャンバーを用いて所望の胚段階(E11.5またはE12.5)で時限妊娠マウスを生け贄に捧げます。
- 解剖台に背の上にマウスを置きます。 70%エタノールで女性の腹部を消毒します。両手で皮膚を保持し、腹壁を露出するように引き離した後、腹の上に皮膚を持ち上げて、刃で小切開(1-2センチ)を作ります。
- 今、子宮角を露出させるために腹壁をカット。子宮角を持ち上げ、慎重に脂肪組織と子宮角に取り付けられた血管を切り取るために滅菌ピンセットを使用してください。子宮を取得するために、子宮頸部で切断。
- 無菌の冷たい1×リン酸バフを含むペトリ皿に子宮角を配置 ered生理食塩水(PBS)と優しく洗い流します。氷上のペトリ皿を置きます。
- 卵黄嚢の内部に残っていると、胎盤を通じて子宮壁に取り付けられた胚を露出させるために(胎盤が配置されているサイトとは反対側)の子宮角の正中線を切断するはさみを使用してください。
- 滅菌ピンセットを用いて、胚を解放するために、胚の卵黄嚢を切り開い。
- 滅菌冷たい1×PBSを含む新しいペトリ皿に胚を置きます。胚を刎ねると、その背中の上に置きます。心臓を露出するために胸壁を開いてカットします。
- 心を持ち上げ、胸の壁から心を解放するためにその周りに船を離れてカットする滅菌ピンセットを使用してください。手術ツールで心臓の心外膜に損傷を与えないように注意を払ってください。
- 流出路との両方の心房を切り落とします。冷たい1×PBSで別の皿に心室を転送します。氷の上の皿を置きます。
- 繰り返して、すべての心室が検索されるまで、1.6から1.9を繰り返します。
注意:文化ガラスチャンバースライド上または下流のアプリケーションのためのコラーゲンゲル上のいずれかのこれらの心外膜の外植片。
- ガラスチャンバースライド
- 、培地を調製したダルベッコ改変イーグル培地(DMEM)に10%ウシ胎児血清(FBS)、1%ペニシリン/ストレプトマイシンおよび2 ngの/ mlの組換え線維芽細胞増殖因子2(FGF2)を追加します。層流フード内のすべての手順を実行します。
- 8ウェルチャンバーの各ウェルに500μlの培地を追加します。
- ウェルの中央にそれぞれ切除した心室を置きます。東洋ウェルの底面を下に切開面を維持する脳室。
- 穏やかに37℃、5%CO 2細胞培養インキュベーター中でプレートを置きます。
- 外植片が付着することを可能にするために妨害を最小限にして文化を維持します。心外膜の単分子層の形成は、48〜72時間後に観察することができます。
- epicardの分化のために平滑筋細胞、培養をさらに6日間分化培地における心外膜単層細胞にIAL細胞。分化培地を調製するために、DMEMに10%FBS、1%ペニシリン/ストレプトマイシンおよび50 ngの/ mlの組換え型トランスフォーミング増殖因子β1(TGF-β1)を加えます。
- 日おきに培地を変更します。
- コラーゲンゲル
- 製造業者のプロトコルに従って、商業用3Dコラーゲン培養キットを用いて96ウェルプレート中のコラーゲンゲルを準備します。
- コラーゲンゲルの所望のボリュームを準備するには、上下DMEMとピペットの5倍とコラーゲン溶液の適量を混ぜます。溶液は黄色に変わります。
- 中和液の対応するボリュームを追加し、ピペッティングにより十分にすぐに混ぜます。解決策は、ピンク色に変わります。
- ピペット96ウェルプレートの各ウェルにこの混合物の100μlを。アルに30〜60分間、37℃、5%CO 2インキュベーターでプレートを置き低ゲルが重合します。
- 各ウェルに、上記の培養培地を200μlを追加します。
- ウェルの中央にそれぞれ切除した心室を置きます。オリエントコラーゲンゲル上で解剖側を下に保つために心室(心室の頂点が実験者に直面している必要があります)。そっと背中細胞培養インキュベーターでプレートを置きます。
- 3日後、心室を削除します。別の2日間、細胞培養インキュベーターにバックプレートを置きます。
- 日おきに培地を変更します。
3.固定と可視化
注:心外膜細胞を、ガラスチャンバースライド、またはコラーゲンゲルのいずれかで可視化することができます。
- 培地アウト吸引し、細胞を洗浄し、滅菌1×等量のPBSを追加します。
- セルをカバーするだけの十分な4%パラホルムアルデヒド(PFA)を加えます。 4℃で10分間細胞を固定。
- PFAを削除し、で1×PBST(1×PBSで外植片を洗います細胞を透過するため、0.1%トリトンX-100)。
- 所望の抗体( 例えば 、アレクサフルオロ488ファロイジン; ZO-1、αチューブリンおよびα平滑筋アクチン)とイムノ7。
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
この培養プロトコルを使用して、主要な心外膜細胞は、下流アプリケーションのための高純度で単離することができます。培養した細胞は、EMTを起こし移行し、心外膜細胞が生体内で同じよう分化することができます。
R26 トム/ +胚;当社の主要な心外膜細胞培養物の純度を決定するために、我々はSema3d GFPCre / +から生成された心外膜外植片を分析しました。 Sema3dは、このように、これらの胚に由来心外膜細胞が標識されたRFPになり、早期心臓発生中に心外膜細胞で発現されます。心外膜の外植片のためのR26 トム/ +胚;我々はSema3d GFPCre / +から心室を単離しました。 48〜72時間後、我々は、心外膜細胞の単層を見ることができました。 RFPの免疫蛍光および明視野画像を重ね合わすると、その過半数を示しました心室から移動した細胞の心外膜起源( - C 図1A)です。我々はさらに、一次心外膜細胞からRNAを単離し、心筋細胞マーカー遺伝子(Nkx2.5)( 図1C)とは対照的に、心外膜の特定の遺伝子(Tbx18およびWT1)の強い発現を示した定量PCRを行うことによって、我々の結果を検証しました。
次に、心外膜細胞の細胞極性および細胞 - 細胞接触を分析することにより、EMTを受ける細胞の能力を調べました。 EMTは、上皮細胞が遊走間葉細胞に形質転換するために、その細胞極性および細胞 - 細胞接触を失うことを可能にする生物学的プロセスです。 EMTの最初のステップは、細胞 - 細胞接触の剥離です。我々は、細胞が持っていることを示す形質膜にZO-1の局在を示した(またTjp1として知られている、密着結合タンパク質1)、ZO-1と心外膜細胞の免疫染色しましたまだEMT( 図2A)を受けること。心外膜細胞の指向性遊走を促進する偏光配向を示した心外膜外植片、中の微小管の組織を観察するために、次に我々は、αチューブリン( 図2B)のための免疫染色を行いました。また、心外膜細胞の分化能を決定するために、我々は、組換えTGF-β1を含有する分化培地で6日間それらを培養しました。 SMAの免疫染色は、平滑筋細胞( 図2C)に心外膜細胞の正常な分化を示しました。
最後に、心外膜由来細胞の遊走および心外膜EMTを分析するために、我々はまた、コラーゲンゲル浸潤アッセイを行いました。心外膜由来の細胞は、免疫染色をファロイジンで可視化しました。心外膜由来細胞の移行を成功さは、外植( 図3A)の周りのすべてを見ることができます。 Dを決定するために、コラーゲンマトリックスへの細胞侵入のepth、3次元再構成は、共焦点画像から生成されました。心外膜由来細胞の浸透は、zスタック( 図3B)に見ることができます。
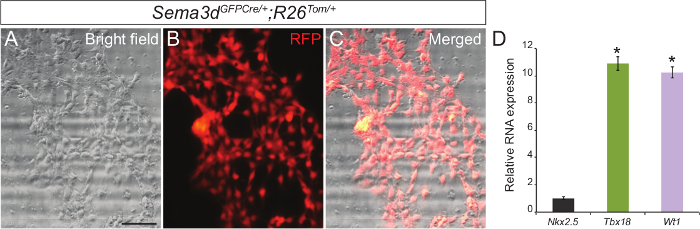
。 図1: マウス胎児ハーツから心外膜細胞の初代培養代表明(A)及びRFP免疫蛍光(B)E12.5 Sema3d GFPCre / +から生成される主心外膜細胞の画像; R26 トム/ +心。マージされた明視野および免疫蛍光画像(C)。主要な心外膜細胞(D)における相対心外膜マーカー(Tbx18およびWT1)のmRNA発現レベルと心筋マーカー(Nkx2.5)。結果は、GAPDH発現に対して標準化し、そして相対的な発現レベルは、Nkx2.5の発現と比較して倍の差として与えられた(n = 3)。データは、平均±SDとして提示されています。スケールバー=200μmです。 *、P <0.05。 この図の拡大版をご覧になるにはこちらをクリックしてください。
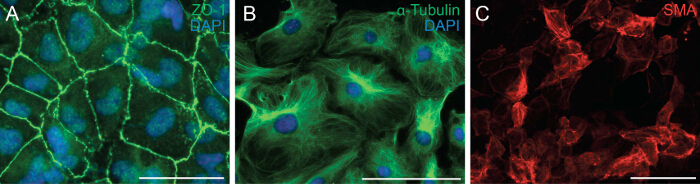
図2:一次心外膜細胞は、EMTおよび分化を受けるための能力を保持 ZO-1(A、緑)またはαチューブリン(B、緑)のための心外膜外植片に免疫染色します。 DAPIは核(青)を視覚化するために使用した。心外膜細胞を6日間、平滑筋細胞に分化し、α平滑筋アクチン(SMA)(C、赤)で染色しました。スケールバー=100μmです。3993fig2large.jpg "ターゲット=" _空白 ">この図の拡大版をご覧になるにはこちらをクリックしてください。

図 3: コラーゲンゲル表面上の心外膜細胞遊走心室E12.5胚からは、3次元コラーゲンゲルマトリックス上で培養し、心外膜由来細胞遊走および浸透(A)を可視化するために、アレクサフルオロ488ファロイジンで染色しました。共焦点画像は、z軸(B)に沿って細胞浸透を決定するために、三次元画像を構築するために使用しました。スケールバー=50μmである。 この図の拡大版をご覧になるにはこちらをクリックしてください。
Subscription Required. Please recommend JoVE to your librarian.
Discussion
心臓の開発と再生に心外膜の重要性が増しに応えるために心外膜の研究を容易にする技術を開発することが極めて重要です。心外膜培養系は、心外膜の研究のための重要な利点をもたらします。
心外膜細胞を単離する別の方法は、蛍光活性化細胞選別(FACS)を使用することです。この方法は、他の系統から心外膜細胞を分離するための心外膜マーカー(または蛍光タンパク質の心外膜細胞特異的トランスジェニック発現)の使用に依存しています。しかし、証拠の増加量は、心外膜マーカーがもっぱら心外膜に発現されないことを示しました。 WT1は、内皮19-21で発現されている間、例えば、Tbx18は心室中隔(IVS)の心筋で発現されます。したがって、単離された心外膜細胞の集団の純度は疑問です。対照的に、本明細書に記載の培養方法を取ります心外膜細胞の遊走性質のdvantage。私たちの遺伝的標識実験によって示されるように、これは心外膜細胞の高度に純粋な集団の単離を可能にします。心外膜細胞を得るための別の方法は、主に、BMP、Wntおよびレチノイン酸シグナル伝達経路を調節することによって心外膜細胞へのヒト多能性幹細胞(hPSCs)の分化です。これらの分化した細胞は密接に胚性心外膜細胞の物理的および分子的特徴に似ています。彼らはだけでなく、EMTを経験することができますが、また、線維芽細胞や平滑筋細胞22,23に分化することができます。この方法は非常に有望であるが、それはかなり複雑で時間本稿で説明した心外膜の文化よりもかかります。
また、この培養技術は、追加の特別な装置を必要とせず、既存の組織培養設定で十分です。このプロトコルに従いながら、sを払うことが重要です心を取得するときに手術ツールと心外膜に損傷を与えないようにpecial注意。また、心外膜細胞移動を容易にするためにコラーゲンゲルまたはチャンバースライドの表面のいずれかに面する切開面で切り出し心室を配向することが重要です。外植片を培養皿に付着することを可能にするように最後に、文化は最小限の妨害で維持されるべきです。
得られた細胞の集団は、その後、心外膜細胞生物学の理解を促進します下流の種々の実験を行うために使用することができます。チャンバースライド上に外植片を培養することは、心臓系統に心外膜細胞の増殖、生存、移動、EMTおよび分化を含む様々な実験のための心外膜の単層を提供します。それはまた、細胞の心外膜の特性ならびに薬物処置に関連した遺伝子発現の変化に対する薬物の効果を試験するための機会を提供します。また、Cuのコラーゲンゲル上で心外膜をlturingする代わりに、in vivoでの生理学のより正確な図を提供する従来の2Dマトリックス、の3次元マトリックス中の細胞の分析を可能にします。
しかし、この手法の欠点は、この方法は、E11.5-E12.5の間の胚の心臓からの培養心外膜細胞にのみ使用することができるであろう。後で妊娠中または新生児期に心外膜が増殖し、移行する能力を失います。したがって、後胚期または成体マウスから心外膜細胞を単離するために、この培養方法を使用することは困難です。
この制限にもかかわらず、この技術は心外膜と心臓の開発と再生におけるその役割を研究するために非常に有益であろうex vivoで心外膜細胞の成長を促進するために、基本的な培養スキルや設定を使用しています。
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
この作品は、DUKE-NUS大学院医学部シンガポール、Manvendra K.シンへゴー基盤とシンガポールNRFの交わり(NRF-NRFF2016-01)からの資金によってサポートされていました。
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco’s modified Eagle’s medium (DMEM) | Life tech invitrogen | 11995065 | |
| Penicillin/streptomycin solution | Life tech invitrogen | 15140122 | |
| Fetal bovine serum (FBS) | Life tech invitrogen | 10500064 | |
| Paraformaldehyde | Sigma | P6148-5KG | |
| Recombinant fibroblast growth factor 2 (FGF2) | PeproTech | 450-33 | |
| Recombinant transforming growth factor beta 1 (TGF-β1) | PeproTech | 100-21 | |
| ZO-1 antibody | Life tech invitrogen | 40-2200 | |
| α-Tubulin antibody | Sigma | T 6074 | |
| α-smooth muscle actin (SMA) antibody | Sigma | A 2547 | |
| Phalloidin antibody | Life tech invitrogen | A12379 | |
| 3D Collagen Culture kit | Millipore | ECM 675 | |
| 8-well chamber slide | Fisher Scientific | NNU 154534-PK | |
| Trizol reagent | Life Technologies | 15596-018 | |
| ViiA 7 Real-Time PCR System | Life Technologies | 4453536 | |
| Superscript First Strand Synthesis kit | Life Technologies | 11904-018 |
References
- Mikawa, T., Fischman, D. A. Retroviral analysis of cardiac morphogenesis: discontinuous formation of coronary vessels. Proc Natl Acad Sci U S A. 89, 9504-9508 (1992).
- Mikawa, T., Gourdie, R. G. Pericardial mesoderm generates a population of coronary smooth muscle cells migrating into the heart along with ingrowth of the epicardial organ. Dev Biol. 174, 221-232 (1996).
- Manner, J., Perez-Pomares, J. M., Macias, D., Munoz-Chapuli, R. The origin, formation and developmental significance of the epicardium: a review. Cells Tissues Organs. 169, 89-103 (2001).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P., Mentink, M. M., Gourdie, R. G., Poelmann, R. E. Epicardium-derived cells contribute a novel population to the myocardial wall and the atrioventricular cushions. Circ Res. 82, 1043-1052 (1998).
- von Gise, A., Pu, W. T. Endocardial and epicardial epithelial to mesenchymal transitions in heart development and disease. Circ Res. 110, 1628-1645 (2012).
- Katz, T. C., et al. Distinct compartments of the proepicardial organ give rise to coronary vascular endothelial cells. Dev Cell. 22, 639-650 (2012).
- Singh, M. K., Lu, M. M., Massera, D., Epstein, J. A. MicroRNA-processing enzyme Dicer is required in epicardium for coronary vasculature development. J Biol Chem. 286, 41036-41045 (2011).
- Degenhardt, K., Singh, M. K., Epstein, J. A. New approaches under development: cardiovascular embryology applied to heart disease. J Clin Invest. 123, 71-74 (2013).
- Singh, M. K., Epstein, J. A. Epicardium-derived cardiac mesenchymal stem cells: expanding the outer limit of heart repair. Circ Res. 110, 904-906 (2012).
- Manner, J. Experimental study on the formation of the epicardium in chick embryos. Anat Embryol (Berl). 187, 281-289 (1993).
- Manner, J., Schlueter, J., Brand, T. Experimental analyses of the function of the proepicardium using a new microsurgical procedure to induce loss-of-proepicardial-function in chick embryos. Dev Dyn. 233, 1454-1463 (2005).
- Pennisi, D. J., Ballard, V. L., Mikawa, T. Epicardium is required for the full rate of myocyte proliferation and levels of expression of myocyte mitogenic factors FGF2 and its receptor, FGFR-1, but not for transmural myocardial patterning in the embryonic chick heart. Dev Dyn. 228, 161-172 (2003).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P., Bergwerff, M., Mentink, M. M., Poelmann, R. E. Epicardial outgrowth inhibition leads to compensatory mesothelial outflow tract collar and abnormal cardiac septation and coronary formation. Circ Res. 87, 969-971 (2000).
- Lavine, K. J., et al. Endocardial and epicardial derived FGF signals regulate myocardial proliferation and differentiation in vivo. Dev Cell. 8, 85-95 (2005).
- Merki, E., et al. Epicardial retinoid X receptor alpha is required for myocardial growth and coronary artery formation. Proc Natl Acad Sci U S A. 102, 18455-18460 (2005).
- Stuckmann, I., Evans, S., Lassar, A. B. Erythropoietin and retinoic acid, secreted from the epicardium, are required for cardiac myocyte proliferation. Dev Biol. 255, 334-349 (2003).
- Huang, G. N., et al. C/EBP transcription factors mediate epicardial activation during heart development and injury. Science. 338, 1599-1603 (2012).
- Zhou, B., et al. Adult mouse epicardium modulates myocardial injury by secreting paracrine factors. J Clin Invest. 121, 1894-1904 (2011).
- Christoffels, V. M., et al. Tbx18 and the fate of epicardial progenitors. Nature. 458, 8-9 (2009).
- Rudat, C., Kispert, A. Wt1 and epicardial fate mapping. Circ Res. 111, 165-169 (2012).
- Duim, S. N., Kurakula, K., Goumans, M. J., Kruithof, B. P. Cardiac endothelial cells express Wilms' tumor-1: Wt1 expression in the developing, adult and infarcted heart. J Mol Cell Cardiol. 81, 127-135 (2015).
- Iyer, D., et al. Robust derivation of epicardium and its differentiated smooth muscle cell progeny from human pluripotent stem cells. Development. 142, 1528-1541 (2015).
- Witty, A. D., et al. Generation of the epicardial lineage from human pluripotent stem cells. Nat Biotechnol. 32, 1026-1035 (2014).



