Introduction
실험 데이터의 재산은 심장 외막은 심장 개발에 중요한 단계에 영향을 미치는 것을 설명했다. 개발하는 동안, 격벽 transversum는 proepicardium 1-4라고도 중피 세포 덩어리를 일으킨다. proepicardium의 세포는 마이그레이션 및 심장 외막을 형성 심근 봉투. 이 후, 심 외막 세포의 일부는 이후 심근을 침범 심장 외막 유래 세포 (EPDCs)의 철새 인구 EMT주는 상승을 받다. 실험 추적 유전자뿐만 아니라 레트로 바이러스 계보 EPDCs가 평활근 세포, 섬유 아세포, 내피 세포 및 심근 (있는 경우)를 포함한 다양한 계통으로 분화 것을 증명했다. 따라서 EPDCs는 관상 동맥 혈관과 심근 아키텍처 1,2,4-9의 발전에 크게 기여하고 있습니다. 또한, 상기 외막은 심실 컴팩트 10-12 층의 개발이 필수적이다. 전자의 경우xample Gittenberger - 드 그루 등. proepicardium의 생장을 억제하는 등의 얇은 심근, 심장과 비정상적인 심실 중격 형성의 부족 루프로 그 결과, 배아 치사 (13) 결함의 배열에 이르게 것을 보여 주었다. 배아 심장 외막에서 분비 분비 인자는 심근 세포의 증식과 분화를 조절한다. 이과 일치, 같은 레티노 산 (RA), 섬유 아세포 성장 인자 (FGFs)과의 Wnt / β-catenin이 같은 신호 전달 경로의 심장 외막 특정 삭제에 결함이 심근 성장과 배아 치사 14-16의 결과.
심장 외막이 성인의 마음에 대기 것으로 생각되었지만, 최근의 연구는 발달 프로그램은 심장 부상 17, 18 다음 심장 외막에 활성화되는 것으로 나타났습니다. 활성화되면, 세포 EPDC 형성 될 급속한 증식과 EMT를 겪는다. 이러한 세포는 capacit 전시Y는 섬유 아세포 및 평활근 세포가 아니라 심근 세포 또는 혈관 내피 세포 (18)로 분화한다. 또한 EPDCs는 손상된 영역의 혈관에서 지원하므로이 경색 크기를 감소시킴으로써 개선 된 심장 기능을 촉진한다는 proangiogenic 인자를 분비한다. 때문에 이러한 결과로, 심장 외막은 심장 혈관 개발, 질병 및 재생 연구에 대한 관심을 얻고있다.
형질 전환 기술은 21 세기 의학 연구에 혁명을했다. 형질 전환 기술의 도움으로 대사 및 pathophysiologically 인간 조건을 모방 질환 마우스 모델이 성공적으로 개발되었다. 그러나, 이러한 돌연변이 체의 심 외막 세포의 행동을 연구하는 것은 초기 배아 치사에 주로 도전하고있다. 심장 외막은 심장 개발 및 재생에서 활약하는 중요한 역할을 고려할 때, 우리는 마우스 epicardia에 대한 체외 배양 시스템을 확립리터 세포. 이 방법은 심 외막 세포의 장기 배양이 가능하고 외막의 두 가지 중요한 특성의 상세한 연구를 용이하게한다 : 이동 및 분화하는 능력. 마우스에서 적출 심실은 마이그레이션 분석을 수행하는 데 사용할 수있는 콜라겐 겔상에서 배양 될 수있다. 더 subepicardial 층의 콜라겐이 풍부한 세포 외 기질을 복제하는 생체 세포 생리학을 되풀이되었습니다 차원 매트릭스에서 배양된다. 대안들은 다음 하류 다양한 용도에 사용할 수있는 외막 단층을 설정하기 위해 챔버 슬라이드상에서 배양 될 수있다. 이 단분자막은 마이그레이션 중요 EMT를 받아야하는 심장 외막의 능력에 대한 통찰력을 제공한다 꽉 접합 단백질 염색하기 위해 사용될 수있다. 또한, 분화 실험은 이러한 세포상에서 수행 될 수있다. 또한, 유전자 발현 프로파일을 세포로부터 RNA를 추출하여 분석 할 수 있고,정량적 폴리머 라제 연쇄 반응 (qPCR에)을 수행. 마지막으로, 단일 층은 잠재적 인 치료제를 테스트하는 분자 분석 하였다 제로 처리 될 수있다. 함께 넣어,이 심 외막 문화 시스템은 시각화 및 심 외막 개발에 대한 우리의 이해를 발전한다 분자 데이터를 수집 할 수있는 기회를 우리에게 제공한다.
이 방법의 또 다른 바람직한 특징은 간단하고 더 복잡한 설정이 필요하지 않다는 것이다. 간단히, 배아는 심장이 절제되어 E11.5 또는 E12.5 다음에 수확된다. 심실은 콜라겐 젤 또는 챔버 슬라이드 중 하나에 배양. 이어서, 이들 세포는 하류 실험을 수행 할 수있다.
Subscription Required. Please recommend JoVE to your librarian.
Protocol
모든 실험은 듀크 - NUS 대학원 의과 대학 기관 동물 관리 및 사용위원회에 의해 승인되었습니다.
1. 배아 심실 가져
- 탄산 가스 공급 장치 또는 다른 승인 안락사 법으로 안락사 챔버를 사용하여 원하는 배아 단계 (E11.5 또는 E12.5)에서 타이밍 임신 마우스를 희생한다.
- 해부 테이블에 그 뒷면에 마우스를 놓습니다. 70 % 에탄올로 여성의 복부를 소독. 배꼽을 통해 피부를 들어 올려 블레이드와 작은 절개 (1-2cm)를 확인 후, 두 손으로 피부를 유지하고 복부 벽을 노출 멀리 당기십시오.
- 이제 자궁 경적을 노출하는 복벽을 잘라. 자궁 뿔을 들어 올려 멸균 집게를 사용하여 조심스럽게 자궁에 부착 된 지방 조직과 혈관을 절단. 자궁 경부에서 절단하여 자궁을 검색 할 수 있습니다.
- 멸균 차가운 1X 인산 버프를 포함하는 배양 접시에 자궁 경적을 배치 겹으로 식염수 (PBS) 부드럽게 씻어. 얼음에 페트리 접시를 놓습니다.
- 난황 내부에 여전히 및 태반을 통해 자궁 벽에 부착 된 배아를 노출 (반대 태반이있는 사이트) 자궁 뿔의 중간 선을 잘라 가위를 사용합니다.
- 멸균 집게를 사용하여 배아를 무료로 배아 난황을 자르면.
- 멸균 차가운 1X PBS를 포함하는 새로운 배양 접시에서 배아를 놓습니다. 배아 목을 벨과 뒷면에 배치합니다. 심장을 노출 가슴 벽을 자르면.
- 마음을 들어 올려 가슴 벽에서 마음을 무료로 주변의 혈관을 절단하기 위해 멸균 집게를 사용합니다. 수술 도구를 사용하여 심장의 심장 외막이 손상되지 않도록 특별한주의를 기울이십시오.
- 유출 관 모두 심방을 낸다. 차가운 1X PBS와 다른 요리에 심실을 전송합니다. 얼음 접시를 놓습니다.
- 반복 모든 심실이 검색됩니다 때까지 1.6-1.9 단계를 반복합니다.
참고 : 문화 유리 챔버 슬라이드 또는 다운 스트림 애플리케이션을위한 콜라겐 겔에 하나이 심 외막 외식.
- 유리 챔버 슬라이드
- 상기 배양 배지를 준비하는 둘 베코 변형 이글 배지 (DMEM)에 10 % 소 태아 혈청 (FBS), 1 % 페니실린 / 스트렙토 마이신이 NG / ml의 재조합 섬유 아세포 성장 인자 2 (FGF2)를 추가한다. 층류 후드의 모든 단계를 수행한다.
- 8 잘 챔버의 각 웰에 500 ㎕의 배양 배지를 추가합니다.
- 잘의 중심에 각 절제 심실를 놓습니다. 웰의 바닥면 아래로 절개면을 유지하는 심실의 방향.
- 조심스럽게 37 ° C, 5 % CO 2 세포 배양 인큐베이터에서 접시를 넣어.
- 외식을 준수 할 수 있도록 최소한의 방해와 문화를 유지한다. 심 외막 단분자막의 형성은 48 ~ 72 시간 후에 관찰 할 수있다.
- epicard의 차별화평활근 세포 배양을위한 다른 6일 분화 배지에서 단층 세포 외막에 IAL 세포. 상기 분화 배지 DMEM을 준비하고, 10 % FBS, 1 % 페니실린 / 스트렙토 마이신 및 50 ng의 / ml의 재조합 변형 성장 인자 베타 1 (TGF-β1)를 추가한다.
- 다른 일에 배양 배지를 변경합니다.
- 콜라겐 젤
- 제조사의 프로토콜에 따라 상업적 3D 콜라겐 배양 키트를 사용하여 96- 웰 플레이트에서 콜라겐 겔을 준비한다.
- 콜라겐 겔의 원하는 부피를 제조 DMEM의 5 배와 피펫 상하로 콜라겐 용액의 적당량을 혼합한다. 이 솔루션은 노란색 설정해야합니다.
- 중화 액의 대응 볼륨을 추가로 pipetting 아래로 잘 즉시 섞는다. 이 솔루션은 분홍색으로 바뀝니다.
- 피펫 96- 웰 플레이트의 각 웰에이 혼합물을 100 ㎕. 알을 30-60 분 동안 37 ° C, 5 % CO 2 인큐베이터에서 플레이트를 놓고낮은 겔 중합합니다.
- 각 웰에 전술 배양 배지 200 μl를 추가합니다.
- 잘의 중심에 각 절제 심실를 놓습니다. 동양은 심실은 (실험자에 직면해야 심실의 정점) 콜라겐 젤의 절개면을 아래로 유지합니다. 조심스럽게 다시 세포 배양 인큐베이터에서 접시를 넣어.
- 삼일 후, 심실를 제거합니다. 또 다른 2 일간 세포 배양 인큐베이터에 다시 접시를 넣어.
- 다른 일에 배양 배지를 변경합니다.
3. 고정 및 시각화
주 : 외막 세포를 유리 슬라이드 챔버 또는 콜라겐 겔 하나에 가시화 될 수있다.
- 문화 미디어 대기음하고 세포를 씻어 살균 1X PBS의 동일한 볼륨을 추가합니다.
- 세포를 충당하기 위해 충분한 4 % 파라 포름 알데히드 (PFA)를 추가합니다. 4 ° C에서 10 분 동안 세포를 고정합니다.
- PFA를 제거하고 1X PBST (와 1X PBS와 함께 외식을 씻어0.1 % 트리톤 X-100) 세포 Permeabilize 하시려면한다.
- 원하는 항체 (예를 들어, 알렉사 플 루어 488 - 팔로이 딘, ZO-1, α-튜 불린과 α - 평활근 액틴)를 발현 사이 7.
Subscription Required. Please recommend JoVE to your librarian.
Representative Results
이 배양 프로토콜을 사용하여, 주 외막 세포 하류 애플리케이션 고순도로 분리 할 수있다. 배양 된 세포는 EMT를 받아야 마이그레이션 및 심 외막 세포가 생체 내에서와 마찬가지로 구별 할 수 있습니다.
우리의 기본 심 외막 세포 배양의 순도를 결정하기 위해, 우리는 Sema3d GFPCre / +에서 발생하는 심 외막 외식을 분석, R26 톰 / + 배아. Sema3d 따라서, 조기 심장 개발하는 동안 심 외막 세포에 RFP 표시됩니다 이러한 배아에서 파생 된 심 외막 세포를 표현한다. 심 외막 외식에 대한 R26 톰 / + 배아, 우리는 Sema3d GFPCre / +에서 심실입니다. 48-72 시간 후에는 외막 세포 단층을 볼 수 있었다. RFP에의 면역 및 시야 이미지를 중첩하는 것은 대부분의 것을 보여 주었다심실에서 마이그레이션 세포의 심 외막 원점 (- C 그림 1A)의이다. 우리는 더 차 심 외막 세포에서 RNA를 분리하고 심근 마커 유전자 (Nkx2.5) (그림 1C)에 반대 심 외막 특정 유전자 (Tbx18 및 WT1)의 강한 표현을 보여 주었다 qPCR에를 수행하여 우리의 결과를 확인.
다음으로 외막 세포의 세포 극성 및 세포 - 세포 접촉을 분석하여 EMT를 받아야하는 세포의 능력을 조사 하였다. EMT는 상피 세포가 철새 중간 엽 세포로 변환하기 위해 그 세포 극성 및 세포 - 세포 접촉을 잃게 할 수있는 생물학적 과정이다. EMT의 첫 번째 단계는 세포 - 세포 접촉의 분리이다. 우리는 세포가 나타내는 원형질막에 ZO-1의 위치 파악을 보였다 (도 Tjp1라고도 밀착 연접 단백질 1) ZO-1 외막 세포를 면역 염색아직 EMT (그림 2A)를 받아야합니다. 다음에 우리는 심 외막 세포의 방향 이동을 용이하게하는 편광 정렬을 보여 주었다 심 외막 외식의 미세 소관의 조직을 관찰하기 위해 α-tubulin의 (그림 2B)에 대한 면역 염색을 수행. 또한, 외막 세포의 분화 잠재 성을 결정하기 위해, 우리는 재조합 TGF-β1을 함유하는 분화 배지 6 일간을 배양 하였다. SMA에 대한 면역 염색은 평활근 세포 (그림 2C)에 심 외막 세포의 성공적인 차별화를 보여 주었다.
마지막으로, 심장 외막 유래 세포 이동 및 심 외막 EMT를 분석하기 위해, 우리는 또한 콜라겐 겔 침윤 분석을 수행 하였다. 심장 외막 유래 세포를 면역 염색을 Phalloidin의 시각화 하였다. 심장 외막 유래 세포의 성공적인 마이그레이션은 이식편 (그림 3A) 주위를 볼 수 있습니다. 는 D를 확인하려면콜라겐 매트릭스에 세포 침투 epth는, 3 차원 재구성 공 초점 이미지에서 생성되었습니다. 심장 외막에서 유래 세포의 침투는 Z-스택 (도 3B)에서 볼 수있다.
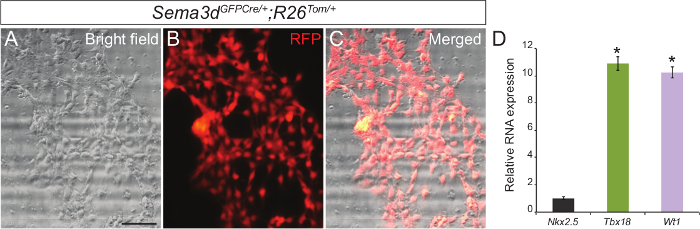
. 그림 1 : 배아 마우스 마음에서 심 외막 세포의 차 문화 대표 브라이트 (A) 및 RFP 면역 (B) E12.5 Sema3d GFPCre / +에서 생성 된 기본 심 외막 세포의 이미지, R26 톰 / + 마음입니다. 합병 시야 및 면역 형광 이미지 (C). 심 외막 마커 (Tbx18 및 WT1) 및 주 외막 세포 (D)에서 심근 마커 (Nkx2.5)의 상대적인 mRNA 발현 수준. 결과는 GAPDH의 발현을 정규화하고 있었다 상대적 발현 수준이 Nkx2.5의 발현에 비해 배 차이로 주어진다 (N = 3). 데이터는 평균 ± 표준 편차로 표시됩니다. 스케일 바 = 200 μm의. * P <0.05. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
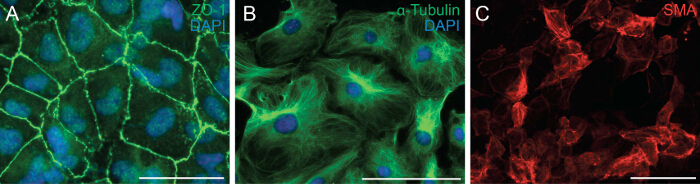
그림 2 :. 기본 심 외막 세포 (녹색, B) ZO-1 (A, 녹색) 또는 α-tubulin에 대한 심 외막 외식에 EMT와 차별화 면역 염색을받을 수있는 능력을 유지. DAPI는 핵 (파란색)를 시각화하는 데 사용되었다. 심 외막 세포를 6 일 동안 평활근 세포로 분화 및 α-평활근 액틴 (SMA) (적색 C)으로 염색 하였다. 스케일 바 = 100 μm의.3993fig2large.jpg "대상 ="_ 빈 ">이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3 :. 콜라겐 젤 표면에 심 외막 세포 마이그레이션 E12.5 배아에서 심실는 세 차원 콜라겐 겔 매트릭스에 배양 및 심장 외막 유래 세포의 이동과 침투 (A)를 시각화하는 알렉사 플 루어 488 - 팔로이 딘 염색. 공 촛점 이미지는 Z 축 (B)을 따라 세포 침투를 결정하는 입체 화상을 구성하는 데 사용 하였다. 스케일 바 = 50 μm의. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
Subscription Required. Please recommend JoVE to your librarian.
Discussion
심장 개발과 재생의 심장 외막의 증가 중요성에 부응하기 위해 심장 외막의 연구를 촉진 기술을 개발하는 것이 중요한 것입니다. 심 외막 문화 시스템은 심 외막 연구에 상당한 이점을 포즈.
심 외막 세포를 분리하는 다른 방법은 형광 활성화 세포 분류 (FACS)를 사용하는 것이다. 이 방법은, 다른 계통에서 외막 세포를 분리하는 외막 마커 (또는 형광 단백질의 심장 외막 세포 특이 적 유전자 발현)의 사용에 의존한다. 그러나, 증거의 증가 금액은 심 외막 마커가 독점적으로 심장 외막에 표시되지 않는 것으로 나타났습니다. WT1은 내피 19-21로 표시되어 예를 들어, Tbx18가 심실 중격 (IVS)의 심근 표현된다. 따라서, 절연 심 외막 세포 집단의 순도는 의문이다. 대조적으로, 본원에 기술 된 배양 방법을 취하는심 외막 세포의 철새 자연의 dvantage. 우리 유전자 표지 실험으로 나타낸 바와 같이이 외막 세포 고순도 인구의 분리를 가능하게한다. 심 외막 세포를 수득하는 또 다른 방법은 주로 BMP, WNT 레티노 산 및 신호 전달 경로를 조절함으로써 심 외막 세포로 인간 다 능성 줄기 세포 (hPSCs)의 분화 될 것이다. 이 분화 된 세포는 밀접 배아 심 외막 세포의 물리적 및 분자 특성을 닮은. 이들은 단지 EMT를 겪을 수뿐만 아니라 섬유 아세포 및 평활근 세포 (22, 23)로 분화 할 수있다. 이 방법은 매우 유망한이지만, 그것은 훨씬 더 복잡하고 시간이 논문에 기술 된 심 외막 문화보다 소요됩니다.
또한,이 배양 기술은 추가적인 특수 장비를 필요로하지 않고 기존의 조직 배양 설치 충분하다. 이 프로토콜에 따라 반면, (S)를 지불 할 중요마음을 검색 할 때 pecial 관심 수술 도구를 사용하여 심장 외막에 손상을주지합니다. 또한, 해부 측 외막 세포 이동을 용이하게하기 위하여 콜라겐 겔 또는 챔버 슬라이드의 표면 중 하나를 향하도록 절제 심실 배향하는 것이 중요하다. 이식편은 배양 접시에 부착 할 수 있도록하기 위해 마지막으로, 문화는 최소한의 방해로 유지되어야한다.
얻어진 세포 집단은 심 외막 세포 생물학의 이해를 촉진한다 하류 다양한 실험을 수행 할 수있다. 챔버 슬라이드에 외식을 배양하는 것은 심장 계통에 심 외막 세포 증식, 생존, 마이그레이션, EMT 및 차별화 등 다양한 실험 심 외막 단일 층을 제공합니다. 또한, 약물 치료와 연관된 심장 외막 세포의 특성에 대한 약물의 효과를 시험하는 기회뿐만 아니라, 유전자 발현의 변화를 제공한다. 또한, CU콜라겐 겔에서 외막을 lturing 것은 3D 행렬 대신 생체 내 생리에 대한보다 정확한 그림을 제공하는 기존의 2 차원 매트릭스에서 세포의 분석을 가능하게한다.
그러나,이 기술의 단점은,이 방법은 E11.5-E12.5 사이 배아 마음에서 배양 세포 외막에 사용될 수 있다는 것이다. 나중에 임신 중 또는 신생아 기간에 심장 외막은 증식 및 마이그레이션 할 수있는 기능을 잃는다. 따라서, 이후 단계 배아 또는 성체 생쥐에서 심 외막 세포를 분리하기 위해 배양 방법을 사용하는 것이 곤란하다.
이러한 제한에도 불구하고,이 기술은 심장 외막과 심장 개발 및 재생에서의 역할에 대한 연구에 매우 도움이 될 것입니다 심 외막 세포 생체의 성장을 촉진하기 위해 기본 배양 기술 및 설정을 사용합니다.
Subscription Required. Please recommend JoVE to your librarian.
Acknowledgments
이 작품은 DUKE-NUS 대학원 의과 대학 싱가포르, Manvendra K. 싱에 총리 재단, 싱가포르 NRF의 교제 (NRF-NRFF2016-01)에서 기금에 의해 지원되었다.
Materials
| Name | Company | Catalog Number | Comments |
| Dulbecco’s modified Eagle’s medium (DMEM) | Life tech invitrogen | 11995065 | |
| Penicillin/streptomycin solution | Life tech invitrogen | 15140122 | |
| Fetal bovine serum (FBS) | Life tech invitrogen | 10500064 | |
| Paraformaldehyde | Sigma | P6148-5KG | |
| Recombinant fibroblast growth factor 2 (FGF2) | PeproTech | 450-33 | |
| Recombinant transforming growth factor beta 1 (TGF-β1) | PeproTech | 100-21 | |
| ZO-1 antibody | Life tech invitrogen | 40-2200 | |
| α-Tubulin antibody | Sigma | T 6074 | |
| α-smooth muscle actin (SMA) antibody | Sigma | A 2547 | |
| Phalloidin antibody | Life tech invitrogen | A12379 | |
| 3D Collagen Culture kit | Millipore | ECM 675 | |
| 8-well chamber slide | Fisher Scientific | NNU 154534-PK | |
| Trizol reagent | Life Technologies | 15596-018 | |
| ViiA 7 Real-Time PCR System | Life Technologies | 4453536 | |
| Superscript First Strand Synthesis kit | Life Technologies | 11904-018 |
References
- Mikawa, T., Fischman, D. A. Retroviral analysis of cardiac morphogenesis: discontinuous formation of coronary vessels. Proc Natl Acad Sci U S A. 89, 9504-9508 (1992).
- Mikawa, T., Gourdie, R. G. Pericardial mesoderm generates a population of coronary smooth muscle cells migrating into the heart along with ingrowth of the epicardial organ. Dev Biol. 174, 221-232 (1996).
- Manner, J., Perez-Pomares, J. M., Macias, D., Munoz-Chapuli, R. The origin, formation and developmental significance of the epicardium: a review. Cells Tissues Organs. 169, 89-103 (2001).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P., Mentink, M. M., Gourdie, R. G., Poelmann, R. E. Epicardium-derived cells contribute a novel population to the myocardial wall and the atrioventricular cushions. Circ Res. 82, 1043-1052 (1998).
- von Gise, A., Pu, W. T. Endocardial and epicardial epithelial to mesenchymal transitions in heart development and disease. Circ Res. 110, 1628-1645 (2012).
- Katz, T. C., et al. Distinct compartments of the proepicardial organ give rise to coronary vascular endothelial cells. Dev Cell. 22, 639-650 (2012).
- Singh, M. K., Lu, M. M., Massera, D., Epstein, J. A. MicroRNA-processing enzyme Dicer is required in epicardium for coronary vasculature development. J Biol Chem. 286, 41036-41045 (2011).
- Degenhardt, K., Singh, M. K., Epstein, J. A. New approaches under development: cardiovascular embryology applied to heart disease. J Clin Invest. 123, 71-74 (2013).
- Singh, M. K., Epstein, J. A. Epicardium-derived cardiac mesenchymal stem cells: expanding the outer limit of heart repair. Circ Res. 110, 904-906 (2012).
- Manner, J. Experimental study on the formation of the epicardium in chick embryos. Anat Embryol (Berl). 187, 281-289 (1993).
- Manner, J., Schlueter, J., Brand, T. Experimental analyses of the function of the proepicardium using a new microsurgical procedure to induce loss-of-proepicardial-function in chick embryos. Dev Dyn. 233, 1454-1463 (2005).
- Pennisi, D. J., Ballard, V. L., Mikawa, T. Epicardium is required for the full rate of myocyte proliferation and levels of expression of myocyte mitogenic factors FGF2 and its receptor, FGFR-1, but not for transmural myocardial patterning in the embryonic chick heart. Dev Dyn. 228, 161-172 (2003).
- Gittenberger-de Groot, A. C., Vrancken Peeters, M. P., Bergwerff, M., Mentink, M. M., Poelmann, R. E. Epicardial outgrowth inhibition leads to compensatory mesothelial outflow tract collar and abnormal cardiac septation and coronary formation. Circ Res. 87, 969-971 (2000).
- Lavine, K. J., et al. Endocardial and epicardial derived FGF signals regulate myocardial proliferation and differentiation in vivo. Dev Cell. 8, 85-95 (2005).
- Merki, E., et al. Epicardial retinoid X receptor alpha is required for myocardial growth and coronary artery formation. Proc Natl Acad Sci U S A. 102, 18455-18460 (2005).
- Stuckmann, I., Evans, S., Lassar, A. B. Erythropoietin and retinoic acid, secreted from the epicardium, are required for cardiac myocyte proliferation. Dev Biol. 255, 334-349 (2003).
- Huang, G. N., et al. C/EBP transcription factors mediate epicardial activation during heart development and injury. Science. 338, 1599-1603 (2012).
- Zhou, B., et al. Adult mouse epicardium modulates myocardial injury by secreting paracrine factors. J Clin Invest. 121, 1894-1904 (2011).
- Christoffels, V. M., et al. Tbx18 and the fate of epicardial progenitors. Nature. 458, 8-9 (2009).
- Rudat, C., Kispert, A. Wt1 and epicardial fate mapping. Circ Res. 111, 165-169 (2012).
- Duim, S. N., Kurakula, K., Goumans, M. J., Kruithof, B. P. Cardiac endothelial cells express Wilms' tumor-1: Wt1 expression in the developing, adult and infarcted heart. J Mol Cell Cardiol. 81, 127-135 (2015).
- Iyer, D., et al. Robust derivation of epicardium and its differentiated smooth muscle cell progeny from human pluripotent stem cells. Development. 142, 1528-1541 (2015).
- Witty, A. D., et al. Generation of the epicardial lineage from human pluripotent stem cells. Nat Biotechnol. 32, 1026-1035 (2014).



